Приготовление рабочего раствора кислот и щелочей из концентрированных растворов
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Государственное образовательное учреждение высшего профессионального образования
«Тюменский государственный нефтегазовый университет»
Институт транспорта
Кафедра ОиСХ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к контрольным заданиям по дисциплине «Химия»
для студентов нехимических специальностей
заочной формы обучения
часть II
Тюмень 2003
Утверждено редакционно-издательским советом
Тюменского государственного нефтегазового университета
Составители: доцент к. х. н. Андрианова Л. И.
доцент к. х. н. Пнёва А. П.
доцент, к. х. н., Обухов В. М.
© Государственное образовательное учреждение высшего профессионального образования
«Тюменский государственный нефтегазовый университет»
2003 г.
РАСТВОРЫ
Способы выражения концентрации раствора
Растворы имеют важное значение в жизни и практической деятельности человека. Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов. Растворомназывается твердая или жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких приделах. Наиболее важный вид растворов – жидкие растворы.
Всякий раствор состоит из растворенных веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Обычно растворителями считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Растворение является обратимым процессом. Когда скорость растворения кристаллического вещества, становится равной обратному процессу, процессу кристаллизации, наступает динамическое равновесие, при котором в единицу времени столько же молекул растворяется, сколько и выделяется из раствора. Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором. Насыщенными растворами приходится пользоваться сравнительно редко. В большинстве случаев употребляют растворы ненасыщенные, т.е. с меньшей концентрацией растворенного вещества, чем в насыщенном растворе.
|
|
|
Концентрация раствора – это количество вещества, заключенного в определенном весовом или объемном количестве раствора или растворителя.
Существуют различные способы выражения концентраций растворов:
1) массовая доля растворенного вещества или процентная концентрация показывает число граммов растворенного вещества в 100 граммах раствора.
Если g1 – масса растворенного вещества, g2 – масса раствора, то процентная концентрация А равна:
|
|
|
 (1)
(1)
Например, растворено 80,8 г. уксусной кислоты СН3СООН в 1 л. раствора и полученный раствор имеет плотность 1,0097 г/см3. Рассчитаем процентную концентрацию.
Масса раствора равна g = V*d, V – объем раствора, d – его плотность, т. е.  g = 1000 см3*1,0097 г/см3 = 1009,7 г, тогда
g = 1000 см3*1,0097 г/см3 = 1009,7 г, тогда

2) в химии часто используются объемные концентрации, поскольку жидкие растворы удобно измерять по объему, а не по весу.
Рассмотрим молярную концентрацию – С (моль/л). Она показывает число грамм-молей растворенного вещества в 1 литре раствора.
Например, пересчитаем концентрацию А соляной кислоты в молярную концентрацию
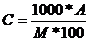 , (2)
, (2)
где М – молекулярный вес растворённого вещества HCI (36,5 г/моль). Тогда  моль/л.
моль/л.
3) моляльная концентрация – это число молей, растворённого вещества в 1000 г, растворителя.
Например, вес раствора объёмом 1 л равен 1185 г, в этом количестве раствора содержится:
100 г – 37,27 г HCI
1185 г – X
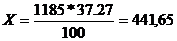 г.
г.
4) нормальная концентрация (нормальность) означает число грамм-эквивалентов вещества, содержащихся в 1 л раствора.
Эквивалентом элементов называется число, которое показывает, сколько весовых частей элемента соединяется с 8 весовыми частями кислорода или с 1 весовой частью водорода или замещает те же количества водорода или кислорода в их соединениях при химических превращениях.
|
|
|
Теперь можно сформулировать закон эквивалентов: элементы соединяются между собой и замещают друг друга в количествах, пропорциональных их эквивалентам, т.е.
 (3)
(3)
где gА и gВ – массы взаимодействующих элементов А и В, ЭА и ЭВ – эквиваленты элементов А и В. отсюда следует, что эквивалент водорода ЭН, а эквивалент кислорода Э0 = 8.
Эквиваленты других элементов можно определить по составу их соединений с другим элементом, эквивалент которого известен.
Грамм-эквивалентом называется число граммов вещества, равное по своей величине его эквиваленту.
Эквивалент элемента можно посчитать, разделив атомную массу М на валентность элемента  :
:
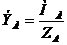 (4)
(4)
Если элемент имеет несколько соединений с разными валентностями, то его эквиваленты также различны, но относятся между собой как целые числа. Особенно широко применяется закон эквивалентов в аналитической химии.
|
|
|
Пусть V1 – объем одного раствора, мл.,
V2 – объем второго раствора, мл.,
N1 – нормальность первого раствора, г – экв./л,
N2 – нормальность второго раствора, г – экв./л, тогда V1*N1 = V2*N2 (5)
Уравнение (5) лежит в основе всех расчетов в объемном аналитическом анализе.
Для соединений эквивалент вычисляется на основании химической реакции, у которой это соединение участвует.
Например, для реакции:

 .
.
Для реакции:

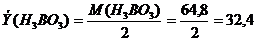 .
.
Наконец, для реакции:

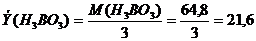 .
.
Следовательно, эквивалент кислоты равен её молекулярному весу, делённому на основность кислоты, т.е. на количество замещённых атомов водорода. Аналогично для оснований эквивалент равен молекулярному весу, делённому на основность (число диссоциирующих гидроксильных групп).

Эквивалент соли равен её молекулярному весу, делённому на произведение валентности металла на число атомов этого металла в молекуле.
Например, молекулярный вес  равен 263 , число атомов магния равно 3, тогда эквивалент соли в реакции обмена равен:
равен 263 , число атомов магния равно 3, тогда эквивалент соли в реакции обмена равен:
 ,
,
где Z=2 – валентность магния в соли.
В окислительно-восстановительном процессе участвуют и окислители, и восстановители.
Окислительным эквивалентом называется количество окислителя, приходящееся на один электрон, отдаваемым восстановителем в данной реакции. Оба эти эквивалента рассчитываются по формуле:
 , (6)
, (6)
где М – молекулярный вес окислителя или восстановителя, Z – число электронов.
Например, для реакции

окислитель: 

восстановитель: 

Расчёт нормальности можно проводить по формуле, аналогичной формуле (2), только вместо молекулярного веса следует взять эквивалентный вес:
 , (7)
, (7)
где  - эквивалентный вес растворённого вещества. Для хлороводородной кислоты
- эквивалентный вес растворённого вещества. Для хлороводородной кислоты  =
= 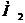 =36,5 г-экв, поэтому N=12?1 г-экв/л.
=36,5 г-экв, поэтому N=12?1 г-экв/л.
5) Мольная доля Ni растворенного вещества, i – это число молей компонента на 1 моль раствора.
Эта концентрация наиболее удобна в теоретических уравнениях. Рассмотрим пример с соляной кислотой, концентрация которой 37,27%. Число молей растворенного вещества:
 .
.
Число молей растворителя:
 .
.
Мольная доля кислоты:
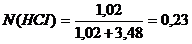
Мольная доля в этом растворе 1,0-0,23 = 0,77.
Вычисления при приготовлении и разбавлении растворов.
Рассмотрим типичные расчеты при приготовлении рабочих растворов.
1. Приготовление раствора нужной нормальности N в количестве V мл. Пусть g – навеска исходного вещества в граммах. Следует отвесить:
 г, (8)
г, (8)
где Э – эквивалент вещества.
Приготовление рабочего раствора кислот и щелочей из концентрированных растворов.
Сколько мл. концентрированного раствора азотной кислоты удельного веса 1,400 потребуется для приготовления 500 мл, 1н.раствора ?
Решение: Рассчитываем вес кислоты по формуле (8):
 .
.
Находим по таблице процентное содержание НNO3 удельного веса 1,400 г/см3. Оно равно 66,97%
Далее расчет производится по пропорции:
100 г р-ра – 66,97 г HNO3
Х - 3,15 г HNO3 ;
Можно этот же расчет производить по формуле:
 , (9)
, (9)
гдеV(HNO3) – нужное количество мл. концентрированной кислоты, d- ее плотность, А – процентная концентрация кислоты, V- объем приготовляемого раствора, мл.
3. При разбавлении растворов меняется его объем и концентрация, но общее количество грамм- эквивалентов остается постоянным. Следовательно, при разбавлении можно использовать уравнение (5).
Например, до какого объема нужно разбавить 100мл 2н. Раствора HNO3, чтобы концентрация кислоты стала равной 0,4н.
Решение:
V1N1= V2N2
V10,4= 100*2
V1 = 500 мл.
Т.е. нужно к раствору прилить 400 мл. H2O
4. Смешивание растворов. Чтобы вычислить соотношения, в которых следует взять два раствора известных концентраций, пользуются правилом “креста”. По этому правилу в центре пишут ту концентрацию, которую требуется получить (в%).
У концов линий слева пишутся концентрации исходных растворов, большая- сверху, меньшая- снизу. У концов линий креста справа пишут разность между концентрациями исходных растворов и требуемого раствора (разность меньшей концентрации и требуемой – вверху). Эта разность показывает, сколько следует взять весовых частей раствора большей концентрации. Разность большей концентрации и требуемой записывается справа внизу и показывает, сколько нужно взять раствора меньшей концентрации.
Пример1. В каком соотношении следует смешать 80%-ный раствор HCI с 10%, чтобы получить 30%-ный раствор?
Решение: По правилу «креста» находим
80 
 20
20

 30 30-10=20
30 30-10=20
10 50 80-30=50
следовательно, надо взять 20 весовых частей 80%-го раствора и прибавить к нему 50 весовых частей 10%-го раствора.
Пример2. Какие количества 80%-го и 20%-го растворов HNO3
Нужно взять, чтобы приготовить 1500г. 40%-го раствора?
Решение: Находим по правилу «креста» соотношение весовых частей:
80  20
20


 |
40
20  40
40
Следовательно соотношение весовых частей g’А:g’B = 20: 40. Количество 80%-го раствора определяется из соотношения:
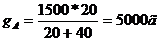 ,
,
а количество 20%-го раствора можно найти из соотношения:

Пример3. Несколько иначе выглядит расчет разбавления или увеличения концентрации имеющегося раствора. Пусть требуется рассчитать, сколько 80%-ой серной кислоты надо добавить к 500г. 20%-ой кислоты, чтобы получить 60% раствор?
Решение: по правилу «креста»

 80 40
80 40

 60
60
20 20
т.е. на 20г. 20%-го раствора следует взять 40г. 80%-го раствора. Далее находим то количество 80%-ой кислоты, которое нужно добавить к 500г слабой кислоты, составив пропорцию:
20 - 40
500 - X
 .
.
Пример 4. При приготовлении определенных объемов растворов необходимо учитывать плотность, чтобы переводить объемные единицы измерений в весовые.
Какие количества 10%-го и 80%-го растворов азотной кислоты нужно смешать, чтобы получить 1л 60%-го раствора?
Решение: по правилу креста
80 
 50
50
60
10 
 20
20
т.е. исходные растворы кислот нужно смешивать в соотношении 20:50.
По справочнику находим, что плотность 60%-го раствора HNO3 составляет 1,365, поэтому 1л нужного нам раствора весит 1365г. Это количество раствора нужно разделить на две части в соотношении 20:50. Составляем пропорции:
Из 20г 10%-го раствора получим 20+50г р-ра
Из Х г------------------------------------1365г р-ра
 .
.
т.е. нужно взять 390г 10%-го раствора.
Аналогично: из 50г 80%-го раствора----------------70г
Х--------------------------------------1365г
 .
.
Для удобства пересчитывают эти количества в объеме на единицы. Для 10%-го раствора HNO3 плотность равна 1,455, поэтому объем раствора, необходимый для смешивания будет равен:

Для 60% -го раствора плотность равна 1,455, поэтому объем раствора равен:
 .
.
Пример 5. При решении задач на разбавление растворов чистым растворителем нужно второй раствор в правиле «креста» считать за раствор с концентрацией 0.
Сколько воды следует добавить к 100г 40%-ой щелочи натрия, чтобы получить 5%-ый раствор?
Решение: по правилу «креста»
40 
 5
5
5

 0 35
0 35
т.е.  ,
,
далее определяем количество воды, которое нужно смешать со 100г щелочи:
5 - 35
100 - X

Пример 6. При решении задач на смешивание растворов, концентрации которых выражены в молях или нормальностях, моляльностях, также можно применять правило «креста».
Сколько нужно взять 0,2М и 1М растворов, чтобы приготовить 1000мл 0,4м раствора?
Решение: по правилу «креста»:
1 
 0,2
0,2

 0,4
0,4
0,2 0,6
 , тогда
, тогда
 ,
,
 .
.
Пример 7.Сколько воды нужно добавить к 1000мл. 1,15н раствора NaOH, чтобы получить 1,0Н раствор?
Решение: по правилу «креста»
 1,15 1 1 - 0,15
1,15 1 1 - 0,15

 1 1000 - X
1 1000 - X
 0 0,15
0 0,15
 .
.
Пример 8. Сколько воды и серной кислоты, удельного веса 1,82 г/см3 следует взять для приготовления 5л 2Н раствора?
Решение: Пересчитаем концентрацию серной кислоты на нормальность. По справочнику находим, что если плотность H2SO4 равна 1,82, то она содержит 91,11г. H2SO4 в 100г раствора.
В 100г раствора - 91,11г
В 1820г (1литр) - Х

Эквивалент H2SO4 = 49, поэтому нормальность будет равна:

Далее применяем правила «креста»:

 33,8 2 .
33,8 2 .

 2
2
0 31,8
т.е. отношение объемов
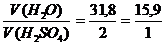
Из 1 литра H2SO4 плотностью 1,82 получается (15,9+1)л. раствора. Из Х – 5л. р-ра.

Из 15,9л. H2O получится 16,9л. 2Н р-ра
Из Хл. H2O -----------5л. 2Н р-ра.

КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. Сколько граммов NH4CI потребуется , чтобы приготовить 1,6кг.10%-го раствора?
2. В 300г раствора содержится 10% безводной соды. Сколько десятиводного карбоната натрия потребовалось для приготовления такого раствора?
3. Требуется приготовить 250г. 3%-го раствора буры. Сколько граммов десятиводного тетрабората натрия и воды необходимо для этого?
4. Сколько граммов воды потребуется для приготовления 10%-го раствора из 35г. двухводного кристаллогидрата хлорида бария?
5. Сколько граммов воды потребуется для растворения 12 граммов NaCI, чтобы получить 5%-ый раствор?
6. Сколько миллилитров этилового спирта (d=0,80 г/см3) потребуется для приготовления 10%-го раствора из 5г.иода?
7. Сколько граммов NaCI, имеющей 15% влажности, требуется для приготовления 1000 грамм 10%-го раствора?
8. Сколько граммов 60%-го раствора КОН и воды потребуется, чтобы приготовить 500г. 1-%-го раствора?
9. Сколько граммов технического едкого натра, содержащего 75% Na2O потребуется для приготовления 600г. 15%-го раствора?
10. 10г КСI растворены в 60г H2O. Найти процентную концентрацию раствора.
11. В 60г. H2O растворили 20мл 40%-го раствора H3PO4 (d= 1,254). Чему равна процентная концентрация раствора?
12. Из мерной колбы на 250мл, в которой находился 0,09650 н. раствор H2SO4 взяли 25,0 мл. Сколько граммов раствора H2SO4 (d=1,611) следует ввести в колбу, чтобы после доливания до метки водой получился 0,2000н. раствор.
13. Сколько мл. 50%-го и 20%-го растворов КОН потребуется для приготовления 500мл. 40%-го раствора?
14. В каком соотношении нужно смешать 12н. раствор НСI с 2н. раствором, чтобы получить 4н. раствор?
15. В каких объемных отношениях нужно смешать раствор HNO3 c водой, чтобы получить 2н. раствор?
16. В каких объемных отношениях надо смешать 1н. раствор уксусной кислоты с водой, чтобы получить 0,05н. раствор?
17. В каких объемных отношениях надо смешать 0,5 и 0,1н. растворы NaOH, чтобы получить 0,2н. раствор?
18. Сколько миллилитров 6н. и 1н. растворов HNO3 надо смешать для получения 500мл 2н раствора?
СВОЙСТВА РАСТВОРОВ
Растворы занимают промежуточное место между механическими смесями и химическими соединениями. Однородность растворов и выделение теплоты при растворении некоторых веществ делает их сходными с химическими соединениями. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких приделах.
Кроме того, в свойствах раствора можно обнаружить свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Давление насыщенного пара над раствором
Переход молекул веществ из жидкости в пар называется испарением. Переход молекул вещества из парообразного состояния в жидкость называется конденсацией.
Если жидкость находится в замкнутом сосуде, то достигается равновесие, когда скорость испарения жидкости равна скорости конденсации пара.
Давление, которое оказывает пар, находящийся в равновесии с жидкостью, называют давление насыщенного пара этой жидкости. Это максимальное давление пара, которое развивается жидкостью. Давление насыщенного пара зависит от природы жидкости и температуры и не зависит от количества жидкости.
Поверхность раствора, в отличае от поверхности чистого растворителя, частично занята молекулами растворенного вещества. Поэтому число молекул растворителя, испаряющихся в еденицу времени с еденицы поверхности раствора меньше, чем с еденицы поверхности растворителя. Следовательно, при одной и той же температуре давление насыщенного пара над раствором всегда будет ниже давления насыщенного пара над растворителем.
Количественно эта зависимость выражается законом Ф. Рауля “В идеальных растворах при постоянной температуре величина относительного понижения давления пара растворителя над раствором равна молярной доле растворенного вещества”.
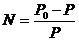 , где
, где
Р0 – давление пара чистого растворителя,
Р - давление насыщенного пара над раствором.
Идеальный раствор – раствор, в котором межмолекулярные силы равны. Если вещества А и В образуют идеальный раствор, то силы между молекулами А…А, А…В и В…В равны.
Из закона Рауля следует, что пар над смесью жидкостей А и В содержит оба этих вещества, причем давление насыщенного пара каждого из веществ в смеси равно произведению мольной доли этого вещества на давление насыщенного пара над чистым веществом, т.е.:
РА = NА* Р0А
РА – давление насыщенного пара вещества А над раствором,
NА – мольная доля вещества А в расворе,
Р0А – давление насыщенного пара вещества А над чистым веществом.
Для вещества В РВ = NВ* Р0 В
Дата добавления: 2018-02-28; просмотров: 1935; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
