Определение золы, потери в массе при прокаливании, остатка после прокаливания
Решение задач по фармацевтической химии
Определение летучих веществ и воды.
Для определения воды в ГФ Х1 издания (вып. 1, с. 176) приведены 3 метода: высушивания, дистилляции и титрования реактивом Фишера.
Содержание летучих веществ и воды (g, %) при определении методом высушивания (потеря в массе при высушивании) рассчитывают по формуле:

где m0 – масса бюкса, предварительно высушенного до постоянного значения, г; m1 – масса бюкса с навеской испытуемого объекта до высушивания, г; m2 – масса бюкса с навеской после высушивания до постоянной величины, г.
Задача 1.
Соответствует ли потеря в массе при высушивании кальция лактата требованиям ГФ (не более 30%), если масса бюкса 21,3782 г, масса бюкса с навеской вещества до высушивания 21,9772 г, масса бюкса с навеской после высушивания: 1-ое взвешивание – 21,8115 г, 2-ое взвешивание – 21,8105 г, 3-е взвешивание – 21,8102 г.
Задача 2.
При определении потери в массе при высушивании пероксида магния масса бюкса 18,3176 г, масса бюкса с навеской вещества до высушивания 18,8342 г, масса бюкса с навеской после высушивания: 1-ое взвешивание – 18,8086 г, 2-ое взвешивание – 18,8084 г. Рассчитайте потерю в массе при высушивании магния пероксида (в %). Соответствует ли она требованиям фармакопеи (не более 4,5%)?
Метод дистилляции применяется для количественного определения воды в объектах, являющихся при обычных условиях жидкостями (нафталанская нефть, эфирные масла), и эфирных масел в ЛРС. Метод характеризуется недостаточной точностью и чувствительностью, поэтому навеска объекта для анализа составляет обычно 10-20 г.
|
|
|
Содержание воды или эфирного масла в анализируемом образце при определении методом дистилляции рассчитывают по формуле:
 ,
,
где V – объем воды или эфирного масла, отсчитанный по градуированной пробирке приемника, мл; a – масса испытуемого объекта, взятая на анализ, г.
Задача 3.
Соответствует ли влажность дегтя березового требованиям ГФ (не более 0,5%), если при определении ее методом дистилляции использована навеска массой 10,5042 г, объем воды в градуированной пробирке приемника – 0,05 мл?
При использовании метода дистилляции для количественного определения эфирного масла в ЛРС, его содержание рассчитывают в объемно-весовых процентах в пересчете на абсолютно сухое сырье:
 ,
,
где V – объем эфирного масла, отсчитанный по градуированной пробирке приемника, мл; a – масса анализируемого сырья, г; В – потеря в массе при высушивании сырья, %.
Задача 4.
Рассчитайте содержание эфирного масла в анализируемом образце листьев шалфея, если объем эфирного масла в градуированной части приемника, при использовании навески сырья массой 20,1036 г, составил 0,175 мл, а потеря в массе при высушивании – 14%.
|
|
|
Титрование реактивом Фишера используется для определения воды в органических и неорганических веществах, подвергающихся гидролизу под воздействием повышенной температуры.
Содержание воды в лекарственных веществах при использовании метода Фишера рассчитывают по формуле:
 ,
,
где V1, V2 – объем реактива Фишера, израсходованный соответственно на титрование основного и контрольного опыта, мл; Т – титр реактива Фишера (устанавливают каждый раз перед употреблением, 1 мл реактива соответствует приблизительно 0,004 г воды), г/мл; а – масса лекарственного вещества, взятая на анализ, г.
Титр реактива Фишера рассчитывают по формуле:
 ,
,
где а – навеска воды, взятая для установки титра реактива, г; V1,V2 – соответственно объем реакива Фишера, на титрование воды и контрольного опыта, мл.
Задача 5.
Рассчитайте содержание воды в секуринина нитрате, если на титрование навески анализируемого образца массой 0,5068 г израсходовано 2,95 мл реактива Фишера. При установке титра реактива Фишера на титрование навески воды массой 0,04234 г пошло 10,8 мл реактива Фишера, контрольного опыта – 0,5 мл.
Соответствует ли секуринина нитрат требованиям ГФ по влажности (не более 2%)?
|
|
|
Определение золы, потери в массе при прокаливании, остатка после прокаливания.
В фарманализе золой называют остаток неорганических веществ, который получается в результате сжигания лекарственных веществ или ЛРС и последующего прокаливания до постоянной массы.
Согласно ГФ Х1 издания рекомендуется определять следующие виды золы:
- в ЛРС: общую золу и золу, нерастворимую в хлористоводородной кислоте;
- в лекарственных веществах: сульфатную золу.
Содержание общей золы в пересчете на абсолютно сухую массу рассчитывают по формуле:
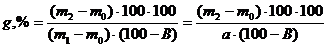 ,
,
где m0 – масса тигля, предварительно прокаленного до постоянного значения, г; m1 – масса тигля с навеской анализируемого объекта, г; m2 – масса тигля с золой после прокаливания до постоянной массы, г; а – навеска анализируемого объекта, г; В – влажность анализируемого объекта, %.
Задача 6.
Рассчитайте содержание общей золы в траве пустырника, если масса тигля – 17,8432 г, навеска травы пустырника – 2,1084 г. Масса тигля после озоления и прокаливания до постоянного значения составила: 1-ое взвешивание – 18,0634 г, 2-ое взвешивание – 18,0631 г. Влажность травы пустырника – 13%. Соответствует ли содержание общей золы требованиям ГФ (не более 12%)?
|
|
|
Остаток после прокаливания рассчитывают по формуле:

где m0 – масса тигля, предварительно прокаленного до постоянного значения, г; m1 – масса тигля с навеской анализируемого объекта, г; m2 – масса тигля с золой после прокаливания до постоянной массы, г; а – навеска анализируемого объекта, г.
Задача 7.
Рассчитайте остаток после прокаливания угля активированного (не более 4%), если масса тигля с навеской вещества до прокаливания – 36,8744 г, после прокаливания – 35,9143 г. Масса тигля – 35,8762 г.
Титрованные растворы.
Титрованными, стандартными или рабочими называются растворы точно известной концентрации, предназначенные для количественного определения лекарственных веществ титриметрическими методами.
В соответствии с международной системой в ГФ Х1 издания в качестве основной единицы количества вещества принят моль, поэтому содержание растворенного вещества в титрованных растворах выражено молярной концентрацией вещества (моль/л) и молярной концентрацией эквивалента (моль/л УЧ).
Различие в выражении концентрации титрованных растворов связано с зависимостью молярной массы эквивалента титранта Х от фактора эквивалентности в используемых для количественного определения методах кислотно-основного или окислительно-восстановительного титрования:
М(fэкв(Х)Х) = Э(Х) = fэкв(Х)Х∙М(Х),
где М(fэкв(Х)Х); Э(Х) – молярная масса эквивалента, г/моль;
М(Х) – молярная масса вещества Х, г/моль;
fэкв(Х)Х – фактор эквивалентности вещества Х в химической реакции.
Если fэкв(Х)Х = 1, а Э(Х) = fэкв(Х)∙М(Х) = М(Х), то титрованный раствор, содержащий 1 моль вещества Х в 1 литре, называют молярным – С(Х).
Если fэкв(Х)Х = 1/z (z-число эквивавалентности вещества Х в используемой реакции), а Э(Х) = fэкв(Х)∙М(Х) = 1/z∙ М(Х) = М(УЧ Х), то титрованный раствор, содержащий 1 моль эквивалента вещества Х (моль условных частиц) в 1 литре, называют нормальным раствором – N(Х). В таких случаях допускается вместо обозначения единицы измерения «моль/л УЧ» сокращение «н». Например, 1 моль/л (1/2 H2SO4) = 1 н. H2SO4.
Под условной частицей (УЧ) в ГФ Х1 подразумевается доля иона, атома или молекулы, ответственная за передачу одного электрона в реакции окисления-восстановления или одного иона водорода в кислотно-основной реакции. По ранее принятой терминологии «УЧ» соответствует понятию «эквивалент».
Молярная (С) и нормальная (N) концентрации титрованного раствора вещества Х связаны между собой следующей зависимостью:
М(Х) = С(Х) = N(Х)∙ fэкв(Х)
Наряду с молярной, концентрация титрованных растворов в ГФ Х1 выражается титром. Значение титра каждого титрованного раствора приведено в соответствующей статье.
Титр соответствует массе растворенного вещества в граммах, содержащейся в 1 мл титрованного раствора:
Т, г/мл = a/V,
где: Т – титр титрованного раствора, г/мл;
а – масса вещества, взятая, для приготовления заданного объема титрованного раствора, мл.
Титрованные растворы, применяемые в фармацевтическом анализе, согласно ГФ Х1 готовят двумя способами:
- по точной навеске соответствующего химически чистого вещества (приготовленные растворы);
- по навеске вещества, позволяющей приготовить раствор приблизительно требуемой концентрации , желательно большей, а затем доводят ее до требуемой (установленные растворы).
По первому способу согласно ГФ Х1 готовятся титрованные растворы калия дихромата и калия иодата.
Второй способ используют, если вещество нельзя получить в достаточно чистом виде или его концентрация меняется при хранении. Этот способ в ГФ Х1 является наиболее употребительным: им готовят титрованные растворы кислот (серной, хлорной, хлороводородной), аммония роданида, щелочей (натрия и калия гидроксида) и других веществ.
Навеску вещества (а), необходимую для приготовления заданного объема титрованного раствора, рассчитывают в зависимости от способа выражения его концентрации.
Если концентрация титрованного раствора выражена молярной массой вещества, то навеску рассчитывают по формуле:
а(Х) = С(Х)∙М(Х)∙V/1000,
где, а(Х) – навеска вещества, необходимая для приготовления заданного объема титрованного раствора, г;
С(Х) – молярная концентрация титрованного раствора, моль/л;
М(Х) – молярная масса вещества, г/моль;
V – заданный объем титрованного раствора, мл.
Задача 8.
Рассчитайте навеску натрия гидроксида (М = 40 г/моль) для приготовления 2 литров 0,1 моль/л титрованного раствора.
Если концентрация титрованного раствора выражена молярной массой эквивалента вещества, то навеску рассчитывают по формуле:
а(Х) = N(Х)∙Э(Х)∙V/1000,
где: N(Х) – концентрация титрованного раствора, выраженная молярной концентрацией эквивалента (УЧ), моль/л УЧ, н;
Э(Х) – молярная масса эквивалента, г/моль.
Задача 9.
Рассчитайте навеску калия бромата (М = 167,0 г/моль) для приготовления 5,0 л титрованного раствора 0,1 моль/л УЧ (1/6 KBrO3).
Навеску вещества для приготовления титрованного раствора можно рассчитать по величине титра:
 ,
,
где Т(Х) – титр вещества, г/мл; V – заданный объем титрованного раствора, мл.
Задача 10.
Рассчитайте навеску для приготовления 3 литров титрованного раствора серебра нитрата (0,05 моль/л), если один мл этого раствора должен содержать 0,008495 г вещества.
Иногда вещество, используемое для приготовления титрованного раствора, представляет собой раствор, концентрация или плотность которого известна (например, концентрированные растворы серной, хлороводородной кислоты). В таких случаях навеску вещества по массе или объему рассчитывают соответственно по формулам:
а(Х) = Т(Х)∙ V∙100/ω(Х) (г);
а(Х) = Т(Х)∙ V∙100/ω(Х)∙ρ(Х) (мл),
где: ω(Х) – массовая доля вещества (Х) в исходном растворе, используемом для приготовления титрованного раствора, %;
ρ(Х) – плотность исходного раствора, г/мл.
Задача 11.
Рассчитайте навеску концентрированной хлороводородной кислоты (М = 36,46 г/моль) для приготовления 1 л 0,5 моль/лраствора хлороводородной кислоты, если концентрированная хлороводородная кислота содержит 36,5% хлороводорода?
Рассчитанные тем или иным способом навески используют для приготовления титрованных растворов. По первому способу приготовления – навески отвешивают на аналитических весах, по второму – на ручных весах или отмеривают по объему. Навески вносят в мерные колбы требуемой вместимости, растворяют в соответствующих растворителях, доводят ими до метки, перемешивают.
Наряду с указанными способами в ГФ Х1 предусматривается использование фиксаналов для приготовления титрованных растворов. Фиксаналы – это выпускаемые промышленностью стандарт-титры. Они представляют собой запаянные ампулы, содержащие точно известное количество моль-эквивалентов вещества. Реактив из фиксанала количественно переносят в мерную колбу. В остальном приготовление титрованного раствора аналогично вышеприведенному. Промышленность выпускает фиксаналы почти всех титрантов.
После приготовления титрованных растворов проводят их стандартизацию. Под стандартизацией титрованного раствора понимают установление его точной концентрации.
Методика стандартизации, установочное вещество, способ расчета концентрации и поправочного коэффициента приготовленного титрованного раствора приводится в статье на титрованный раствор соответствующего наименования.
Для расчета концентрации приготовленного титрованного раствора в ГФ XI приведены два способа:
- по навеске химически чистого вещества (первичный стандарт);
- по титрованному раствору известной концентрации (вторичный стандарт).
При расчете концентрации по первому способу используют формулу:
С(Х) = a∙1000 / M(f экв)∙ V,
где С(Х) – концентрация стандартизуемого раствора, моль\л;
а – навеска химически чистого вещества (первичного стандарта),г;
M(f экв) – молярная масса эквивалента первичного стандарта, г\моль;
V – объем стандартного раствора, пошедшего на титрование первичного стандарта, мл;
1000 – количество мл в 1 литре раствора.
Задача 12.
Рассчитайте концентрацию титрованного раствора натрия тиосульфата, если на титрование 0,1546 г калия дихромата (М = 294,18 г/моль) по методике ГФ Х1 израсходовано 29,5 мл приготовленного титранта.
По второму способу концентрацию стандартизуемого раствора рассчитывают по формуле:
C(X) = C0V0 / V,
где С0 – концентрация титрованного раствора (вторичный стандарт), по которому устанавливается титр, моль\л;
V0 – объем раствора вторичного стандарта, пошедший на титрование стандартизуемого раствора, мл;
V – объем стандартизуемого раствора, взятый на анализ (обычно 20-25 мл), мл.
Задача 13.
Рассчитайте концентрацию раствора иодмонохлорида, если на титрование иода, выделившегося при обработке 25,0 мл приготовленного раствора израсходовано 22,5 мл раствора натрия тиосульфата 0,1 моль/л.
На основании найденной концентрации рассчитывают поправочный коэффициент (К) приготовленного титрованного раствора. Поправочный коэффициент показывает, в каком соотношении друг к другу находятся истинная (экспериментально установленная) и теоретическая концентрации приготовленного титрованного раствора:
К = Сэ / Ст,
где Сэ и Ст – соответственно экспериментально установленная и теоретическая концентрация стандартизуемого титрованного раствора, моль\л.
Поправочный коэффициент согласно ГФ должен укладываться в интервал 0,98-1,02. В случаях, когда значения поправочных коэффициентов не укладываются в указанные пределы, растворы необходимо укрепить или разбавить.
В случае разбавления титрованных растворов, объем соответствующего растворителя, который необходимо добавить к приготовленному раствору для доведения К до требуемого значения рассчитывают по формуле:
Х, мл = (К – 1)∙Vр-ра
Задача 14.
Поправочный коэффициент 0,1 моль/л раствора натрия гидроксида, приготовленного в количестве 500 мл равен 1,1. Как довести значение К до нормы?
Для укрепления титрованного раствора (К<1) из 1 вычитают К и полученную разность умножают на массу навески исходного вещества, взятую для приготовления необходимого объема титрованного раствора:
Х,г = (1 –К) ∙ а
Задача 15.
Для приготовления 2000 мл 0,1 моль/л раствора натрия гидроксида (М = 40 г/моль) была отвешена навеска массой 8,0 г. Поправочный коэффициент полученного раствора равен 0,95. Как довести значение К до нормы?
После добавления рассчитанного количества растворителя или исходного вещества проводят повторное определение поправочного коэффициента. При соответствии К требованиям ГФ Х1 титрованный раствор готов к употреблению.
Дата добавления: 2018-02-28; просмотров: 4147; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
