Структурная организация фотосинтетического аппарата
Лист как орган фотосинтеза
Фотосинтез может протекать в различных органах растения (стебель, чашелистники, плоды и т. д.), но в основном он осуществляется в листе. Данному процессу подчинена вся его структура. Поверхность листа благодаря дорсовентральному строению превосходит его объем. Это и обусловливает интенсивный газообмен листа с внешней средой, чему способствуют устьица, а также система дыхательных полостей и межклетников.
Углекислый газ попадает в лист в основном через устьица (в меньшей степени через кутикулу) путем диффузии по градиенту концентрации. Далее он распространяется по системе межклетников и поступает в оболочки клеток мезофилла, растворяется в воде, пропитывающей пектиновый матрикс, и преобразуется в угольную кислоту. Часть ее диффундирует в хлоропласты через клеточные мембраны и оболочки хлоропластов, а остальная часть нейтрализуется в цитоплазме катионами, в результате чего образуется резерв углекислого газа в виде гидрокарбонат-ионов (НCO-3). У суккулентов и С4 растений запас углекислого газа создается за счет связывания его в цитоплазме органическими кислотами.
Структура листа приспособлена к максимальному поглощению солнечной радиации. Лист обладает большой светособирающей поверхностью. Эпидермис, клетки которого, за исключением замыкающих клеток устьиц, не содержат хлоропластов и беспрепятственно пропускает солнечные лучи. Вакуоли эпидермальных клеток играют роль миниатюрных линз, концентрирующих свет. Клетки столбчатой ткани располагаются плотно в один, два, реже в три ряда, торцом к поверхности эпидермиса, благодаря чему солнечные лучи скользят по продольным стенкам клетки и освещают всю ее полость. Палисадная ткань, обращенная к свету, содержит большую часть всех хлоропластов листа и выполняет основную работу по ассимиляции СО2. Число слоев клеток мезофилла в листе в большой степени зависит от интенсивности освещения. Листья, выросшие на ярком свету, имеют, как правило, более развитый столбчатый мезофилл.
|
|
|
В течение дня интенсивность освещения варьирует в широких пределах, что не всегда благоприятно сказывается на функционировании хлоропластов. В связи с этим они приспособились поглощать свет путем изменения своего положения (фототаксис). Если освещенность невелика, хлоропласты рассеиваются по всей клетке или собираются у стенок, на которые непосредственно падает поток солнечных лучей, и таким образом максимально используют свет. При интенсивном освещении хлоропласты собираются у стенок, вдоль которых солнечные лучи скользят, и поворачиваются ребром к свету, избегая таким путем действия избыточной солнечной радиации.
|
|
|
Под столбчатой тканью залегают клетки губчатой ткани. К ним доходит уже достаточно ослабленный световой поток. Однако они располагаются рыхло. Поэтому свет в межклетниках многократно отражается от клеточных стенок и поглощается почти полностью. Благодаря развитой системе межклетников мезофилл обладает громадной поверхностью, во много раз превышающей наружную поверхность листа.
Для листа характерна хорошо развитая сеть проводящих пучков. По их сосудам поступают необходимая для фотосинтеза вода и элементы минерального питания, а по ситовидным трубкам продукты фотосинтеза оттекают в потребляющие органы (в противном случае хлоропласты переполняются ассимиляционным крахмалом и перестают функционировать).
Листья большинства растений способны медленно поворачиваться к свету таким образом, чтобы обеспечить наилучшие условия для фотосинтеза. Так возникает «листовая мозаика» - расположение листьев в одной плоскости с минимальным затенением друг друга. Это происходит за счет роста растяжением клеток в черешке или работы тургорных механизмов в листовых сочленениях.
Химический состав и строение хлоропластов
|
|
|
Размер хлоропластов колеблется от 4 до 10 мкм. Их число обычно составляет от 20 до 100 на клетку. Химический состав хлоропластов (% на сухую массу): белок — 35—55; липиды — 20—30; углеводы — 10; РНК — 2—3; ДНК — до 0,5; хлорофилл — 9; каротиноиды — 4,5.
В хлоропластах сосредоточены все ферменты, принимающие участие в процессе фотосинтеза (окислительно-восстановительные, синтетазы, гидролазы). Многие из них являются двухкомпонентными, небелковыми компанентами которых являются различные витамины и металлы. В хлоропластах сосредоточены витамины группы В, К, Е, D и их производные, находится 80% Fe, 70% Zn, около 50% Си от всего количества этих элементов в листе.
Процесс фотосинтеза происходит непосредственно в хлоропластах и базируется на тех реакциях, которые протекают в их тилакоидах (Рис. 14).
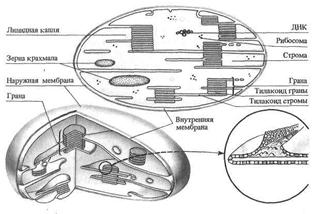
Рисунок 14. – Строение хлоропласта.
Как и другие пластиды, хлоропласты обладают наружной и внутренней мембранами. Толщина каждой мембраны 7,5—10 нм, расстояние между ними 10—30 нм. Внутренняя часть органеллы заполнена жидким коллоидным матриксом (строма), в котором расположена гранулярная система. Тилакоиды гран соединены между собой и тилакоидами стромы особыми канальцами или спайками. Оба типа тилакоидов образуют единую замкнутую фотосинтетическую систему хлоропластов, являющуюся производной внутренней мембраны.
|
|
|
Тилакоиды образованы особыми мембранами, называемыми фотосинтетическими. Они построены по тому же принципу, что и все биологические мембраны, но включают специфические структурные и ферментные белки, а также фотосинтетические пигменты.
Хлоропласты имеют свою собственную ДНК осуществляющей синтез специфических для хлоропластов структурных белков и ферментов. Ее структура и состав отличаются от ядерной ДНК. Результатом мутации генома хлоропластов является возникновение пестролистных форм растений, не подчиняющихся законам наследования Г. Менделя. В процессе эволюции фотосинтетический аппарат приобрел двойную генетическую подчиненность — геному ядра и полуавтономную — собственной ДНК.
Хлоропластная ДНК отличается от ядерной значительно меньшей молекулярной массой, различным соотношением нуклеотидов, не образует комплекса с белками гистонами и некоторыми другими особенностями. Она образует замкнутую кольцевую структуру и по своим физико-химическим свойствам близка к ДНК митохондрий и прокариотным организмам.
Достаточно специфичны и пластидные РНК: информационные, транспортные и рибосомальные. Большая часть РНК хлоропластов располагается в рибосомах пластид. Рибосомы хлоропластов также отличаются от цитоплазматических рядом особенностей: они существенно более активны, требуют для повышенной активности больших концентраций Мд+2 и т. д. Обнаружены и полирибосомы в хлоропластах, связанные с тилакоидами или находящиеся в свободном состоянии в строме хлоропластов.
Нативные хлоропласты содержат в среднем 75 % воды, являясь резервным ее источником. Набор ферментов в хлоропластах очень широк, поэтому их нередко называют «депо ферментов». Ферментные системы хлоропластов принимают активное участие в синтезе органических веществ в процессе фотосинтеза.
В хлоропластах высших растений осуществляется не только фотосинтез. На свету в них за счет энергии АТФ происходят процессы восстановления нитратов и сульфатов, синтезируются пигменты, фосфолипиды, полисахариды, белки и ряд других веществ. Во всех этих процессах принимают участие разнообразные ферментные системы, широко представленные в хлоропластах.
При росте клетки количество хлоропластов увеличивается путем деления. При делении ламеллярная система пересекается перемычкой поперек органоида, иногда наблюдается почкование хлоропластов. Затем размер дочерних хлоропластов увеличивается. Деление хлоропластов происходит через 6 — 20 ч и не всегда совпадает с делением ядра. Оно может регулироваться красным светом (660 нм) и устраняется облучением дальним красным светом (730 нм). Деление останавливается также низкой температурой.
На формирование хлоропластовсильное влияние оказывают внешние условия. У большинства растений хлоропласты формируются только на свету. Исключением являются лишь проростки ели и некоторых других голосеменных растений, некоторые мхи, водоросли и лишайники. Процессы формирования хлоропластов чувствительны не только к интенсивности, но и к качеству света, условиям минерального питания, температуре и другим внешним условиям. С помощью электронного микроскопа показано, что на одном красном свету развивается очень рыхлая гранулярная структура и то только в периферической части хлоропласта. На синем свету гранулярная структура еще слабее. Такие хлоропласты обладают менее высокой интенсивностью фотосинтеза.
Из элементов минерального питания наиболее сильное влияние на формирование хлоропластов оказывают азот, фосфор, магний, железо, марганец, цинк. Неблагоприятные условия внешней среды приводят к уменьшению числа тилакоидов в гранах и количества гран в самих хлоропластах.
Фотосинтетические пигменты
Пигменты — важнейший компонент аппарата фотосинтеза. Изучение растительных пигментов резко ускорилось благодаря работам русского физиолога растений М. С. Цвета. В 1901 — 1903 гг. он открыл принципиально новый метод, который назвал адсорбционной хроматографией. Через колонку с сорбентом пропускается растворитель с растворенными веществами. Так как вещества различаются по степени адсорбции, они перемещаются по колонке с разной скоростью, в результате чего происходит разделение веществ. С помощью хроматографического метода Цвет обнаружил два хлорофилла — а и в и разделил желтые пигменты листа на три фракции. Пигменты пластид относятся к трем классам веществ: хлорофиллам, фикобилинам и каротиноидам.
Структура хлорофиллов
Впервые хлорофилл в кристаллическом виде был описан русским физиологом и ботаником И. П. Бородиным в 1883 г. В дальнейшем оказалось, что это не сам хлорофилл, а несколько видоизмененная его форма — этилхлорофиллид.
Польские биохимики М. Ненцкий и Л. Мархлевский (1897) обнаружили, что основу молекулы хлорофилла, как и гема гемоглобина, составляет порфириновое кольцо. Таким образом было показано принципиальное структурное сходство этих пигментов у растений и животных. Немецкий химик Р. Вильштеттер в 1906-1914 гг. установил элементарный состав хлорофилла а — С55Н72О5N4Мg и хлорофилла b — С55Н70О6N4Мg, а немецкий биохимик Г. Фишер в 1930 -1940 гг. полностью расшифровал структурную формулу хлорофилла. В 1960 г. химики-органики Р. Б. Вудворд (США) и М. Штрель (ФРГ) осуществили искусственный синтез хлорофилла.
В химическом отношении хлорофиллпредставляет собой сложный эфир дикарбоновой кислоты хлорофиллина (хлорофиллиновой кислоты) и двух спиртов — метилового и фитола (Рис. 15).

Рисунок 15. – Структурная формула молекулы хлорофилла а.
Основу молекулы хлорофилла составляют 4 пиррольных кольца, соединенные метиновыми мостиками (-СН= ). Они образуют порфириновое ядро и придают хлорофиллу гидрофильные свойства. Атомы азота пиррольных колец четырьмя координационными связями взаимодействуют с атомом магния. В структуре порфиринового ядра есть также циклопентановое кольцо (V), образованное остатком кетопропионовой кислоты и содержащее химически активную карбонильную группу у С9 и метилированную карбоксильную группу у С10. Структура, состоящая из тетрапиррольного и циклопентанового колец, получила название форбина. Боковая цепь IV пиррольного кольца включает в себя пропионовую кислоту, связанную сложноэфирной связью с полиизопреновым непредельным спиртом фитолом (С20Н39ОН). Фитольный хвост придает хлорофиллу гидрофобные свойства.У 1, 3, 5 и 8-го углеродов пиррольных колец имеются метильные группы, у 2-го — винильная, у 4-го — этильная группа. Порфириновое кольцо представляет собой систему из девяти пар конъюгированных (сопряженных) чередующихся двойных и одинарных связей с 18 делокализованными р-электронами. Хлорофилл b отличается от хлорофилла а тем, что у 3-го углерода второго пиррольного кольца вместо метильной (-СН3 находится альдегидная формильная (—СНО) группа.
Структура хлорофилла, лишенная фитола, называется хлорофиллидом.
У высших растений и водорослей обнаружены хлорофиллы а, b, с, d. Все фотосинтезирующие растения, включая все группы водорослей, а также цианобактерии, содержат хлорофиллы группы а. Хлорофилл b представлен у высших растений, у зеленых водорослей и эвгленовых. У бурых и диатомовых водорослей вместо хлорофилла b присутствует хлорофилл с, а у многих красных водорослей — хлорофилл d. В фотосинтезирующих бактериях, осуществляющих фоторедукцию, найдены различные бактериохлорофиллы.
Физико-химические свойства хлорофиллов
Втвердом виде хлорофилл а представляет собой аморфное вещество сине-черного цвета. Температура плавления хлорофилла а 117 — 120 °С. Хлорофиллы хорошо растворимы в этиловом эфире, бензоле, хлороформе, ацетоне, этиловом спирте, плохо растворимы в петролейном эфире и нерастворимы в воде.
Раствор хлорофилла а в этиловом эфире имеет сине-зеленый цвет, хлорофилла b — желто-зеленый. Резко выраженные максимумы поглощения хлорофиллов лежат в красной и синей частях спектра.
Поглощение в сине-фиолетовой части спектра обусловлено системой конъюгированных одинарных и двойных связей порфиринового кольца молекулы хлорофилла. Интенсивная полоса поглощения в красной области связана с гидрированием двойной связи у С7 — С8 в IV пиррольном ядре (при переходе от протохлорофиллида к хлорофиллиду) и присутствием магния в порфириновом кольце. Эти же условия способствуют снижению поглощения в желтой и зеленой частях спектра.
Замещение магния протонами при обработке хлорофилла кислотой приводит к образованию феофетина, имеющего буро-зеленый цвет и ослабленный красный максимум поглощения.
Удаление остатков фитола и метилового спирта путем щелочного гидролиза мало сказывается на спектре поглощения хлорофилла. У хлорофиллина те же спектральные свойства, что и у хлорофилла: он зеленый, имеет красный и синий максимумы поглощения.
В этиловом эфире максимумы поглощения хлорофиллов группы а в красной части спектра — в пределах 660 — 663 нм, в синей — 428 —430 нм, хлорофилла b — соответственно в пределах 642 — 644 и 452 — 455 нм. У агрегированных молекул хлорофилла, находящегося в хлоропластах, красный максимум поглощения сдвинут в более длинноволновую область (до 680 нм).
Растворы хлорофиллов в полярных растворителях обладают яркой флуоресценцией. Это происходит за счет потери энергии в виде излучения при переходе ē молекулы хлорофилла из возбужденного состояния в основное. При этом испускаются лучи с большей длиной волны, чем поглощенные. В этиловом эфире у хлорофилла а наблюдается рубиново-красная флуоресценция с максимумом 668 нм, у хлорофилла b — 648 нм. Агрегированный хлорофилл и хлорофилл в нативном состоянии (в живом листе) флуоресцируют слабо. Растворы хлорофиллов способны также к фосфоресценции (т. е. длительному послесвечению), максимум которого лежит в инфракрасной области.
Содержание хлорофилловколеблется от 0,3 до 1,3 % на абсолютно сухую массу листа. Хлорофилла а обычно в 3 раза больше, чем хлорофилла b. У теневых листьев хлорофилла b больше, чем у световых. Содержание хлорофилла изменяется в связи с возрастом листа. Так, в момент распускания хвои сосны и ели содержание зеленых пигментов в ней обычно не превышает 0,1 мг/г сырой массы. Но уже к августу оно повышается до 0,4 — 0,7 мг/г. У ели количество хлорофилла обычно повышается вплоть до 4-летнего возраста, у сосны — до 3-летнего, после чего наблюдается его снижение. У лиственных пород наблюдается аналогичная зависимость в течение одного вегетационного сезона.
Биосинтез хлорофилла
Хлорофилл в клетке постоянно обновляется. По мере разрушения старых молекул его в определенных участках тилакоидов (центрах биосинтеза хлорофилла), при участии специального ферментного комплекса постоянно образуются новые. Это происходит так, как представлено на схеме (Рис. 16).
Непосредственным предшественником хлорофилла а является аминокислота гликокол (глицин) (СН2NН2COOH) и активированная янтарная кислота (НООС—СН2—СН2—СООН) — сукцинилкоэнзим А, синтезирующийся в процессе окислительного расщепления глюкозы. Эти вещества взаимодействуют между собой и при участии основного фермента биосинтеза хлорофилла б-АЛК-синтетазы дают б-аминолевулиновую кислоту (б-АЛК). При конденсации двух молекул последней образуется порфобилиноген — структурная основа пиррольного кольца.
Далее 4 пиррольных кольца через ряд промежуточных стадий конденсируются в протопорфирин IX.
К молекуле протопорфирина присоединяются атом магния и остаток спирта метанола, замыкается циклопентановое кольцо с образованием протохлорофиллида.
Под действием света к молекуле протохлорфиллида в месте двойной связи 4-го пиррольного кольца присоединяются два атома водорода, в результате чего образуется хлорофиллид.
К хлорофиллиду присоединяется остаток спирта фитола, завершая реакции синтеза хлорофилла а. Исходным веществом синтеза фитола, как и порфиринового ядра, служит глюкоза. Определенная часть молодых молекул хлорофилла а ферментативным путем преобразуется в хлорофилл b.
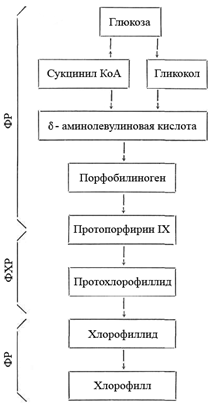
Рисунок 16. – Схема биосинтеза хлорофилла а
Молекулы хлорофилла ориентируются на фотосинтетической мембране так, что их порфириновые ядра располагаются на внешней поверхности тилакоида и вступают в связь с гидрофильными концами молекул его структурного белка. Фитольная часть молекулы хлорофилла (фитольный хвост) несет многочисленные — СН3-радикалы и обладает гидрофобными свойствами. Поэтому она внедряется между гидрофобными участками структурных белков либо между остатками жирных кислот липидного матрикса. По мере образования новых молекул хлорофилла они располагаются в фотосинтетической мембране все более плотно (агрегация).
Условия образования хлорофилла
Для биосинтеза хлорофилла необходима развитая система тилакоидов (несут соответствующие ферменты), кислород (участвует в окислительном превращении глюкозы), железо (входит в состав цитохромоксидазы), азот и магний (обязательные компоненты молекулы хлорофилла), а также бор, цинк и медь.
Биосинтез хлорофилла теснейшим образом связан с внешними факторами. Необходима определенная температура — не ниже -2°С, оптимальная — около 20°С. Для большинства растений оптимальная интенсивность света составляет около 25000 лк, причем лучше всего реакции синтеза хлорофилла идут в красной части спектра.
При прорастании семян в темноте, появляющиеся проростки лишены обычной зеленой окраски вследствие отсутствия хлорофилла. Такие растения называют этиолированными, а само явление — этиоляцией. Первые признаки позеленения этиолированных покрытосеменных растений наблюдаются через 2 — 4 ч после начала освещения.
Явление хлорозарастений (белые или желтые пятна на листьях) связано с недостатком в них железа, ответственного за ряд реакций биосинтеза хлорофилла.
Каротиноиды
Каротиноиды — жирорастворимые пигменты желтого, оранжевого, красного цвета. Присутствуют в хлоропластах всех растений. Они входят также в состав хромопластов незеленых частей растений, например в корнеплодах моркови, от латинского наименования которой (Daucus carota L.) они и получили свое название. В зеленых листьях каротиноиды обычно незаметны из-за присутствия хлорофилла, но осенью, когда хлорофилл разрушается, именно каротиноиды придают листьям характерную желтую и оранжевую окраску. Каротиноиды синтезируются также бактериями и грибами. В настоящее время известно около 400 пигментов, относящихся к этой группе.
Структура и свойства.
Элементарный состав каротиноидов установил Вильштеттер. С 1920 по 1930г. была определена структура основных пигментов этой группы. Искусственный синтез ряда каротиноидов впервые осуществлен в 1950 г. в лаборатории П. Каррера.
К каротиноидам относятся три группы соединений:
1) оранжевые или красные пигменты каротины (С40Н56);
2) желтые ксантофиллы (С40Н56О2 и С40Н56О4);
3) каротиноидные кислоты — продукты окисления каротиноидов с укороченной цепочкой и карбоксильными группами (например, С20Н24О4 — кроцетин, имеющий две карбоксильные группы).
Каротины и ксантофиллы хорошо растворимы в хлороформе, бензоле, сероуглероде, ацетоне. Каротины легко растворимы в бензине, петролейном и диэтиловом эфирах, но почти нерастворимы в метаноле и этаноле, а ксантофиллы наоборот. Каротиноиды имеют максимумы поглощения в фиолетово-синей и синей частях спектра света от 400 до 500 нм. Они не способны к флуоресценции. Содержание каротина в 3 — 5 раз меньше, чем хлорофиллов. На одну молекулу каротинов приходится 2 — 3 молекулы ксантофиллов.
Все каротиноиды — полиеновые соединения. Каротиноиды первых двух групп состоят из восьми остатков изопрена, которые образуют цепь конъюгированных двойных связей. Каротиноиды могут быть ациклическими (алифатическими), моно- и бициклическими. Циклы на концах молекул каротиноидов являются производными ионона. Примером ациклического каротиноида может служить ликопин (С40Н56) — основной каротин некоторых плодов (в частности, томатов) и пурпурных бактерий (Рис. 17).

Рисунок 17. – Структурные формулы каротиноидов и последовательность их превращений (по В. В. Полевому).
b-Каротин имеет два b-иононовых кольца (двойная связь между С5 и С6). При гидролизе b-каротина по центральной двойной связи образуются две молекулы витамина А (ретинола).
Ксантофилл лютеин — производное a-каротина, а зеаксантин — b-каротина. Эти ксантофиллы имеют по одной гидроксильной группе в каждом иононовом кольце. Дополнительное включение в молекулу зеаксантина двух атомов кислорода по двойным связям С5—С6 (эпоксидные группы) приводит к образованию виолаксантина. Название «виолаксантин» связано с выделением этого соединения из лепестков желтых анютиных глазок (Viola tricolor). Зеаксантин впервые получен из зерновок кукурузы (Zea mays). Лютеин (от лат. luteus — желтый) содержится, в частности, в желтке куриных яиц. К наиболее окисленным изомерам лютеина относится фукоксантин (С40Н60О6) — главный ксантофилл бурых водорослей. Основные каротиноиды пластид высших растений и водорослей — b-каротин, лютеин, виолаксантин и неоксантин.
Синтез каротиноидов начинается с ацетил-СоА через мевалоновую кислоту, геранилгеранилпирофосфат до ликопина, который является предшественником всех других каротиноидов. Синтез каротиноидов идет при температуре не ниже -5°С. Наиболее оптимальной является температура в пределах 20°С. Свет для синтеза каротиноидов не обязателен, но он стимулирует реакции образования этих веществ, особенно синие лучи спектра. Необходим и ряд минеральных элементов, особенно фосфор.
Функции каротиноидов
1) Участие в поглощении света в качестве дополнительных пигментов – расширение спектра поглощения.
2) защита молекул хлорофиллов от необратимого фотоокисления.
3) Способствуют определению направления роста побега – участие в фототропизме.
4) Обусловливают цвет лепестков и плодов у некоторых растений.
Фикобилины
Синезеленые водоросли (цианобактерии), красные морские водоросли и некоторые морские криптомонады помимо хлорофилла а и каротиноидов содержат пигменты фикобилины. Наиболее известные представители фикобилинов — фикоэритробилины и фикоцианобилины. Первые преобладают у красных водорослей и определяют их цвет, вторые — у синезеленых.
Структура и свойства фикобилинов.
По структуре фикобилины (от греч. «phycos» — водоросль и лат. bills — желчь) относятся к группе желчных пигментов — билинов (у животных представитель этой группы — билирубин). Это тетрапирролы с открытой цепью, имеющие систему конъюгированных двойных и одинарных связей. В своем составе они не содержат атомов магния или других металлов, а также фитола (Рис. 18).

Рисунок 18. – Структурные формулы фикобилинов (по В. В. Полевому)
Фикобилины являются хромофорными группами фикобилипротеидов — глобулиновых белков, с которыми в отличие от хлорофиллов они связаны прочными ковалентными связями.
Фикобилипротеины делятся на три основные группы:
1) фикоэритрины — белки красного цвета с максимумом поглощения от 498 до 568 нм,
2) фикоцианины — сине-голубые белки с максимумами поглощения от 585 до 630 нм,
3) аллофикоцианины — синие белки с максимумами поглощения от 585 до 650 нм.
Все эти хромопротеиды обладают флуоресценцией с максимумами 575 – 578, 635 – 647 и 660 нм соответственно.
Фикобилипротеиды водорастворимы, в клетках водорослей они локализованы в фикобилисомах — гранулах, расположенных на наружной поверхности фотосинтетических ламелл.
Значение фикобилинов.Максимумы поглощения света у фикобилинов находятся между двумя максимумами поглощения у хлорофилла: в оранжевой, желтой и зеленой частях спектра, менее всего поглощаемых водой. В связи с изменением качественного состава света в верхних слоях морей и океанов обитают преимущественно зеленые водоросли, глубже — синезеленые и еще глубже — водоросли с красной окраской. В. Т. Энгельман назвал это явление хроматической комплементарной адаптацией водорослей. По его наблюдениям (1881 — 1884), наиболее интенсивная ассимиляция СО2 у водорослей с различной окраской соответствует максимумам поглощения света пигментными системами этих водорослей. У водорослей фикобилины — дополнительные пигменты, выполняющие вместо хлорофилла b функции светособирающего комплекса. Около 90% энергии света, поглощенного фикобилинами, передается на хлорофиллы а. Кроме фикобилинов, участвующих в фотосинтезе у водорослей, у всех растений имеется другой фикобилин — фитохром, являющийся фоторецептором для восприятия красного и дальнего красного света и выполняющий регуляторные функции.
Дата добавления: 2018-02-28; просмотров: 2491; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
