На электродах протекают реакции 1 страница
Nbsp; Учреждение образования «Международный государственный экологический университет имени А. Д. Сахарова» Программа подготовки к экзамену по физической и коллоидной химии для студентов 2 курса факультета заочного обучения по специальности 1-33 01 05 «Медицинская экология 2008-2009 учебный год
Основные направления развития физической и коллоидной химии. Соотношение с другими дисциплинами. Ее место в ряду химических дисциплин. Коллоидная химия как раздел физической химии, имеющих важное значение для описания биологических систем.
Физи́ческая хи́мия — раздел химии, наука об общих законах строения, структуры и превращения химических веществ. Исследует химические явления с помощью теоретических и экспериментальных методов физики. Наиболее обширный раздел химии.
История физической химии. Начало физической химии было положено в середине XVIII века. Термин «Физическая химия», в современном понимании методологии науки и вопросов теории познания, принадлежит М. В. Ломоносову. М. В. Ломоносов следовал таким принципам во многих направлениях своих исследований: в разработке и практической реализации основанной им же «науки о стекле», в различных опытах, посвящённых подтверждению закона сохранения вещества и силы (движения); — в работах и экспериментах, имеющих отношение к учению о растворах — им была разработана обширная программа исследований настоящего физико-химического феномена, находящаяся в процессе развития до настоящего времени.
|
|
|
Затем последовал более чем столетний перерыв и одним из первых в России физикохимические исследования в конце 1850-х годов начал Д. И. Менделеев.
Физическая химия является основным теоретическим фундаментом современной химии, использующим теоретические методы таких важнейших разделов физики, как квантовая механика, статистическая физика и термодинамика, нелинейная динамика, теория поля и др. Она включает учение о строении вещества, в том числе: о строении молекул, химическую термодинамику, химическую кинетику и катализ. В качестве отдельных разделов в физической химии выделяют также электрохимию, фотохимию, физическую химию поверхностных явлений (в том числе адсорбцию), радиационную химию, учение о коррозии металлов, физико-химию высокомолекулярных соединений (см. физика полимеров) и др. Весьма близко примыкают к физической химии и подчас рассматриваются как её самостоятельные разделы коллоидная химия, физико-химический анализ и квантовая химия. Большинство разделов физической химии имеет достаточно чёткие границы по объектам и методам исследования, по методологическим особенностям и используемому аппарату.
|
|
|
Коллоидная химия – это наука о дисперсных системах и поверхностных явлениях, возникающих на границах раздела фаз. Она является химией реальных тел, поскольку реальные объекты живой и неживой природы, продукты и материалы, создаваемые и используемые человеком, практически всегда находятся в дисперсном состоянии, т. е. содержат в своем составе малые частицы, тонкие пленки, мембраны, волокна с четко выраженными поверхностями раздела. При этом поверхностные явления и дисперсные системы встречаются не только на
Земле, но и далеко за ее пределами. Например, межзвездная материя – это газопылевые облака, из которых, согласно теории образования планет О. Ю. Шмидта, произошло самообразование планет вокруг Солнца. Метеорологические явления – грозовые разряды, дождь, снег, град, туман и др. – это коллоидные процессы.
Коллоидная химия составляет научную основу производства пластических масс, резины, синтетических волокон, клеев, лакокрасочных и строительных материалов, продуктов питания, лекарств и т. п. Практически нет ни одной области промышленности, которая в той или иной степени не имела бы дела с дисперсными системами. Велика роль коллоидной химии и в решении комплекса задач охраны окружающей среды, включая очистку сточных вод, водоподготовку,
|
|
|
улавливание аэрозолей, борьбу с эрозией почв и др.
Коллоидная химия открывает новые подходы к изучению истории земной коры, установлению связей между коллоидно-химическими свойствами почвы и ее плодородием, выяснению условий возникновения жизни, механизмов жизнедеятельности; она одна из ведущих основ таких смежных наук, как современная биология, почвоведение, геология, метеорология. Вместе с биохимией и физикохимией полимеров она составляет основу учения о возникновении и развитии жизни на Земле. Конечно, жизненные процессы весьма сложны, и невозможно свести их к закономерностям коллоидной химии, но тот факт, что все живые системы являются высокодисперсными, подчеркивает значение коллоидной химии для развития современной науки в целом.
Моделирования свойств сложных систем. Взаимосвязь температуры, давления и объема; эмпирическая температура. Уравнение Гей-Люсака и понятие температуры абсолютного нуля. Уравнение Менделеева-Клапейрона и физический смысл универсальной газовой постоянной Уравнение Ван-дер-Ваальса и его основные модификации. Физический смысл входящих в уравнение Ван-дер-Ваальса поправочных коэффициентов и условия применения законов идеального газа при описании поведения реальных газов
|
|
|
Изучение физической химии часто начинают с законов поведения газов. Связано это с тем, что законы поведения газов представляют собой основу для понимания поведения более сложных систем, поскольку в той или иной мере все системы могут быть мысленно или экспериментально упрощены. Такое упрощение часто называют моделированием определенных свойств сложной системы. Поведение газов относительно просто по двум причинам:
1. Смеси газов всегда образуют однородные по составу, истинные растворы, находящиеся в одной «фазе».
2. При одной и той же температуре и одном и том же давлении одинаковые объемы газов содержат одинаковое количество молекул (это известный закон Авогадро).
Системы газов характеризуются общими параметрами – такими, как масса, объем, температура, давление, плотность и др. Некоторые параметры связаны между собой. Это означает, что если мы, например, знаем массу и объем газа, то нам не представляет труда вычислить его плотность, так как
плотность = масса/объем.
То, что мы обычно понимаем под температурой, есть не что иное, как мера средней кинетической энергии молекул некоего тела. Если рассматривать перенос тепла от одного тела к другому, то это представляет собой просто передачу кинетической энергии молекул одного тела другому.
Состояние газа обусловлено любыми двумя из трех его свойств: P, V, T. Иначе говоря, из трех переменных независимыми являются только две. Математически мы можем записать это в форме
T = f (P,V) (эмпирическая температура). (1.1)
Определение температуры, которое следует из выражения 1.1, часто называют нулевым законом термодинамики. Нулевой закон термодинамики часто выражают через понятие температуры и теплового равновесия: две системы, находящиеся в тепловом равновесии с третьей, находятся в тепловом равновесии друг с другом.
Допустим, что два тела, нагретые до разных температур, приводятся в контакт друг с другом до наступления равновесия.
Это значит, что
f(P1,V1) = f(P2,V2) или T1 = T2. (1.2)
На практике это означает, что одно тело может быть использовано для определения температуры другого тела. Это легко видеть из уравнения. Допустим, у нас сохраняется одинаковым давление для двух тел, т.е. Р1 = Р2, тогда после установления равновесия по изменению объема можно судить о температуре анализируемого образца. На этом принципе работают известные нам термометры.
Закон Шарля (он одновременно был открыт Ж.Л. Гей-Люссаком) тоже был найден эмпирически. Сегодня он гласит:
В процессе охлаждения газа при постоянном давлении на каждый градус Цельсия его объем уменьшается на 1/273,15 того объема, который он занимает при 0 С
Математически это можно записать уравнением
 (при постоянном давлении). (1.4)
(при постоянном давлении). (1.4)
Чем интересно это уравнение? Оно указывает, что при t = -273,15 С газ вообще должен исчезать, т.е. не занимать никакого объема. Это невероятно. Понятно, что это уравнение не может выполняться точно. Тем не менее температура -273,15 С получила название абсолютного нуля. Абсолютный ноль использован в качестве точки отсчета в шкале Кельвина (или абсолютной шкале).
Приведенное выше уравнение можно записать так:
 , где T = t + 273,15.
, где T = t + 273,15.
уравнение идеального газа или уравнение Менделеева-Клайперона:
Р 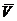 = RТ (для 1 моля газа, где
= RТ (для 1 моля газа, где 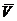 молярный объем), (1.7)
молярный объем), (1.7)
PV = nRT (для n молей газа). (1.8)
Универса́льная га́зовая постоя́нная — константа, равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К. Впервые введена в употребление Д. И. Менделеевым в 1874 году. Обозначается латинской буквой R.
R = 8,314 107 эрг/моль град;
R = 8,314 Дж/мольград;
R = 1,987 кал/мольград.
Газовая постоянная тесно связана с теплоемкостью газов. Теплоемкость – это количество тепла, необходимое для повышения температуры вещества на 1°. Обычно речь идет о молярной теплоемкости, т.е. она относится к количеству вещества в один моль.
Уравнение состояния реальных (неидеальных) газов.
Уравнение Ван-дер-Ваальса
Речь уже шла о том, что свойства реальных газов редко полностью могут быть описаны законами, выведенными для идеальных газов. Это особенно касается состояний при высоких давлениях и низких температурах. В этих условиях объем системы становится относительно малым и необходимо учитывать собственный объем молекул. Кроме того, начинают действовать силы межмолекулярного притяжения. Для идеального газа произведение PV является постоянным.
Рис. 1.2 показывает, что поведение О2, Н2 и CO2 отклоняется от поведения идеального газа. Причем вид отклонения зависит от природы газа.

Рис. 1.2. Отклонение в поведении реальных газов от идеального в условиях высоких давлений
Чтобы как-то устранить причины, из-за которых уравнение идеального газа практически неприменимо для описания поведения реальных газов, Ван-дер-Ваальс в 1879 году предложил включить в него два дополнительных члена – а и b: константу а добавляют к Р для того, чтобы учесть (скомпенсировать) уменьшение давления из-за межмолекулярного притяжения; константа b учитывает эффективный объем молекул газа, и она вычитается из 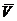 . Обе константы подбирались эмпирически. В результате для одного моля газа уравнение приобретает вид:
. Обе константы подбирались эмпирически. В результате для одного моля газа уравнение приобретает вид:
 . (1.18)
. (1.18)
Однако в этом уравнении появились еще некоторые члены. Так, поправка к давлению принята равной  по той причине, что молекулы на поверхности газа притягиваются не только друг к другу (к молекулам на поверхности), но и к молекулам, находящимся внутри. Сила притяжения зависит от плотности газа как на поверхности, так и внутри. Поскольку плотность – это масса/V, то ее влияние можно учесть умножением константы а на 1/V2. Поправка b в реальном случае примерно в 4 раза превышает собственный объем молекул моля газа. Ее иногда называют исключенным объемом, так как она соответствует пространству, реально исключаемому одним молем плотно упакованных молекул. Поправки а и b для любого газа приводятся в расчете на 1 моль. Если количество газа больше или меньше одного моля, необходимо пользоваться следующим уравнением
по той причине, что молекулы на поверхности газа притягиваются не только друг к другу (к молекулам на поверхности), но и к молекулам, находящимся внутри. Сила притяжения зависит от плотности газа как на поверхности, так и внутри. Поскольку плотность – это масса/V, то ее влияние можно учесть умножением константы а на 1/V2. Поправка b в реальном случае примерно в 4 раза превышает собственный объем молекул моля газа. Ее иногда называют исключенным объемом, так как она соответствует пространству, реально исключаемому одним молем плотно упакованных молекул. Поправки а и b для любого газа приводятся в расчете на 1 моль. Если количество газа больше или меньше одного моля, необходимо пользоваться следующим уравнением
 . (1.19)
. (1.19)
В практике при расчетах обычно используются табличные данные по значениям а и b.
Это важно в некоторых случаях при расчетах метаболических процессов, в результате которых выделяется, например, СО2.
Однако в большинстве случаев при метаболических процессах давление выделившегося газа относительно невелико. Поэтому ошибка при использовании уравнения, применимого к идеальному газу, для расчетов поведения реальных газов находится в пределах 1-2%. Это меньше, чем стандартная ошибка большинства экспериментов, и поэтому в обычных условиях уравнение Ван-дер-Ваальса используется редко.
Энергетическое состояние системы – основа реализации физико-химических процессов в живой и неживой природе. Типы систем и процессов, функции состояния, работа, внутренняя энергия, теплота. Первое начало термодинамики. Применение первого начала термодинамики к различным процессам (изобарный, изохорный, изотермический, адиабатный). Энтальпия и ее физический смысл. Закон Гесса – следствие первого начала термодинамики, имеющее принципиальное значение для определения тепловых эффектов химических и биохимических реакций Основной смысл и значение второго начала термодинамики. Статистическая природа второго начала термодинамики Изменение энтропии изолированной системы; критерии достижения термодинамического равновесия в изолированной системе. Постулат Планка (третье начало термодинамики) как основа расчета абсолютных значений энтропии. Стандартные значения энтропии. Расчеты изменения энтропии в различных процессах (изотермический, неизотермический, сложный), расчет изменения энтропии в химическом и биохимическом процессах.
Термодинамика – это наука о теплоте и ее превращениях. Она возникла в конце восемнадцатого века в результате интереса к повседневно встречающимся процессам превращения работы, теплоты и материи.
С помощью термодинамики есть возможность предсказать максимальную работу, которую можно получить в определенном процессе, определить состояние равновесия, максимально возможный выход, оптимальную температуру и давление для данной реакции, выбрать лучший растворитель. Термодинамика может ответить на вопрос о том, будет ли реакция протекать в нужном направлении. Но термодинамика не может предсказать необходимое для этого время, указать на механизм реакции.
Под понятием энергия обычно понимают способность производить работу. Решая какую-либо задачу методами термодинамики, необходимо прежде всего выделить из окружающего мира какую-то систему. Это может быть дождевая капля, двигатель, организм, планета и т.д. Если говорят, что выделенная система гомогенна, это означает, что свойства системы одинаковы во всех частях, и система непрерывна от точки к точке. Если говорят, что система гетерогенна, это означает, что в ней присутствует не менее двух областей, называемых фазами, которые отделены друг от друга поверхностями, называемыми границами раздела. Системы бывают трех типов: открытые, закрытые и изолированные. В закрытой системе во время процесса происходит изменение энергии, но масса остается постоянной. В открытой системе может изменяться как энергия, так и масса. В изолированной системе не происходит обмена с окружающей средой ни массой, ни энергией!
Очень часто в термодинамике сталкиваются с понятием равновесие. Если состав и свойства системы достаточно долго не меняются, то говорят, что система находится в равновесии. Однако химическое равновесие не является состоянием покоя. Это состояние, в котором реакция протекает как в одну, так и в другую сторону, но с одинаковыми скоростями.
Состояние системы определяется ее свойствами. Если изменяется одно из свойств, состояние системы меняется. При изучении системы обычно рассматриваются такие свойства, как температура, давление, объем, состав.
Первое начало термодинамики – это закон сохранения энергии. Он впервые четко сформулирован Г. Гельмгольцем в 1847 году. Этот закон не может быть четко доказан, но является результатом всего человеческого опыта. Такие законы часто называют законами природы.
Есть несколько формулировок первого закона термодинамики. Если одна из них принимается в качестве основной, то все другие являются следствиями, вытекающими из нее.
Одна из формулировок звучит следующим образом: энергия не создается и не уничтожается. Возможны лишь превращения энергии из одного вида в другой в строго эквивалентных количествах.
Следствием из этого закона является вывод, что невозможен вечный двигатель первого рода, т.е. нельзя создать такой двигатель, который совершил бы работу без затраты энергии. Создание такого двигателя возможно только в том случае, если неверен первый закон.
Часто используется еще одна формулировка первого начала термодинамики: внутренняя энергии изолированной системы есть величина постоянная.
Если данной системе передается некоторое количество энергии в форме тепла Q, которое идет только на приращение внутренней энергии системы DU и на совершение системой работы W, то, согласно первому началу,
Q = DU + W, (2.1)
для бесконечно малых изменений
dQ = dU + dW. (2.2)
Уравнения (2.1) и (2.2) являются математическим выражением первого начала термодинамики.
Укажем, что DU и dU не зависят от пути перехода системы из начального состояния в конечное, т.е. внутренняя энергия является функцией состояния системы.
Справедливость этого утверждения можно доказать следующим образом (рис. 2.1).
Предположим, что в состоянии (I) внутренняя энергия системы U1. Из этого состояния система переходит в состояние (2), в котором ее внутренняя энергия равна U2.

Рис. 2.1. Схематическое отображение путей перехода системы из состояния 1 в состояние 2 и обратно
При переходе системы из состояния 1 в состояние 2 по пути I обозначим изменение внутренней энергии системы как DU1, а по второму пути, – как DU2. Согласно первому закону, DU1 = DU2 . Если бы это равенство не соблюдалось, а, например, DU1 было бы больше DU2, то, переводя систему из состояния 1 в состояние 2 по пути I и обратно по пути II, можно было бы получать энергию из ничего. Это противоречит первому началу термодинамики.
В отличие от DU величины Q и W в общем случае зависят от пути процесса. Поэтому в уравнении (2.2) dU является полным дифференциалом, в то время как dQ и dW – просто бесконечно малыми величинами.
Применение первого начала термодинамики к различным процессам
Если система совершает работу W только против внешнего давления, то
W = РDV (2.3)
или для элементарного процесса
dW = pdV. (2.4)
Математическое выражение первого начала термодинамики в этом случае имеет вид:
Q= DU + pD (2.5)
или
dQ = dU + pdV. (2.6)
Для изохорного процесса (V = const) pDV = 0 и следовательно:
QV = DU, (2.7)
Дата добавления: 2018-02-28; просмотров: 303; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
