РН природных вод. Щелочность природных вод
Для большинства природных вод при pH=7 в соответствии с принципом электронейтральности соблюдается равновесие:

Неорганич. соед-я углерода в прир.водах могут находиться в виде  и образуют карбонатную систему
и образуют карбонатную систему

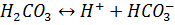


Диссоциация  по 2 ступ.протекает крайне медленно
по 2 ступ.протекает крайне медленно

Конст.дис.  по 2 ступ.приблизительно на 4 порядка меньше 1 ступ. При диссоц.
по 2 ступ.приблизительно на 4 порядка меньше 1 ступ. При диссоц.  по 1 ступ.концентрации образ-ся
по 1 ступ.концентрации образ-ся  равны между собой.
равны между собой.
Существует зависимость.

Учитыв.малую долю недиссоц.  в р-ре и значит.трудн.разделен.отдельн. ионов конц-ю
в р-ре и значит.трудн.разделен.отдельн. ионов конц-ю  в р-ре оценивают как уравнение:
в р-ре оценивают как уравнение:


Подобный подход оценки pHпримен., если в воде присутствуют диоксид серы и аммиак.
Щелочность природных вод – способность воды нейтрализовать ионы водорода. Кол-во ионов водорода, идущих на реакцию с карбон.и  , наз-ся карбонатной щелочностью. Участие в реакции всех трех ионов составляет общую щелочность воды:
, наз-ся карбонатной щелочностью. Участие в реакции всех трех ионов составляет общую щелочность воды:
Щ=2  [
[  ]+[O
]+[O 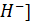 , моль/л
, моль/л
Если pH ниже 4,5, то Щ=0 моль/л. Помимо щелочноси воды сущ-ет понятие основн. р-ра. Это конц-я O  в воде в данный момент времени. Величина щелочности природных вод имеет значение для фотосинтеза.
в воде в данный момент времени. Величина щелочности природных вод имеет значение для фотосинтеза.

Протекание реакции фотосинтеза в отсутствие достаточного поступления в раствор углекислого газа может сопровождаться значительным увеличением pH. При отсутствии процесса растворения/осаждения щелочность воды остается неизменной.
Солёность и жёсткость природных вод. Какие анионы и катионы являются главными ионами природных вод.
|
|
|
Солёность – содержание солей в воде. Качественная питьевая вода содержит не более 0,5г/л солей, такие воды относятся к пресным, менее 0,2г/л – ультрапресные, 0,5-1 – повышенная минерализация, 1-3 – солоноватые воды, 3-10 – солёные, 10-35 – с повышенной солёностью, 35-50 – переходные к рассолам, 50-4000– рассолы.
Жёсткость (Ж) – свойство воды, обусловленное содержанием в ней ионов Са и Mg (моль/м3). Величину общей Жопр-ют по уравнению: Ж=[Ca2+]/20+[Mg2+]/12.
Карбонатная Ж – количество ионов Са и Mg, связанных с карбонат- и гидрокарбонат-ионами. Если данная величина больше общей Ж, то карбонат- и гидрокарбонат-ионы связаны с другими катионами, тогда карбонатная Ж равна общей.
Некарбонатная Ж – это Ж воды, определяемая как разность общей и карбонатной Ж.
Устраняемая Ж – часть карбонатной Ж, устраняемая при кипячении воды. Определяется экспериментально.
Неустраняемая Ж – опр-ся как разность общей и устраняемой Ж.
По величине общей Ж воду делят на группы: менее 1,5моль/м3 – очень мягкая вода; 1,5-3 – мягкая; 3-5,4 –средней жёсткости; 5,4-10,7 – жёсткая; более 10,7 – очень жёсткая.
Сумма катионов в природных водах должна быть равна сумме анионов. Главными ионами морских вод являются:
Na+>Mg2+>Ca2+>K+> …; Cl->SO42->HCO3->Br->…
Главными ионами речной воды являются:
Ca2+>Na+>Mg2+>…; HCO3->SO42->Cl->…
7. Растворимость газов в воде. Основные газы в природных водоёмах. Их роль в гидросфере.
|
|
|
В природных водах присутствуют: O2 (расходуется на дыхание и др.окислительные процессы), H2S (вреден для организмов: снижает концентрации кислорода, смертелен в очень малых концентрациях), CH4 (ядовит для многих организмов), CO2 (расходуется в результате потребления фотосинтезирующими организмами, при связывании в соли угольной кислоты), N2 и др. Их источниками являются контактирующий с водой воздух и внутриводоёмные процессы. Концентрации газов в воде определяются их парциальными давлениями и константами Генри:
Сpi =Kiг*Pi[моль/л].
Kiг – константа Генри [моль/л*Па]; Pi – парциальное давление отдельного газа, находящегося в растворе [Па].
Растворимость газов в воде увеличивается с ростом внешнего давления и уменьшается с увеличением температуры. С этим связано уменьшение кислорода в верхнем слое водных объектов в летний период.
8. Эвтотрофность природных водоёмов.
Эвтрофизация– процесс ухудшения качества воды из-за избыточного поступления в водоём биогенных элементов (соединения азота и фосфора).
К эвтрофным водоёмам относятся неглубокие (до 10–15 м) равнинные озёра с обильным поступлением биогенов. Летом в массовом количестве развивается фитопланктон. Грунты илистые, прозрачность воды низкая, цветность высокая. Водная масса гиполимниона(нижний слой воды в период стратификации) по сравнению с эпилимнионом (верхний слой) мала, бедна кислородом. Водная толща прогревается до дна.
Причины эвтрофизации : почва, богатая минеральными веществами , попадающая в озёра из-за разрушающихся берегов; сельскохозяйственные удобрения; сточные воды животноводческих комплексов; фосфатсодержащие детергенты (ПАВ).
Процесс эвтрофизации, как правило, необратим. Связано это с тем, что фосфаты, однажды попавшие в водоём, не выводятся окончательно в осадок с органическим веществом.
Дата добавления: 2018-02-28; просмотров: 1504; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
