Алидоформиат 2) алидоацетат 3) алидофенон
Энтропияның төмендеуі жүйенің мына өзгерісі кезінде орын алады: СҰЙЫҚТАН ҚАТТЫҒА ӨТКЕНДЕ 2. Өздігінен жүретін үдерістер кезінде: ГИББС ЭНЕРГИЯСЫ ТӨМЕНДЕЙДІ 3. Жай заттардың стандартты түзілу энтальпиясының өзгерісі тең болады (Дж/моль): ∆Но = 0 4. Термодинамиканың бірінші заңының математикалық өрнегінің түрі: Q = ∆U + A. 5. Күй параметрлерінің өзгерісіне (p = const, ∆p = const) жүйенің сәйкес келетін күйі: ИЗОБАРАЛЫҚ 6. Егер жүйенің энтальпиясы төмендейтін болса, онда реакция: 1, а. а) жылуды бөле жүреді. б) жылуды сіңіре жүреді. в) жылу өзгермей жүредіжәне 1. Экзотермиялық 2. Эндотермиялық болады. Сәйкестікті тағайындаңдар: 7. Жүйенің ішкі энергиясының өзгерісі былайша анықталады: ∆U = U2 – U1 8. Адам организмінде этанол екі сатыда тотығады: –493 кДж/моль ΔН1 ΔН2 С2Н5ОН → СН3СНО → СН3СООН ΔНº1= -256 кДж/моль; ΔНº2= -237 кДж/моль. Гесс заңын пайдаланып, этил спиртінің сірке қышқылына дейін тотығуы реакциясының ΔНºх.р есептеңдер. 9. Гетерогенді жүйе болып табылады: H2Oқ + Н2Обу 10. Гесс заңы бойынша реакцияның жылу эффекті тәуелсіз болады: АРАЛЫҚ САТЫЛАРДЫҢ САНЫМЕН СИПАТЫНА ТӘУЕЛДІ ЕМЕС 11. Жүйе ашық болып саналады, егер ол қоршаған ортамен: ЭНЕРГИЯ ЖӘНЕ ЗАТПЕН АЛМАСАДЫ 12. Жүйе ...... өткенде оның энтропиясы өседі: СҰЙЫҚТАН ГАЗҒА ӨТКЕНДЕ 13. Термодинамикада стандартты жағдай деп есептеледі: Т = 298 К, Р = 101,3 кПа 14. Жүйе ашық болып саналады, егер ол қоршаған ортамен былайша алмасатын болса: ЗАТ ЖӘНЕ ЭНЕРГИЯ 15. Гиббс энергиясы бойынша мынадай қорытынды жасауға болады: ҮДЕРІСТІ, ӨЗДІГІНЕН ЖҮРУ МҮМКІНДІГІ ТУРАЛЫ 16. Жүйенің энтропиясы мына өзгеріс кезінде өседі: СҰЙЫҚТАН ГАЗҒА ӨТКЕНДЕ 17. Химияда қалыпты жағдай (қ.ж.) ретінде қысым мен температураның мына мәндері алынады: Т = 273 К, Р = 101,3 кПа. 18. Эндотермиялық реакциялар кезінде: РЕАКЦИЯЛЫҚ ҚОСПАНЫҢ ЭНТАЛЬПИЯСЫ ӨСЕДІ 19. Гиббс энергиясын (изобарлық-изотермиялық потенциал) есептеу үшін қолданылатын формуланы көрсетіңдер: ∆G = ∆H-T∆S 20. Гесс заңынан шығатын 1-салды өрнектейтін формуланы көрстеіңдер: ∆G = E∆Gөнім-Е∆G 21. Гесстің термохимиялық заңынан туындайтын маңызды сал бойынша, химиялық реакцияның жылу эффекті тең болады: СТЕХИОМЕТРИЯЛЫҚ КОЭФФИЦЕНТТНРІН ЕСЕПКЕ АЛА ОТЫРЫП, ЗАТТЫҢ ТҮЗІЛУ ЖЫЛУЫ ӨНҢМ ЗАТТАРДЫҢ ТҮЗІЛУ ЖЫЛУЫНЫҢ ҚОСЫНДЫСЫ,б.з. ТҮЗІЛУ ЖЫЛУЫНАН АЛЫП ТАСТАҒАНЫНА ТЕҢ. 22.Заттардың эксперимент кезіндегі жану жылуларын анықтау үшін қолданылатын арнайы аспап былайша аталады: КАЛОРИМЕТР 23.Мына үдеріс үшін H2 (г) + 1/2 O2 (г)= H2O (г) есептеулер жүргізбей-ақ ∆S°таңбасын анықтаңдар: ∆S<0 24.Мына үдеріс үшін 2NH3(г)= N2(г)+ 3H2(г)есептеулер жүргізбей-ақ ∆S°таңбасын анықтаңдар: ∆S>0 ∆S>0 25.Тепе-теңдік жағдайындағы энтальпияны есептеу үшін қолданылатын өрнекті көрсетіңдер: ∆H=T∆S 26.Бірінші бастамасын тұжырымдаңдар: ӘРЕКЕТТЕСЕТІН ЖӘНЕ ТҮЗІЛЕТІН ЗАТТАРДЫҢ РЕАЛДЫ МӨЛШЕРІ 27.Энтропияның өлшем бірлігі: Дж/моль*К Дж/К 28.Химиялық үдеріс өздігінен мына жағдайда жүруі мүмкін, егер...: ∆G < 0 ГИББС ЭНЕРГИЯСЫ ТӨМЕНДЕЙДІ, ЭНТРОПИЯ АРТҚАНДА 29.Термохимиялық теңдеудегі стехиометрлік коэффициенттер мынаны көрсетеді: ӘРЕКЕТТЕСЕТІН ЖӘНЕ ТҮЗІЛЕТІН ЗАТТАРДЫҢ РЕАЛДЫ МӨЛШЕРІН 30.Оқшауланған жүйе сыртқы ортамен: ЗАТ ЖӘНЕ ЭНЕРГИЯ АЛМАСПАЙДЫ 31.Химиялық реакция міндетті түрде энергияны бөле, немесе сіңіре жүреді, себебі ...: СЕБЕБІ ХИМИЯЛЫҚ РЕАКЦИЯ КЕЗІНДЕ БІР БАЙЛАНЫСТАР ҮЗІЛІП, БАСҚАЛАРЫ ТҮЗІЛЕДІ 32.Аммиак мына реакция бойынша алынады: N2(r)+3H2(r)=2NH3(r)+92кДж Аммиактың стандартты жылу мөлшерін көрсетіңіз: 27кДж 33.Атмосфералық қысым кезінде иодты белгілі бір температураға дейін қыздырғанда ол балқымай буланады. Қатты заттың тікелей газ күйіне өту құбылысының атауы: СУБЛИМАЦИЯ 34.Бейтараптау реакциясының стандартты жылуы –57 кДж/моль. Сілті затының мөлшері 2 моль болатын натрий гидроксидін тұз қышқылымен бейтараптау реакциясының жылу эффектін көрсетіңдер: ЕКЕ ЕСЕ АРТАДЫ -114 35.Төменде келтірілген термодинамикалық функциялардың ішінен үдерістің өздігінен жүру мүмкіндігін көрсететінін таңдап алыңдар: ∆G < 0 36.Мына реакция үшін әсер етуші массалар заңының математикалық өрнегі: V = k[Cl2][H2] 37.Температуралық коэффициенті 3-ке тең реакцияның жылдамдығы температураны 10ºС-қа көтергенде былайша өседі: 3 ЕСЕ 38.Химиялық реакцияның молекулалығы дегеніміз ...: ХИМИЯЛЫҚ АЙНАЛЫМНЫҢ ЭЛЕМЕНТАРЛЫ АКТІНЕ ҚАТЫСАТЫН МОЛЕКУЛА САНЫ 39.Организмдегі химиялық реакцияларды тездететіндер: ФЕРМЕНТ КАТАЛИЗАТОР 40. Мына жүйедегі FeO(қ) + H2(г) ⇄ Fe(қ) + H2O(г) – Q химиялық тепе-теңдік реакция өнімдері бағытында ығысады, егер: ТЕМПЕРАТУРА КӨТЕРІЛСЕ 41.Реакция жылдамдығының температураға тәуелділігін анықтайтын Вант-Гофф ережесінің математикалық өрнегін жазыңдар: V2 = V1γ(∆t / 10) 42.Көптеген реакциялар үшін температураны көтергенде жылдамдықтың артуын дұрыс түсіндіретін тұжырымды таңдап алыңдар: БӨЛШЕКТЕР АРАСЫНДАҒЫ СОҒЫСУЛАРДЫҢ КӨБЕЙГЕН КЕЗДЕ 43.Ферментті үдерістердің кинетикасын сипаттайтын теңдеу: V = Vmax[S] / (K + [S]). 44.Реакция мына теңдеу бойынша жүреді: В(қ) + 2А(г) = С(г). Осы реакцияның жылдамдығы мына теңдеумен анықталады: V = k[A]2 45.Мына реакция үшін 2Н2(г) + О2(г) = 2Н2О әсер етуші массалар заңының математикалық өрнегі: V = k[H2]2[O2]. 46.Реакция жылдамдығының температуралық коэффициенті 3-ке тең. Температураны 40°С-қа көтергенде реакции жылдамдығы неше есе артады: 81 есе 47.Өте жылдам (іс-жүзінде лезде) жүретін реакцияның типі: ИОНДАР АРАСЫНДА АЛМАСУ 48. Мына реакция үшінА(с) ⇄ В(қ) + С(с) тепе-теңдік константасы неге тең: Кр = [C] / [A] 49. Мына жүйедегі тепе-теңдікті көміртек(IV) оксидінің түзулуі жағына қарай ығыстыру үшін: ҚЫСЫМДЫ КӨТЕРУ КЕРЕК 50.Әсер етуші массалар заңы бойынша: ХИМИЯЛЫҚ РЕАКЦИЯНЫҢ ЖЫЛДАМДЫҒЫ ӘРЕКЕТТЕСЕТІН ЗАТТАРДЫҢ КОНЦЕНТРАЦИЯСЫНЫҢ КӨБЕЙТІНДІСІНЕ ТУРА ПРОПОРЦИОНАЛЬ. 51. Әсер етуші массалар заңының негізінде 2Fe(қ) + 3Cl2(г) = 2FeCl3(қ) химиялық реакцияның жылдамдығы мына теңдеумен өрнектеледі: V = k[Cl2]3 52.Температцураны 10-нан 40ºС-қа дейін көтергенде реакцияның жылдамдығы 16 есе өсті. Осы реакция жылдамдығының температуралық коэффициенті тең болады: 2 53. Мына жүйедегі тепе-теңдікке СО2(г) + С(қ) ⇄ 2СО(г) – 172,2 кДж көміртектің концентрациясын арттыру былайша әсер етеді: ТЕПЕ ТЕҢДІК БҰЗЫЛМАЙДЫ 54. Дұрыс анықтаманы таңдап алыңдар: «Химиялық реакцияның реттілігі дегеніміз»: РЕАКЦИЯНЫҢ КИНЕТИКАЛЫҚ ТЕҢДЕУДЕГІ ДӘРЕЖЕЛЕР КӨРСЕТЕТІН ҚОСЫНДЫСЫ 56. Мына реакция үшін: С(қ) + СО2(г) ⇄ 2СО(г) тепе-теңдік константасының мәні анықталады: Кр = [СО]2 / [CО2] 57. Мына гомогенді жүйедегі 2SO2(г) + O2(г) ⇄ 2SO3(г) тепе-теңдікке қысымды қөтеру былайша әсер етеді: ТЕПЕ ТЕҢДІК ОҢҒА ЖЫЛЖИДЫ 58. Химиялық реакцияың жылдамдық константасына әсер етпейді: ЗАТТАР КОНЦЕНТРАЦИЯСЫ 59. Химиялық рекцияның жылдамдығы – бұл ... УАҚЫТ БІРЛІГІ АРАЛЫҒЫНДА КӨЛЕМ НЕМЕСЕ (ӨНІМДЕРДІҢ) МӨЛШЕРІНІҢ ӨЗГЕРІСІ 60. Вант-Гоффтың эмпирикалық ережесіне сәйкес реакциялық қоспаның температурасын 30-дан 40 °С-қа дейін көтергенде химиялдық реакцияның жылдамдығы... 2-4 есе артады 61. Клапейрон-Менделеев теңдеуіндегі R шамасы былайша аталады... ӘМБЕБАП-ГАЗ ТҰРАҚТЫСЫ 8,31 Дж/К*моль 62. Оң катализатор химиялық реакцияның жылдамдығын өзгертеді, себебі: БЕЛСЕНДІРУ ЭНЕГИЯСЫН ТӨМЕНДЕТЕДІ 63. «Ерітінді бетіндегі қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың молярлық үдесіне тең». Бұл анықтама кімнің заңына сәйкес келеді: РАУЛЬ ЗАҢЫ 64.Стаканда қайнап жатқан тұз ерітіндісінің қайнау температурасы жоғарылайды, егер: ЕГЕР ОҒАН ТАҒЫ ТҰЗ ҚОССА 65.Криоскопиялық константа тәуелді болады: ЕРІТКІШТІҢ ТАБИҒАТЫНА ТӘУЕЛДІ 66.Дұрыс анықтаманы таңдап алыңдар.Ерітінді дегеніміз: КӨП КОММЕНТТІ ГОМОГЕНДІ ЖҮЙЕ 67.Электролит ерітінділерінің коллигативтік қасиеттерінің ұшпайтын бейэлектролит ерітінділерінің қасиеттерінен ауытқу дәрежесін көрсететін эмпирикалық коэффициент былайша аталады: ИЗОТОНДЫ КОЭФФИЦИЕНТ (ВАНН-ГОФФ) 68.Сутектік көрсеткіш рН дегеніміз: СУ ЕРІТІНДІСІНДЕГІ СУТЕК ИОНЫ МОЛЯРЛЫҚ КОНЦЕНТРАЦИЯСЫНЫҢ ТЕРІС ТАҢБАМЕН АЛЫНҒАН ОНДЫҚ ЛОГАРИФМІ 69.Аздаған мөлшерде күшті қышқыл немесе күшті негіз қосқанда өзінің рН мәнін іс жүзінде өзгертпейтін ерітінді: БУФЕРЛІК 70.Судың иондық көбейтіндісі дегеніміз: СУТЕК ИОНЫ МЕН ГИДРОКСИД ИОНЫНЫҢ КОНЦЕНТРАЦИЯСЫНЫҢ КӨБЕЙТІНДІСІ ТҰРАҚТЫ ТЕМПЕРАТУРАДА, ТҰРАҚТЫ ШАМА [ ] [OH] 71.Қанның буферлік қасиеттерін қамтамасыз ететін амфолиттерге жатады: НӘРУЫЗДЫ БУФЕРЛІК ЖҮЙЕ 72.Генри заңы бойынша ерітіндінің берілген көлеміндегі берілген температурада еритін газдың мөлшері тура пропорционал болады: СҰЙЫҚ БЕТІНДЕГІ ГАЗ ҚЫСЫМЫНА 73.Изотонды ерітінділер – мына көрсеткіштері бірдей ерітінділер: ОСМОСТЫҚ ҚЫСЫМ 74.NaCl концентрлі ерітіндісінде қызыл қан түйіршіктері бүрісіп қалады. Бұл кезде орын алатын үдеріс: ПЛАЗМОЛИЗ 75.Қаналмастырғыштар ретінде қолданылатын барлық ерітінділер: ҚАНҒА ИЗОТОНДЫ БОЛЫП КЕЛЕДІ 76.Егер сілтінің ерітіндісіне артық мөлшерде қышқылдың ерітіндісін құйсақ, онда ортаның рН-ы былайша өзгереді: 9-ДАН 5-КЕ ДЕЙІН ТӨМЕНДЕЙДІ 77.Буферлік сыйымдылық дегеніміз: 1 л буферлі еретіндінің pH 1 бірлікке өзгерту үшін қажетті күшті қышқыл /HCl/ не күшті негіздің /NaOH/ эквивалентті концентрациясын айтады 78.Буфферлік ерітінділер дегеніміз мына ерітінделер: АЗДАҒАН МӨЛШЕРДЕ КҮШТІ ҚЫШҚЫЛДАРМЕН НЕГІЗДЕРДІ ҚОСҚАНДА СОНЫМЕН ҚАТАР СУМЕН СҰЙЫЛТҚАНДА РН ШАМАСЫН ТҰРАҚТЫ ТҮРДЕ САҚТАП ҚАЛАТЫН ЕРІТІНДІЛЕР 79.Төменде берілген қоспалардың ішінде буферлік әсер танытатыны: CH3COOH + CH3COONa. 80.Еріген заттың массалық үлесі көрсетеді: 100 г ЕРІТІНДІДЕГІ ЕРІГЕН ЗАТ МАССАСЫ 81.И.М.Сеченов заңы бойынша: Газдың электролит ерітіндісінде ерігіштігі қысым өскен сайын төмендейді 82.Дұрыс тұжырымды таңдап алыңдар. Ерітінділер: ТАЗА ЕРІТІНДІГЕ ҚАРАҒАНДА ЖОҒАРЫРАҚ ТЕМПЕРАТУРАДА ҚАЙНАЙДЫ 83. Жасушаны тұздың гипертонды ерітіндісіне батырғанда байқалатын құбылыс: ПЛАЗМОЛИЗ 84. Қантты емес диабет кезінде көп мөлшерде сұйылтылған несеп бөлінеді, оның осмостық қысымы 154,6 кПа-ға дейін төмендейді. Осындай несептің ерітіндісі қан плазмасына (Росм =740-780 кПа) қатысты ........ерітінді болып саналады: ГИПОТОНДЫ 85.Мына теңдеу С = kP газдар үшін кімнің заңының математикалық өрнегі болып табылады: ГЕНРИ ЗАҢЫ 86.Ерітіндідегі сутек иондарының концентрациясы өскенде: рН ЕРІТІНДІСІНІҢ САНДЫҚ МӘНІ ТӨМЕНДЕЙДІ 87. Мына жұптардың буферлік әрекет танытатыны: Н2CO3 + NaHCO3. 88. Молярлық концентрациясы 0,01 моль/л калий гидроксиді КОН ерітіндісінің рН мәні: рН = 12. 89.Төменде келтірілген жұптардың ішінен қанның буферлік жүйесіне кіретінін таңдап алыңдар: NHb+NHbO2 90. Ерітіндінің молялдық концентрациясы дегеніміз: 1000г еріткіштегі еріген зат мөлшері 91. Коллигативтік қасиеттерді анықтайтын қасиеттер: Еріген зат молекуласындағы иондарының саны 92. Ерітіндінің осмостық қысымы тәуелді: Ерітінділердің концентрациясына 93. Жасушаны гипотонды ерітіндіге батырғанда байқалатын құбылыс: Экзоосмос 94. Газдардың ерігіштігінің температураға байланысты тәуелділігі: Температура өскенде газдардың ерігіштігі төмендейді, себебі газдардың ерігіштігі экзотермиялық үдеріс 95. Буферлік ерітінділерді дайындау үшін мына заттардың жұбын алуға болады:H2CO3+NaHCO3 96. Ерітіндінің молярлық концентрациясы дегеніміз: 1 л ерітіндідегі еріген заттың мөлшері 97. Ерітінді бетіндегі еріткіштің қаныққан бу қысымының салыстырмалы төмендеуін анықтайтын көрсеткіш: Еріген заттың мольдік үлесіне тең 98. Ерітіндінің осмостық қысымы мынаған тәуелді: ЕРІТІНДІЛЕРДІҢ КОНЦЕНТРАЦИЯСЫНА 99. Қайнау температурасы кезінде: Қаныққан бу қысымы атмосфера бу қысымына тәуелді 100. Берілген ерітіндімен салыстырғанда осмостық қысымы жоғары ерітінді былайша аталады: Гипертонды 101. Ерітінді бетіндегі еріткіш қаныққан бу қысымының салыстырмалы төмендеуі тура пропорционал болады: Еріген заттың молдік мөлшеріне тең 102. Эбуллиоскопиялық тұрақты тәуелді: Еріткіштің табиғатына 103. Буферлік әрекет танытын ерітінді: C COOH+C COON 104. рН мәні берілген буферді дайындау үшін мына шамаларды білу қажет: Әлсіз электролиттің рН-ын және буферлік жүйе комп қатынасына тең 105. Сілті бойынша да, қышқыл бойынша да ерітіндінің буферлік сыйымдылығы жоғары болуы үшін рН =9,2 буферлік ерітінді дайындаған кезде мына қоспаны алу керек: D.Боратты , К = 6,0∙1 . 106. Қанға изотонды глюкоза ерітіндісінің концентрациясы: 5% 107. Қанға изотонды натрий хлориді ерітіндісінің концентрациясы: 0,9 пайыз 108. Байланыс полюстілігі жоғарырақ молекула: HF 109. Адамдар мен жануалардың тіршілігіне хлор мына формада қажет: Хлорид 110. Атомдары иондық байланыспен қосылған қосылыс: NaF 111. Адамдар мен жануарлар организміндегі минералдық алмасуды зерделеу үшін қолданылады: Радиоизотоптар 112. Органоген-элементтер қатарын көрсетіңдер: C.N.O.H.S 113. Организмдегі кальцийдің мөлшері шамамен 1,4% (70кг дене массасына 1 кг). Бұл элементті мына топқа жатқызуға болады: Макроэлементтің 114. Медициналық практикада дезинфекциялайтын зат және цианидтер үшін уқайтарғыш ретінде қолданылатын маргенецтің қосылысын көрсетіңдер. Оны қолдану мына химиялық қасиетіне негізделген: ТОТЫҚТЫРҒЫШТЫҢ 115. Уланғанда, толассыз құсу, жедел қан жоғалтқанда, шок кезінде, жараны, сілемей қабатын жуу үшін қолданылады: Натрий хлориді 116. Мына кешенді иондағы [Al(OH)x]ˉ кешентүзушінің координациялық санын анықтаңдар, егер орталық атомның заряды +3, ал лигандтың заряды -1 болса: 4 117. Калий гексанитрокобальтатының(III) химиялық формуласы: [Co(N ] 118. Электрстатикалық тартылыс күштерінің нәтижесінде түзілген химиялық байланыс былайша аталады: Иондық 119. Азот молекуласындағы байланыстың түрі: Ковалентті полюссіз 120. Көп ретте кешентүзуші ретінде бола алады: Катиондар 121. Мына қосылыс үшін кешеннің заряды нөлге тең: [Pt+2(N C ] 122. Құрамы [Pt(NH3)3Cl]Cl болатын кешенді қосылыстың аталуы: Хлоротриаминплатина II валентті хлориды 123. Кешенді қосылыстарда кешентүзуші мен лигандтардың арасында міндетті түрде байланыстың мынатүрі болады: Ковалентті полюсті донорлы акцеп 124. Қалқанша безі тироксиннің негізгі элементі (массалық үлесі бойынша 65%): Иод 125. Ауыз суындағы бұл элементтің аздаған концентрациялары қосылыстар түрінде тіс жегісінің алдыналады, ал жоғары концентрациялары – тіс эмалінде дақтардың пайда болуын тудырады: Фтор 126. Микроэлементтердің қатарын көрсетіңдер: Fe.Zn.F.Mo.Cu.Mn 127. Адам және жануарлар тіршілігі үшін фосфор мына түрде қажет: Фосфат 128. d-Қатарының микроэлементтерін көрсетіңдер: Fe CO CR 129. Адам және жануарлар тіршілігі үшін фтор мына түрде қажет: Фторид 130. Организмде иод көп мөлшерде кездесетін ағза: Қалқанша без 131. Организмге ауыз суы және тағамдық заттардың құрамында келіп түсетін су былайша аталады: Экзогенді 132. Донорлық-акцепторлық механизм бойынша коваленттік байланыс түзілетін қосылыс: 𝑵 𝑪𝒍 133. Екі ортақтасқан электрон жұптары арқылы екі атомның арасында түзілетін байланыс былайша аталады: Ковалентті байланыс 134. Кешенді қосылыстарда лигандтар мынадай қасиеттер көрсетеді: Электронды жұптың доноры 135. Мына кешенді қосылыстағы [Ni(NH3)6]Cl3 электрон жұптарының доноры мен акцепторын көрсетіңдер:𝑵𝒊+𝟑- акцептор, 𝑵𝑯𝟑-донор 136. Бромопентаамминкобальт(III) сульфаты атауына сәйкес келетін кешен: [Co(𝑵𝑯𝟑)𝟓𝑩𝒓]𝟐𝑺𝑶𝟒 137. Тұрақтырақ кешенді ион болып табылады: Кн[Fe(CN)6]3- = 1,0∙10-31 138. р-Қатарының микроэлементтерін көрсетіңдер: Br , I , Se. F 139. Хлор молекуласындағы химиялық байланыстың түрі: Коваленттік полюссіз 140. Байланысқан атомдар ядроларының арасындағы қашықтықтың аталуы: БАЙЛАНЫСТЫҢ ҰЗЫНДЫҒЫНА БАЙЛАНЫСТЫ 141. Кешентүзуші – металл ионының координациялық саны ең алдымен мынаған тәуелді: Металл табиғатына 142. Төменде келтірілген қосылыстардың ішінен ішкі кешенді қосылыстарға (хелаттар) жататыны: гемоглобин 143. Органоген-элементтер қатарын көрсетіңдер: C,O,N,P,S,H 144. Организм үшін уытты элементке жатқызуға болады: ҚОРҒАСЫН 145. Табиғаттағы (бүкіл Әлемдегі) ең көп тараған элемен: ОТТЕГІ, СУТЕГІ, АЗОТ 146.Атомның заряды тең болады: 0-ге тең болады 147. Молекуладасында байланыс s- және p-электрон бұлттарының қабысуынан пайда болған: NH3 148. Қышқылдық қасиеттері өте айқын байқалатын заттың формуласы HCl 149. Кальций мен фтор негізінен жинақталатын нысан: ТІС ЭМАЛІ 150. Асқазан сөлінің құрамына кіретін қышқыл: HCl 151. Уыттылығы өте жоғары (улы) элементтердің қатары: As, Tl, Hg, Cd, U 152. Антисептикалық, күйдіргіш әсер көрсететін зат: AgNO3 153. Адамдар мен жануарлардың тыныс алу ферметтерінің құрамына кіретін топтар: ФЕРРОПОРФИН 154. Мына кешендегі Na4[Сd(ОН)6] кешентүзуші-ионның координациялық санын (КС) көрсетіңдер: 6 155.Кешенді қосылыстардың мына белгілерінің ішінен оларды жіктеуге негіз болатындарын таңдап алыңдар: 1. Лигандтардың табиғаты 2. Кешентүзушінің табиғаты. 3. Кешеннің бояуы. 4. Кешенді ионның заряды. 5. Кешентүзушінің координациялық саны.
|
|
|
|
|
|
|
|
|
|
|
|
ЖАУАБЫ: 1,4
156. Лигандтың дентаттылығы дегеніміз: ІШКІ КООРДИНАЦИЯДАҒЫ ЛИГАНДТАР АЛАТЫН ОРЫН САНЫ
157. Орбитальдық квант саны атомның мына қасиеттерін анықтайды: Электрондардың, бұлттардың формасы
158. s-Орбитальдағы электрондардың максимал саны: 2
159. р-Орбитальдағы электрондардың максимал саны: 6
160. Бас квант санының n қабылдайтын мәндері: 1-7
161. d-Элементтеріне жататын элементтер жұбы: Fe CO CR
162. Төменде келтірілген үшінші период элементтерінің ішінен айқын бейметалдық қасиеттер көрсететіні: P, S, Cl As
163. Иондық байланыс дегеніміз: КАТИОНДАР МЕН АНИОНДАРДЫН АРАСЫНДА ЭЛЕКТРО-СТАТИКАЛЫҚ ТАРТЫЛУ КҮШІНІҢ НӘТИЖЕСІНДЕ ПАЙДА БОЛАДЫ.
164. Коваленттік байланыс дегеніміз: ОРТАҚ ЭЛЕКТРОН ЖҰБЫН ТҮЗУ АРҚЫЛЫ ПАЙДА БОЛАТЫН ХИМИЯЛЫҚ БАЙЛАНЫС.
165. Донорлық-акцепторлық байланыс дегеніміз: БІР АТОМНЫҢ ЭЛЕКТРОН ЖҰБЫ (ДОНОРЫ) ОРТАҚ, АЛ ЕКІНШІ АТОМНАН БОС ОРБИТАЛЬ (АКЦЕПТОР) БОЛАДЫ
166. Мына қатарда N2O3, P2O3, As2O3, Sb2O3, Bi2O3: Элементтері , металдық қасиеттері N-Bi қатарында артады
167.Сутектік байланыс дегеніміз: СУТЕК АТОМЫ МЕН ЭЛЕКТРТЕРІСТІЛІГІ ЖОҒАРЫ АТОМДАР АРАСЫНДА БОЛАТЫН ХИМИЯЛЫҚ БАЙЛАНЫС ТҮРІ
168. Периодта элементтің реттік нөмірі өскенде оксидтер қатарындағы қышқылдық қасиеттер:
169. Бейметалдарға жататын элементтердің қатары: H, B, C, Si. P, O, S, ГАЛОГЕНДЕР, АСЫЛ ГАЗДАР
170. Бір элементтің екі изотопының атомдары ерекшеленеді: ПРОТОН САНЫ БІРДЕЙ, БІРАҚ АТОМДЫҚ МАССАЛАРЫ ЖӘНЕ НЕЙТРОН САНЫ ӘРТҮРЛІ
171. Күрделі бейорганикалық заттарды әдетте төрт топқа бөледі: ТҰЗДАР, НЕГІЗДЕР, ОКСИДТЕР, ҚЫШҚЫЛДАР
172. Оксидтер деп мына қосылыстарды айтады: Тотығу дәрежесі -2 болатын оттек атомы болатын 2 элеметтен тұрады
173. Пероксидтер деп мына қосылыстарды айтады: Тотығу әрежесі -1 болатын оттек атомы болатын 2 элеметтен тұрады
174. Екідайлы оксидтерге жататын қатар: Cr,  ,A
,A  ,Z
,Z 
175. Негіздерге қышқылдармен реакция тән, олар ....... реакциясы деп аталады: Бейтараптау
176. Н2 молекуласындағы байланыстың түрі: Ковалентті Полюссіз
177. Сутектің тотығу дәрежесі -1 болатын қосылыс: NaH
178. Оттектің тотығу дәрежесі -1 болатын қосылыс: H2O2
179. Байланыстың сипатын былайша болжауға болады: Электртерістіліктің айырмасымен
180. Химиялық реакция міндетті түрде энергияны бөліп немесе сіңіріп жүреді, себебі: СЕБЕБІ ХИМИЯЛЫҚ РЕАКЦИЯ КЕЗІНДЕ БІР БАЙЛАНЫСТАР ҮЗІЛІП, БАСҚАЛАРЫ ТҮЗІЛЕДІ
181. Иондық қосылыстардан тұратын қатар: N  O, BaS
O, BaS  , Ca(OH
, Ca(OH 
182. Табиғатта тек ионды қосылыстар түрінде кездесе алатын металдардың қатарын көрсетіңдер: Li, Na, Ca
183. Сумен сутекті бөле әрекеттесетін металдардың қатарын көрсетіңдер: Ca, K, F
184. Стандартты сутек электродынан және өзінің тұзына батырылған металл электродынан тұратын гальваникалық элементте сутек бөле жүретін реакция жүреді. Металды көрсетіңдер: Zn+2  Z
Z  +
+ 
185. Ерітіндінің рН-ын мына тізбектің көмегімен өлшеуге болады: Салыстыру электронды және индикаторлық
186. Электродтық потенциалды есептеу үшін қолданылатын формула: Норнест
187. Түрлі электродтардың тепе-теңдіктегі потенциалының температура мен электролиттің концентрациясына тәуелділігі: Температура және электролитының концентрациясы өскенде потенциалдық шамасы өседі
188. Мембраналық потенциал негізінен мына иондар жұбының концентрациясымен анықталады:  ,
, 
189. Концентрациялары әр түрлі бір электролиттің екі ерітіндісінің немесе екі әр түрлі электролит ерітінділерінің жанасу шекарасында пайда болатын потенциал былайша аталады: ДИФФУЗЛЫҚ
190. Бейстандартты жағдайлардағы тотығу-тотықсыздану потенциалын анықтайтын фомула: E=E0 + (0.059/NHg)*lg[ОКИС]/[ВОССТ]
191. Потенциометрлік титрлеу деп титрлеу барысында эквиваленттік нүкте былайша анықталатын титриметрлік талдау әдісін айтады: ГАЛЬВАНИКАЛЫҚ ТІЗБЕКТІҢ ЭКҚ-СЫН ЗЕРТТЕЛЕТІН ЕРІТ. ӨЛШЕУІ
192. Кондуктометрлік титрлеу деп титрлеу барысында эквиваленттік нүкте былайша анықталатын титриметрлік талдау әдісін айтады: Зерттелетін ерітіндінің электрөткізгіштігін өлшеу
193. Молярлық концентрациясы бірдей электролиттердің сулы ерітінділерінің арасында электрөткізгіштігі ең жоғары болатын электролит: Тұз қышқылы HCL, NaOH
194. Молярлық концентрациясы бірдей электролиттердің сулы ерітінділерінің арасында иондық күші ең жоғары болатын электролит: Кальций хлориды CaCl2
195. Молярлық концентрациясы бірдей электролиттердің сулы ерітінділерінің арасында электрөткізгіштігі ең жоғары болатын электролит: Na гидроксиді (NaOH)
196. Тотығу-тотықсыздану электроды дегеніміз: ЗАТТЫҢ БІР УАҚЫТТА ТОТЫҚҚАН ЖӘНЕ ТОТЫҚСЫЗДАНУ ФОРМАСЫ БАР ЕРІТІНДІГЕ БАТЫРЫЛЫП ИНЕРТТІ МЕТАЛДАРДАН ТҰРАТЫН ЖҮЙЕ
197. Мембраналық потенциал негізінен мына катионның концентрациясымен анықталады: Ca
198.Тотығу-тотықсыздану потенциалының шамасы тәуелді болады: ЕРІТІНДІДЕГІ ЗАТТЫҢ ТОТЫҚҚАН ЖӘНЕ ТОТЫҚСЫЗДАНҒАН ФОРМАСЫНЫҢ КОНЦЕНТРАЦИЯСЫ
199.Тотығу-тотықсыздану электроды - құрамында .... бар ерітіндіге батырылған .... тұратын жүйе. Дұрыс сөздерді орнына қойыңдар. ИНЕРТТІ МЕТАЛЛ, БІРУАҚЫТТА ТОТЫҚҚАН ЖӘНЕ ТОТЫҚСЫЗДАНҒАН ЗАТ ФОРМАСЫНДА
200. Электрөткізгіштігінің мәні ең жоғары болатын биологиялық сұйықтықты немесе адам организмінің тінін көрсетіңдер: Жұлын сұйығы
201. Электрөткізгігштігінің мәні ең төмен адам организмінің тінін көрсетіңдер: Эпидермис
202. Электролиттер ерітінділеріндегі электр тогын тасымалдаушылар - ....., олар электролиттің ....... нәтижесінде түзіледі. Жіберілген сөздерді орнына қойыңдар. Иондар молекуласының диссоцациялануы
203. Стандартты сутектік электрод – бұл: Стандартты жағдайы потенциалдар 0-ге тең болатын электролид
204. Мыс электродының потенциалын мына формула бойынша анықтауға болады: E=  +0,059/2
+0,059/2  loga(C
loga(C  )
)
205. Мембраналық потенциал – мына шекарада пайда болатын потенциал: ҚҰРАМЫ ӘРТҮРЛІ ЕКІ ЕРІТІНДІ НЕМЕСЕ КОНЦЕНТРАЦИЯСЫ ӘРТҮРЛІ СОЛ БІР ЭЛЕКТРОЛИТТІҢ ЕРІТІНДІСІН БӨЛІП ТҰРАҒАН ӨТІМДІЛІГІ ТАЛҒАМДЫ МЕМБРАНАНЫҢ (ЖАРТЫЛАЙ ӨТКІЗГІШТІК ҚАБАТЫ АРАСЫНДА )
206. Төмендегі кондуктометрлік титрлеу қисығы мына реакцияға сәйкес келеді: HCl + NaOH
207. Фазааралық бөліну ауданы өскенде беттік энергияның өзгеруі: ӨСЕДІ
208. Көміртек(IV) оксиді қатты кальций оксидіне адсорбцияланғанда СаСО3 түзіледі. Бұл үдерістің атауы: ХИМИЯЛЫҚ АДСОРБЦИЯ
209. Мына берілген заттардың қайсылары: Nа2SО4 (1), Н3РО4 (2), КОН (3), изоамил спирті (СН3)2СН(СН2)2ОН (4), анилин С6Н5NН2 (5), пальмитин қышқылы СН3(СН2)14СООН (6) суға қатысты беттік белсенділік қасиеттер танытады: 4-5-6
210. Адсорбция изотермасы адсорбцияның мына факторға тәуелділігін көрсетеді: КОНЦЕНТРАЦИЯСЫ
211. Мына қатардағы СН3СН2СН2СООН > СН3СН2СООН > СН3СООН беттік керілістің заңдылығын сипаттайтын ереже: Дикло-Траубе ережесі
212. Қатты дененің немесе сұйықтықтың газ тәріздес немесе еріген затты сіңіруі былайша аталады: Адсорбция
213. Пластмасса пластинкасына бір тамшыдан: бензин, сынап және су тамызылды. Бұл кезде бензиннің тамшысы жайылып кетеді, сынап тамшысының формасы шар тәрізді болады, ал су тамшысы жалпаяды: Сынап, Су, Бензин

Осы заттарды беттік керілістерінің төмендеуі бойынша қатарға орналастырыңдар.
214. Оң адсорбция кезіндегі адсорбенттің беттік керілісі ....... және оң адсорбцияланатын заттар ........ деп аталады:Төменгі беттік белсенді заттар
215. Панет-Фаянс ережесіне сәйкес Ca2+, Mg2+, Cl‾, Br‾, J‾, K+ иондарының ішінен АgCl бетінде талғамды адсорбциялана алатындары: Хлор ( Cl)
216. Қатты дененің бетінде жүретін молекулалық адсорбция мына заттарға тән: Бейэлектролит және газдарға
217. Судың бетінде ББЗ молекуласының дұрыс бағытталуына сәйкес келетін сурет:
218. Мына берілген иондардың: NO3‾, Na+, PO43-, Sr2+, Al3+, Br‾, SO42- адсорбент SrSO4 бетінде адсорбциялана алатындары: Sr2+, S 
219. Г = –С/RT(Δσ/ΔC) теңдеуі қандай фазалардың бөліну шекарасындағы адсорбцияны сипаттайды: Cұйықтық-сұйықтық , сұйықтық-газ
220. Мына тұжырымдама: «Қаныққан қышқылдар мен спирттердің қатарында тізбек бір СН2-тобына ұзарғанда сулы ерітіндіде гомологтың беттік белсенділігі 3-3,5 есе өседі» сәйкес келетін ереже (заң): Дикло-Траубе ережесі
221. Коллоидтық химияда қос электрлік қабат түзілген кезде бет аудан зарядының таңбасын анықтау үшін қолданылатын тұжырым (ереже): Панет-Фаянс
222. Бір заттың екінші бір зат бетінде жинақталу үдерісі былайша аталады: Адсорбция
223. Атмосфералық қысымның күрт төмендеуі кессон ауруын тудыруы мүмкін. Мұндай сырқатты емдеу үшін: Ауруды барокамераға апарып жоғары қысым береді де кейін қысымды жайлап түсіреді
224. Мына теңдеу Г = Гmax P/ (K + P) ..... теңдеуінің математикалық өрнегі болып табылады: Ленгмюр
225. Талғамды адсорбцияны анықтайтын ереже: Панет Фаянс
226. Бүйректің жұмыс жасауының негізінде жатқан үдеріс: Диализ
227. Пластинкаға бір тамшыдан үш сұйықтық тамызылды: 3-2-1
228. Өкпенің жоғары адсорбциялық әсері мына физикалық сипаттаманың салдарына байланысты: Өкпенің кеңейуі
229. Сумен талғамды суланатын беттердің аталуы: Гидрофилді
230. Газ фазадан адсорбенттің қатты бетіне сәйкес келетін адсорбция изотермасының қисығы: В - график

231. Беттік белсенді зат:  ОН
ОН
232. Коллоидтық ерітінді арқылы жарық шоғын өткізгенде байқалатын құбылыс: Жарықтың шашырауы, (дифрокатция)
233. Коллоидтық ерітінділерді тазарту әдісі: Электродиализ
234. Электрофорез кезінде қозғалады: Дисперсті фазаның зарядталған бөлшегі
235. Мыс(ІІ) гидроксидінің золі теріс зарядталған бөлшектерден тұрады. Мына қосылған электролиттердің ішінде коагуляция табалдырығы ең төмен: Алюминий хлориді (III) AlCl3
236. Салмақ күштерінің әсерінен қалқып жүрген (диспергацияланған) бөлшектердің тұну жылдамдығы ескермеуге болатындай өте аз жүйелер былайша аталады: Кинетикалық тұрақтылық
237. Теріс зарядталған бөлшектері бар коллоидтық ерітіндінің бөлшектері қай электродқа қарай қозғалады: Анодқа
238. Нәруыздың ісіну дәрежесінің ортаның рН-ына тәуелділігі екі максимумы және бір минимумы бар қисықпен сипатталады. Минимумға сәйкес келетін нүктені былайша атайды: Изоэлектрлік нукте
239. Коллоидтық бөлшектердің аттас зарядтарының және (немесе) еріткіш молекулаларынан тұратын сольват қабығының болуымен байланысты тұрақтылықтың түрін былайша атайды: Агрегаттық
240. Төменде келтірілген анықтамалардың ішінен электрофорезге сәйкес келетінін таңдай алыңдар: Электр тогының әсерінен дисперсті фаза бөлшегінің қарама-қарсы зарядталған электродқа қарай қозғалысы
241. Бөлшектері теріс зарядталған кремний қышқылының золі үшін мына қатарда СrС13 (1), Ва(NО3)2 (2), К2SО4 (3) коагуляция табалдырығы былайша орналасады: 3>2>1
242. Дисперстік фазасы сұйық ортада қалқып жүрген өлшемдері 10-5 м-ден (100 мкм) жоғары болатын қатты бөлшектерден тұратын микрогетерогенді жүйенің аталуы: Суспензия
243. Дисперстік фаза бөлшектерінің ірірек агрегаттарға жабысуы (бірігуі) былайша аталады: Коагуляция
244. Оң зарядталған бөлшектері бар зольге теріс зарядты бөлшектері бар зольді қосқан кезде байқалатын үдеріс: ӨЗАРА КОАГУЛЯЦИЯ
245. Коллоидтық ерітінділердің молекулалық-кинетикалық қасиеттеріне жатады: БРОУНДЫҚ ҚОЗҒАЛЫС
246. Каучуктың ісіну дәрежесі ең төмен болатын еріткіш: СУ
247. Ионданған негіздік және қышқылдық топтарының саны тең полиэлектролит молекуласының зарядтары бірдей болатын күйі былайша аталады: Изоэлектрлік күй
248. Температура жоғарылағанда құрылымданған жүйелердің тұтқырлығы: ҚҰРЫЛЫМЫН БҰЗЫЛУЫНА БАЙЛАНЫСТЫ ТӨМЕНДЕЙДІ
249. Артық мөлшерде алынған күміс нитратының сулы ерітіндісіне баяу натрий хлоридінің сулы ерітіндісі қосылды. Күміс хлоридінің коллоидтық ерітіндісі түзілді. Золь бөлшектерінің заряды: ОҢ
250. Оң зарядталған бөлшектері бар коллоидтық ерітіндіге мына иондарды қосқан кезде жоғары коагуляциялық белсенділік және тез коагуляция байқалады: РО43-
251. Фарадаей-Тиндаль эффекті мына жүйелерде байқалады: КОЛЛОИДТЫ ЕРІТІНДІЛЕРГЕ
252. Дисперстік фазасы сұйық ортада қалқып жүрген өлшемдері 10-7 – 10-9 м (1-100 мкм) болатын қатты бөлшектерден тұратын микрогетерогенді жүйенің аталуы: КОЛЛОИДТЫ-ДИСПЕРСТІ
253. Жартылай өткізгіш мембраналардың кішімолекулалық қоспаларды (иондар мен молекулаларды) өткізіп, коллоидтық бөлшектерді ұстап қалу қасиеттеріне негізделген құбылыс: ДИАЛИЗ
254. Дисперстік фазасы сұйық ортада қалқып жүрген өлшемдері 10-5 см (100 мкм) болатын сұйық бөлшектерден тұратын микрогетерогенді жүйелердің аталуы: 1  Эмульсиялар
Эмульсиялар
255. Сұйықтықтың беттік керілісі температура жоғарылағанда: Төмендейді
256. “Агрегаттық тұрақтылық” дегеніміз: Дисперсті фаза бөлшегінің бір-біріне жабыспау (Іріленбеу, сөйтіп белгілі бір дисперстену)
257. Артық мөлшерде алынған NaJ сулы ерітіндісіне баяу AgNO3 сулы ерітіндісі қосылды. Күміс иодидінің коллоидтық ерітіндісі түзілді. Золь бөлшектерінің зарядын көрсетіңдер: ТЕРІС
258. Электроосмос кезінде электр өрісінде қозғалатын бөлшектер: ДИСПЕРСТТІК ОРТА
259. Ас қорыту кезіндегі майларды эмульгациялайтын зат: ӨТ ҚЫШҚЫЛЫ
260. Инсулиннің изоэлектрлік нүктесі 6-ға тең. Нәруыздың электрофорездік қозғалғыштығы ең төмен болатын рН-тың мәні: 6
261. ЖМҚ концентрациясы өскенде олардың осмостық қысымы тезірек өседі де, Вант-Гофф заңына бағынбайды. Ауытқудың себебі мынада: ЖМҚ ИКЕМДІ ТІЗБЕКТЕР БІРНЕШЕ ҚЫСҚА МОЛЕКУЛАЛАР РЕТІНДЕ ӘРЕКЕТ ЕТЕДІ
262. Сынауықтағы суға шайқай отырып, бірнеше тамшы шайыршықтың (канифоль) ерітіндісі қосылды. Коллоидтық ерітіндіні алу әдісінің аталуы: ЕРІТКІШТІ АЛМАСУ
263. Көп мөлшерде алынған күміс нитратының сулы ерітіндісіне натрий хлоридінің сулы ерітіндісі абайлап қосылды. Коллоидтық ерітіндіні алу әдісінің аталуы: КОНДЕНСАЦИЯЛАУ ӘДІСІ
264. Дисперстік фазасы сұйық ортада қалқып жүрген өлшемдері 10-5 см-ден (100мкм) жоғары қатты бөлшектерден тұратын микрогетерогенді жүйенің аталуы: СУСПЕНЗИЯ
265. Әр түрлі зарядталған бөлшектері бар зольдерді араластырған кезде орын алатын құбылыс: КОЛЛОИДТЫ ӨЗАРА КОАГУЛЯЦИЯЛАУ
266. Теріс зарядталған бөлшектері бар мыс(ІІ) сульфиді золінің ерітіндісіне қосылған иондардың ішінде коагуляциялық қабілеті ең жоғарысы: Al 3+
267. Жекелеген электролиттің әсеріне қарағанда электролиттер қоспасының тиімдірек әсері былайша аталады: ЭЛЕКТРОЛИТТІҢ СИНЕРГИЗМІ
268. Эмульсияға жататын жүйе: БЕНЗОЛ, NaCl, БӨЛШЕК
269. Коллоидтық бөлшектердің ірірек агрегаттар түзіп, бір-біріне жабысу үдерісі былайша аталады: КОАГУЛЯЦИЯ
270. Желатиннің сулы ерітіндісіне спиртті қосқанда ерітіндіге еріген затпен байытылған тамшылардың бөлінуі байқалады. Бұл құбылыстың аталуы: КОАЦЕРВАЦИЯ
271. Жоғарымолекулалық заттарды (крахмал, желатин, альбумин) қосқанда лиофилді зольдердің электролиттердің коагуляциялық әсеріне тұрақтылығының өсуі былайша аталады: КОЛЛОЙДТТЫҚ ҚОРҒАНЫС
272. Медицинада менингитті диагностикалау үшін жұлын сұйықтығының «алтын санын» анықтайды. «Алтын саны» мынаны сипаттайды: КОАГУЛЯЦИЯНЫҢ ҚОРҒАНУ ҚЫЗМЕТІН
273. «Протаргол» және «Колларгол» препараттары ..... дисперсті жүйе болып табылады, ондағы химиялық элемент ....: КОЛЛОИДТЫҚ, КҮМІС
274. Сірнелер мен гельдердің көлемінің сұйықтықтың бөлінуі салдарынан өздігінен кішірею құбылысын былайша атайды: СИНЕРЕЗИС ҚҰБЫЛЫСЫ
275. Субстанциялардың (бірқатар химиялық ерітінділер немесе биологиялық құрылымдар, мысалы, жасушалардың цитоплазмалары) механикалық әсердің нәтижесінде тұтқырлықтарының төмендету және тыныштық күйде тұтқырлықтарын өсіру қабілеті былайша аталады: ТИКСОТРОПИЯ
276. Полимердің массасы және көлемінің өсуі арқылы жүретін жоғарымолекулалық қосылыстың кішімолекулалық еріткішті өздігінен таңдамалы сіңіру үдерісі былайша аталады: ІСІНУ
277. Мицелланың формуласын жазған кезде потенциаланықтағыш иондарды мына ережеге сәйкес таңдайды: ПАНЕТ-ФАЯНС
278. Физиотерапевтік әдіс – дәрілік заттың ерітіндісін (иондарын) электр өрісінің әсерінен тері немесе сілемейлі қабат арқылы денеге енгізу мына құбылысқа негізделген: ЭЛЕКТРОФОРЕЗ
279. Эмульсиядағы дисперстік фаза мен дисперсиялық ортаның агрегаттық күйлерін көрсетіңдер: СҰЙЫҚ-СҰЙЫҚ
280. Дұрыс тұжырымды көрсетіңдер: «Этиленді бромдау кезінде....»: ЭЛЕКТРОФИЛ РЕТІНДЕ B  БОЛАДЫ
БОЛАДЫ
281. Мына формуладағы CH3→ CH2→ Br атомдардың арасындағы бағдар көрсете:  -байланыстардың тізбегі бойынша электрондық тығыздықтың ығысуын
-байланыстардың тізбегі бойынша электрондық тығыздықтың ығысуын
282.Спирттер, аминдер, тиолдарға тән реакцияның түрі және механизмі: 
283.Спирттер, аминдер, тиолдарға тән реакцияның түрі және механизмі: 
284.Спирттердің дегидратациялануы қандай механизм бойынша жүреді: E МОНОМОЛЕКУЛЯРЛЫҚ
285.Алкендерге тән реакцияның түрі және механизмі: 
286.Арендерге көбірек тән реакцияның түрі және механизмі: SE Электрофильді орынбасу
287.Қаныққан көмірсутектерге тән реакцияның түрі және механизмі: SR Радикалды орынбасу
288.Пропеннің хлорсутекпен әрекеттесу реакциясының түрі және механизмі: АЕ Электрофилді қосып алу
289.Марковников ережесі бойынша жүретін әрекеттесу реакциясы: Пропеннің сутекпен
290.Төменде келтірілген органикалық қосылыстың қайсысында sp3-гибридтік күйдегі көміртек атомы бар: 4-хлорлы көмірсу
291.Ацетилен молекуласының С2Н2геометриялық формасын көрсетіңдер: Сызықтық
292.Нуклеофилді бөлшектің ең маңызды белгісін таңдап алыңдар: Атомның сыртқы электрондық деңгейінде бөлінбеген электрон жұбының болуы
293.Электрофилді бөлшектің ең маңызды (негізгі) белгісін таңдап алыңдар: Бос валентті орбитальдің болуы
294.Жұптаспаған электроны бар және заряды жоқ бөлшектің аталуы: Бос радикал
295.Ароматты көмірсутекке жатады: Толуол
296.sp3-, sp2- және sp-гибридтік күйдегі көміртек атомдарына сәйкесінше қандай валенттік бұрыштар тән 109,50, 1200, 1800
297.Ең жоғары теріс индуктивтік әсер (–Ј) танытатын топ: -СL
298.Қосарланған жүйеге жатады:Жауабы: С. КЕЗЕКТІ БІР ЖАЙ ҚОСБАЙЛАНЫС
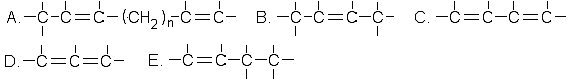
299.Бензолдың гомологтарын алған кезде (Фридель-Крафтс реакциясы) алкилдеуші реагент болып табылады: R-Cl, AlCl3
300.Полимерлену реакциясы мына көмірсутекке тән: Изопренге
301.Бензолды синтездеуге болатын қанықпаған көмірсутек..... және бұл кезде реакцияға заттың ...... мөлшері қатысады: 3 моль ацетилен
302. -С6Н5радикалының аталуы: Фенил
303. Қосылысты халықаралық номенклатура бойынша атаңдар: 1,4-дибром – 4-метилпентен-2

304. Наркоз үшін келтірілген заттардың ішінен С2Н5-О-С2Н5 формуласына сәйкес келетін затты көрсетіңдер: Диэтил эфирі (этоксиэтан)
305. Электрофилді реагенттер дегеніміз – бұл: Электрон жұбын өзіне тартып алады, акцепторы болатын бөлшектер
306. Нуклеофил – бұл: Электрон жұбынберетін, доноры болатын бөлшек
307. Радикалды реагенттер болып табылады: ЖҰПТАСПАҒАН ЭЛЕКТРОНДАР НЕМЕСЕ БОС АТОМДАР
308. Электрофилді қосып алу реакциясы мына қосылыс үшін мүмкін болады: АЛКЕНДЕР, ЦИКЛОАЛКЕНДЕР, АЛКИНДЕР
309. Келтірілген қосылыстардың ішінде монофункциялық қосылысқа жатады: Гидроксибензол (фенол)
310. Келтірілген қосылыстардың ішінде полифункциялық қосылысқа жатады: ЖҮЗІМ ШАРАП ҚЫШҚЫЛЫ
311. Келтірілген қосылыстардың ішінде монофункциялық қосылысқа жатады: Пальмитин қышқылы
312. Келтірілген қосылыстардың ішінде монофункциялық қосылысқа жатады: Ацетон
313. Бренстед қышқылдары дегеніміз мына бөлшектер: (ДОНОР) Протон беруге бейім бейтарап молекула және иондар
314. Бренстед негіздері дегеніміз мына бөлшектер: (акцептор) Протон қосып алуға бейтарап молекула және иондар
315. Мына анықтама «Бос орбитальдары бар және электрон жұбын қосып алып коваленттік байланыс түзуге қабілетті атом, молекула немесе ион» сәйкес келеді: ЛЬЮИС ҚЫШҚЫЛЫНА
316. Коваленттік байланыс гомолиттік үзілген кезде түзілетінбөлшектер: Бос радикалдар
317. Бутадиен-1,3 молекуласындағы С2 – С3байланысының ұзындығы бутан молекуласындағыға қарағанда қысқарақ. Мұны немен түсіндіруге болады: р-ЭЛЕКТРОН БҰЛТТАРЫНЫҢ БҮЙІРІНЕН ҚАБЫСУЫНЫҢ НӘТИЖЕСІ  ЖӘНЕ
ЖӘНЕ  АТОМДАРЫНЫҢ АРАСЫНДА ҚОСЫМША Д- БАЙЛАНЫСТАРЫНЫҢ ТҮЗІЛУІМЕН
АТОМДАРЫНЫҢ АРАСЫНДА ҚОСЫМША Д- БАЙЛАНЫСТАРЫНЫҢ ТҮЗІЛУІМЕН
318. Брёнстед-Лоури теориясына сәйкес күштірек қышқщыл болып табылады:  SH
SH
319. Келтірілген орынбасарлардың қайсысы бензол сақинасындағы орто- және пара-орындардағы көміртек атомының электрондық тығыздығын арттырады: C2 
320. Кетондар осы спирттерден тотықтырған кезде алынады: Екіншілік спирттерден
321. Бетаинді алу реакциясының типін көрсетіңдер: ТОТЫҒУ

322.Үшіншілік спирт: 2-метилпропанол-2
323. Адреналинге мына органикалық қосылыстардың қасиеттері сәйкес келеді: Аминдер және спирттер

324. Этанаминді ацетамидтен және хлорэтаннан алу реакцияларының сәйкесінше типтерін көрсетіңдер: Тотықсыздану, нуклеофилді орын басу
1) СН3CONH2→ С2Н5NH2 2) С2Н5Cl → С2Н5NH2
325. Хлорлы этилге NaOH сулы ерітіндісімен әсер еткенде алынатын қосылыс: С2Н5ОН
326. 1,2-диолды фрагментке сапалық реакцияны жүргізетін қосылыс: Cu(O 
327. Фенолды бромдау реакциясының типі мен механизмі: Электрофильді орын басу SE
328. Этиленгликоль этиленнің мына затпен әрекеттесуі кезінде түзіледі: KMn  сулы ерітіндісімен
сулы ерітіндісімен
329. Элиминдеу реакциясымен этиленді алу үшін қажет бастапқы қосылыс: Этанол
330. Анилин құрылысы төмендегідей аминдерге жатады: Біріншік ароматты
331. Көп атомды спирттердің сапалық реакциясына мына әрекеттесу жатады: Cu(O 
332. AN механизмі бойынша этанолды алу үшін мына субстраттар мен реагенттер қажет: Хлорэтан NaOH
333. Нәруыздардың шіру өнімдерінің бірі путресцин Н2N-СН2-СН2-СН2-СН2-NН2ИЮПАК жүйелік номенклатурасы бойынша былайша аталады: БУТАНДИАМИН-1,4
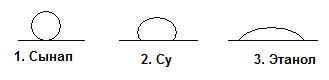
334. Этанолдың сәйкесінше ацетальдегидке, этиленге және хлорэтанға өту реакциясының типін көрсетіңдер: Тотығу, элиминдеу, нуклеофилді орын басу
1) С2Н5ОН → СН3СНО 2) С2Н5ОН → С2Н4 3) С2Н5ОН → С2Н5Cl
335. Адреналинді қосылыстардың мына түріне жатқызуға болады: АМИНДЕР ЖӘНЕ СПИРТТЕР

336. Қосылыстардың класын көрсетіңдер: АЛИФАТТЫ АМИН, АРОМАТТЫ ТИОЛ, АЛИФАТТЫ ҚАНЫҚПАҒАН СПИРТ

337. Метоксиметан жатқызылатын қосылыстардың класы: ЖАЙ ЭФИРЛЕР
338. Бутанолдың изомерінің саны: 3
339. Екі атомды фенолдарға жатады: Б , Д

340. Кето-енолдық таутомерия қосылыстардың мына класына тән: ОКСОҚОСЫЛЫСТАРҒА
342. Диспропорциялану реакциясына (Канниццаро реакциясы) түсетін альдегид: Бензальдегид
343. Альдегидтер тотыққанда түзілетін зат: Карбон қышқылы
344. Күміс формиаты мен 1-бромпропанның әрекеттесу өнімі: Пропилформиат
345. Сулы ерітіндіде көбірек гидратталған мына оксоқосылыс: Хлораль
346. –ОН және –СНО функциялық топтары болатын қосылыс: Гидроксиальдегид
347. Сүт қышқылынан пирожүзім қышқылының түзілуі мына үдеріс болып табылады: Тотығу

348. Альдольды СН3-СН(ОН)-СН2-СНО әлсіз тотықтырғышпен (күмістің аммиакты кешені) тотықтырған кезде түзілетін қосылыс: β-оксомай қышқылы
349. Ацетальдегид пен этанолдың әрекеттесу реакциясы мына механизммен жүреді: 
350. Альдегид пен спирт әрекеттескен кезде түзілетін қосылыс: Жартылай ацеталь
351. 2-метилбутен-2 және HBr әрекеттесу өнімі: 2-бром, 2-метилбутан
352. Кетондардың жалпы формуласы: R-COOR
353. Альдегидтердің жалпы формуласы: R-C=O
354. Ацетонның СН3 – СО – СН3тотықсыздану өнімі: ПРОПАНОЛ-2
355. Мына оксоқосылыстарды атаңдар: Бензальдегид, Кратон альдегиді, ДИБЕНЗОН

356. Формалиннің қышқылдық қасиеттерінің пайда болуына химиялық реакцияныңмына типі әкеледі: Тотығу
357. Құрылысы СН3-СО-R оксоқосылыстарды ашу үшін жалпы ракция: Галоформдық
358. Пропаналь және пропанон бір-бірінемынадай изомер болып табылады:Функциональды топ
359. Төмендегі күрделі эфирлердің дұрыс атауларын көрсетіңдер: 1-Пропилформиат 2-Изопропилацетат 3-Этилбензоат

360. Тотығу реакцияларында альдегидтер мына қосылыстар класының арасындағы аралық қосылыс болып табылады: Біріншілік спирт , Карбон қышқылы
361. Құрылысы төмендегідей затты ХН бойынша атаңдар: 3,3 диметилгексаналь

362. Мына қышқылдарды орналасу ретімен атаңдар: Сүт, пирожүзім және изомай қышқылы
1) СН3-СН(ОН)-СООН 2) СН3-СО-СООН 3) СН3-СН(СН3)-СООН
363. «Күмісайна реакциясы» - мына қосылыстарға сапалық реакция: Альдегидтерге
364. Мына амидтердің дұрыс атауларын көрсетіңдер: Формамид, ацетамид, бензамид
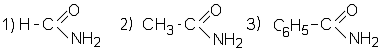 С4Н5NO2
С4Н5NO2
алидоформиат 2) алидоацетат 3) алидофенон
365. Пропаналь және пропанон тотықсызданған кезде қандай өнімдер түзіледі: Пропанол -1, пропанол -2
366. Спирттер альдегидтермен әрекеттескенде оңай түзіледі: Жартылай ацетальдар
367. Мына өзгерістер тізбегінде: дофамин →А норадреналин Б→ адреналин А және Б сатыларына сәйкес келетін үдерістер: Гидроксилдеу және метилдеу
368. Қымыздықсірке қышқылының кето-енолдық таутомериясының болу себебі мынада: СН-ҚЫШҚЫЛДЫҚ
369. Ацилдеуші агент болып табылады: (СН3СО)2
370. Сірке қышқылына қарағанда құмырсқа қышқылы өзгешелеу әрекеттесетін химиялық зат: A  O АММИАКТАҒЫ ЕРІТІНДІСІ
O АММИАКТАҒЫ ЕРІТІНДІСІ
371. Фталь қышқылы диметил эфирінің құрылысын сипаттайтын формула: В.

372. Берілген қосылыстардың ішінен гетерофункциялығын көрсетіңдер: Аминпропан қышқылы NH2 – CH2 - CH2 - COOH
373. 100°С-тан жоғары қыздырғанда малон қышқылы НООС-СН2-СООН түсетін өзгеріс: Декарбоксилдеу
374. Мына қосылысты халықаралық номенклатура бойынша атаңдар: СН3-СН(СН3)-СН2-СН(NН2)-COOH 2-амино 4-метилпентан қышқылы
СН3-СН(СН3)-СН2-СН(NН2)-COOH
375. Сірке қышқылы хлордың артық мөлшерімен әрекеттескенде түзілетін қосылыс: Трихлорсірке қышқылы
376. Төменде келтірілген реакцияны жүргізетін реагент: HCl

377. ГАМҚ (γ-аминмай қышқы) формуласы: N  -C
-C  -C
-C  -C
-C  -COOH
-COOH
378. Мына қосылыстардың ішінен күрделі эфирді табыңдар: E.
379. Карбон қышқылдарының ангидридтері карбоксил тобының гидроксилін мына топқа алмастырғанда түзіледі: Ацил тобына
380. Гидроксиқышқылдың құрамында мына функциялық топтар бар: -СООН, -ОН
381. Этерификациялау реакциясы – мына үдеріс: Спиртті қышқылмен ацилдеу
382. Келтірілген күрделі эфирлердің атауларын көрсетіңдер: Пропилформиат,изопропилацетат және этилбензоат

383. Организмде пирожүзім қышқылы сүт қышқылына дейін тотықсызданады. Бұл репкцияға сәйкес келетін теңдеу: C  -CO-COOH
-CO-COOH  C
C  -CH(OH)-COOH
-CH(OH)-COOH
384. Ацетил радикалы: C  COO-
COO-
385. Пируват-лактат тотығу-тотықсыздану жүйесіне қатысатын қышқыл: Сүт қышқылы
386. Сірке қышқылы мен этил спирті әрекеттесу нәтижесінде түзілетін өнім: Этилацетат
387.Химиялық жіктеу бойынша адамның зат алмасуының азоты бар ақтық өнімі несепнәр Н2N-CO-NH2 мына қосылыс болып табылады: Көмір қышқылының диамиді
388. Қосылысты атаңдар: Фенол, салицил қышқыл

389. Қосылысты атаңдар: Никотин қышқылы

390. Қосылысты атаңдар: Сульфанил қышқылы 1-АМИНО, 4-СУЛЬФАБЕНЗОЛ

391. Мына карбон қышқылдарын:
1. СН3СН(ОН)СООН 2. СН3СОСООН 3. НООС – СООН
халықаралық номенклатура (ИЮПАК) бойынша атаңдар: 2 – гидроксипропан . 2- оксопропан. этанди
392. Сүт қышқылы қосылыстардың мына кластарының химиялық қасиеттерін көрсететді: Қышқылдар мен спирттердің
393. Оптикалық белсенді зат: 2- Гидроксипропан қышқылы CH3 CH(OH)COOH
394. Төменде келтірілген қосылыстардың ішінен гетерофункциялық қосылыстарға жататынын табыңдар: А

395. Зәр қышқылына сәйкес келетін формула: а,б

396. Салицил қышқылының туындыларына жатады: B, Г.

397. Лактам мына қосылысты қыздырғанда түзіледі: -аминмай қышқылын
398. Полипептидтің түзілу реакциясы мына реакцияға жатады: Поликонденсациялану
399. Ароматты α-аминқышқылдарына сапалық реакция: Ксантопротеинді
400. Нәруыздың біріншілік құрылымын анықтайтын байланыстың түрі: Амидті( пептидті)
401. α-Аминқышқылы изолейциндеегі СН3-СН2-СН(СН3)-СН(NН2)-СООН радикал: Алифатты
402. Нәруыздардың екіншілік құрылымын бекітетін негізгі байланыстың түрі: Сутектік
403. Нәруыздар мен пептидтердегі пептидтік байланыстарды ашу үшін қолданылатын реакция: Биурет
404. Хиралды орталығы жоқ және оптикалық белсенділік танытпайтын α-аминқышқылы: Глицин
405. Бұлшықеттер миозинінің изоэлектрлік нүктесі 5-ке тең. Нәруыздың электрфорездік қозғалғыштығы ең төмен болатын рН-тың мәні: 5
406. 2-амин-3-гидроксипропан қышқылының аталуы: Серин
407. Төменде келтірілген α-аминқышқылы – валин мына стереохимиялық қатарға жатады: L-қатарға

408. α-Аминқышқылын атаңдар: Фенилаланин

409. α-Аминқышқылын атаңдар: Гистидин

410. Гетероциклді α-аминқышқылына жатады: Триптофан
411. Треонин α-аминқышқылындағы хиралды орталықтардың саны: 2

412. Тиол тобы бар α-аминқышқылы: Цистеин
413. Жаруарлар организмінің нәруыздарын түзуге қатысатындар:  -L-аминқышқылдары
-L-аминқышқылдары
414. Сериннің декарбоксилденуі кезінде түзілетін зат: Коламин
415. Pb+2 сапалық реакциясының көмегімен мына трипептидті ашуға болады: Глу-цис-три
416. Биурет реакциясына түсетін аминқышщқылдары: ТРИПЕПТИД
417. Қайталанып келетін дисахаридтік бірліктерден тұратын, механикалық беріктігі жоғары және өсімдіктердің тірек материалдарының рөлін атқаратын гомополисахаридтік көмірсуды атаңдар: Целлюлоза
418. D-глюкоза альдогексозаға сәйкес келетін кетогексоза: Д-фруктоза
419. Сызықтық (тармақталмаған) полисахаридтері бар көмірсу: Амилоза
420. Молекулалық массасы өте жоғары, молекулалары мықты тармақталған, жануарлар организмінде энергия қоры қызметін атқаратын, көп мөлшерде бауырда жинақталатын гомополдисахарид көмірсуды атаңдар: Гликоген
421. Гидролиз кезінде төмендегі реакция өнімдерін беретін: Сахароза
Х + Н2О → D-Глюкоза + D-Фруктоза
422. 2-Дезокиси-D-рибоза D-рибозаға қатысты болады: Туынды
423. D-глюкоза мен D-фруктозаның изомериясы мынаған байланысты: Оксо-топтың формасына
424. Тотықсыздандыратын дисахаридке жатады: Мальтоза
425. Екі D-глюкоза молекуласын түзіп гидролизденетін дисахарид: Целлюбиоза
426. РНҚ-ның (нуклеин қышқылының) құрылымдық компоненті болып табылады: D-Рибоза
427. Биологиялық сұйықтықтарда глюкозаны анықтау үшін қолданылатын реакция: 1, A
Глюкоза + [Ag(ΝH3)2]+ → Ag + Тотығу өнімдері
Қолданылатын 1. Толленс 2. Бенедикт 3. Фелинг реактивтері, оларды қолдану глюкозаның а) тотықсыздандырғыштық
б) тотықтырғыштық қасиеттеріне негізделген:
428. Көмірсуларды атаңдар: Сахароза,  -D-глюпираноза,
-D-глюпираноза,  -D-фруктофураноза
-D-фруктофураноза

429. Көмірсуларды атаңдар: ЛАКТОЗА,  -D-ГАЛАКТОПИРАНОЗА,
-D-ГАЛАКТОПИРАНОЗА,  -D-ГЛЮПИРАНОЗА,
-D-ГЛЮПИРАНОЗА,

430. Глюкоза мен фруктоза өзара мына изомерлерге жатады: ФУНКЦИЯЛЫҚ ТОПТАРДЫҢ
431. Жануарлар организмі қанының және тіндерінің міндетті компоненті және жасушалық реакциялар үшін тікелей энергия көзі болатын моносахарид: D-глюкоза
432. Мына өзгерісті жатқызуға болатын реакция: Изомерлену

433. Төмендегі сызбада ..Амилоза.... көмірсудың фрагменті келтірілген, ондағы байланыстар: АМИЛОЗА  -1,4 ГЛИКОЗИДТІК БАЙЛАНЫС
-1,4 ГЛИКОЗИДТІК БАЙЛАНЫС

434. D-глюкоза және D-галактоза түзіп гидролизденетін дисахарид: Лактоза
435. Химиялық табиғатына қарай полисахаридтерді мына қосылыстар ретінде қарастыруға болады: Поли ацетальдар
436. D-глюкоза және L-глюкоза өзара: Энантиомерлер
437. Глюкоза тотықсызданғанды түзілетін зат: Алты атомды спирт: Сорбит түзіледі
438. D-дигитоксоза (жүрек гликозидтерінің белсенді бастамасы) құрылысы жағынан көмірсулардың мына класына жатады: 2,6 - Дидезоксимоносахаридтерге

439. Адамдар мен жануарлардың асқазан-ішек жолдарында іс жүзінде қорытылмайтын полисахарид: ХИТИН
440. Пиримидиннің формуласын көрсетіңдер: Е. 
441. Пурин тобының алкалоидтарына жататындар: Кофеин, теофиллин
Дата добавления: 2018-02-15; просмотров: 3426; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
