Заключительный (городской) этап. Теоретический тур.
Класс
1.а) Na2SO3 + 2HCl → 2NaCl + H2O + SO2↑;
2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + 2NH3↑;
б) 2Fe(OH)3 → Fe2O3 + 3H2O;
MgCO3 → MgO + CO2;
в) CaO + CO2 → CaCO3;
SO3 + H2O → H2SO4;
г) 2Al + Fe2O3 → Al2O3 + 2Fe;
CuO + H2 → Cu + H2O;
д) 2NH3 + H2SO4 → (NH4)2SO4;
NH3 + HClO4 → NH4ClO4.
Существует множество альтернативных примеров.
2.Объем каждого компонента V = V0·φ, где V0 – исходный объем смеси, φ – объемная доля данного компонента. Используя формулы ν = V/Vm, m = ν·M получим выражение для массы каждого компонента: m = V0·φ·M/Vm.
Тогда общая масса смеси μ = (40·0,1 + 71·0,4 + 44·0,5)·7,84/22,4 = 19,04 г, а плотность ρ = 19,04 / 7,84 = 2,43 г/л.
3.
| Оксид | Характер оксида | Соответствующий гидроксид |
| SrO | основный | Sr(OH)2 |
| CrO | основный | Cr(OH)2 |
| CrO3 | кислотный | H2CrO4 или H2Cr2O7 |
| N2O | несолеобразующий | – |
| N2O5 | кислотный | HNO3 |
1) SrO + 2HCl → SrCl2 + H2O;
2) CrO + SO3 → CrSO4;
3) CrO3 + 2NaOH → Na2CrO4 + H2O;

 4) N2O + H2SO4 →; N2O + NaOH →;
4) N2O + H2SO4 →; N2O + NaOH →;
5) N2O5 + Ca(OH)2 → Ca(NO3)2 + H2O.
4.1) X – кислород O, A – O2, B – озон O3.
2) 3O2 → 2O3
Пусть объем всего кислорода y л, а прореагировавшего – х л, тогда образуется 2х/3 л озона. Объем получившейся смеси y – x + 2x/3 = y – x/3. Т.е. объем в результате реакции уменьшается на x/3 л. По условию x/3 = 0,2, следовательно, х = 0,6 л.
3) 2C + 2O3 → 2CO2 + O2.
5.C + O2 → CO2
S + O2 → SO2
CO2 + 2KOH → K2CO3 + H2O
SO2 + 2KOH → K2SO3 + H2O
ν(CO2) = ν(C) = (15·3/5)/12=0,75 моль
ν(SO2) = ν(S) = (15·2/5)/32=0,1875 моль
m(KOH)р-р = (1,5 + 1,875)·56/0,005 = 2100 г
6. А – Cu, В – CuO, Г – CuSO4, Д – Cu(OH)2.
2Cu + O2 → 2CuO;
CuO + H2SO4 → CuSO4 + H2O;
|
|
|
CuSO4 + 2NaOH → Сu(OH)2 + Na2SO4;
Сu(OH)2 (t0)→ CuO + H2O;
CuO + H2 → Cu + H2O.
Класс
1. При приливании раствора нитрата серебра к смеси бромидов протекают реакции:
NaBr + AgNO3 = AgBr↓ + NaNO3; (1)
RbBr + AgNO3 = AgBr↓ + RbNO3. (2)
Так как изменилась масса железной пластинки, значит, в растворе остался в избытке нитрат серебра:
2AgNO3 + Fe = Fe(NO3)2 + 2Ag (3)
По разнице масс моля железа и двух молей серебра находим число молей вступившего в реакцию с железом нитрата серебра:
2 моль AgNO3 дают изменение массы пластинки на 160 г (216-56)
х моль « на 2 г
Откуда х = 2·2/160 = 0,025 моль AgNO3 (вступило в реакцию с железом).
Исходное число молей AgNO3: 0,393∙0,7 = 0,275.
Число молей AgNO3 на реакцию с бромидами: 0,275 – 0,025 = 0,25.
По уравнениям 1 и 2 находим число молей бромидов в исходной смеси:
ν(NaBr) = а моль, ν(RbBr) = b моль. Тогда:
 а + b = 0,25
а + b = 0,25
103а + 165b = 35,05
Решая эту систему уравнений, получим а = 0,10 моль, b = 0,15 моль.
Массовые доли:
ω(NaBr) = 0,1·103/35,05 = 0,294 или 29,4%
ω(RbBr) = 0,15·165/35,05 = 0,706 или 70,6%
2. Один из возможных вариантов решения:
1) Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO + 2P;
2) 2P + 3Br2 = 2PBr3;
3) PBr3 + 3H2O = H3PO3 + 3HBr;
4) 5H3PO3 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O;
5) MnSO4 + KOH = Mn(OH)2 + K2SO4;
6) K2SO4 + ВаS = ВаSО4 + K2S;
|
|
|
7) K2S + 4H2O2 = K2SO4 + 4H2O;
8) O2 + 4NO2 + 2H2O = 4HNO3.
3.При прокаливании солей протекают реакции:
Al(NO3)3 = Al2О3 + 6NO2↑ + 1,5O2↑ (1)
(NH4)2CO3 = 2NH3↑ + H2O + CO2↑ (2)
СaCO3 = CaO + CO2↑ (3)
Уравнения реакций газов:
NH3 + HCl = NH4Cl (4)
Сa(OH)2 + CO2 = СaCO3↓ + H2O (5)
По уравнению (4): ν(NH3) = 6,72/22,4 = 0,3 моль.
По уравнению (2): m((NH4)2CO3)в смеси = 96∙0,15 = 14,4 г.
По уравнению (5): при прокаливании смеси выделилось ν(CO2) = 45/100 = 0,45 моль.
Зная ν(NH3), по реакции (2): ν(CO2) = 0,15 моль.
Тогда по реакции (3): ν(CO2) = 0,45 – 0,15 = 0,3 моль. Это соответствует ν(СaCO3).
m(СaCO3)в смеси = 0,3·100 = 30 г .
m(Al(NO3)3)в смеси = 52,5 – 14,4 – 30 = 8,1 г.
ω(Al(NO3)3) = 8,1/52,5 = 0,1543 или 15,43%
ω(СaCO3) = 30/52,5 = 0,5714 или 57,14%
ω((NH4)2CO3) = 14,4/52,5 = 0,2743 или 27,43%
Одна из некорректностей связана с тем, что аммиак может реагировать с оксидом азота (IV) по уравнению: 4NH3 + 3NO2 = 3,5N2 + 6H2O, а это делает решение задачи неоднозначным.
4. Уравнения реакций:
а) CuSO4 + H2S = CuS↓ + H2SO4;
б) 4Br2 + H2S + 4H2O = H2SO4 + 8HBr.
Для случая а): электропроводность повышается благодаря тому, что образующаяся кислота имеет более высокую проводимость тока, чем прореагировавшая соль (подвижность ионов водорода выше, чем подвижность ионов меди).
|
|
|
Для случая б): возрастание электропроводности более значительное (образуется моль серной кислоты и 8 молей бромоводородной кислоты), поэтому можно определять более точно концентрации сероводорода. Однако получить высокую концентрацию поглотителя (бромной воды) нельзя, поэтому поглотительная емкость раствора невелика.
5. Растворение золота основано на реакции комплексообразования:
4Au + 8NaCN + O2 + 2H2O = 4Na[Au(CN)2] + 4NaOH. (1)
Остальные уравнения реакций:
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au; (2)
Zn + H2SO4 = ZnSO4 + H2 (3)
Масса избытка цинка: (12,6/22,4)∙65 = 36,6 г.
Масса прореагировавшего цинка: 60 – 36,6 = 23,4 г.
Масса золота, извлеченного из породы (см. уравнение 2): (23,4:65)∙2∙197 = 141,8 г.
Масса золота в породе: 141,8/0,93 = 152,5 г.
Массовая доля золота в породе: (152,5/107)∙100 = 0,001525 %.
6.С выделением газообразных продуктов с углекислым газом без нагревания способны реагировать только пероксиды и надпероксиды. При нагревании только натрий образует с кислородом пероксид, а остальные щелочные металлы (калий, рубидий и цезий) преимущественно – надпероксиды.
Уравнения реакций:
2Na + O2 = Na2O2
Э + O2 = ЭO2 (Э = K, Rb, Cs)
2Na2O2 + 2CO2 = 2Na2CO3 + O2
4ЭO2 + 2CO2 = 2Э2CO3 + 3O2
Следовательно, газ В – кислород, а исходный металл А – любой щелочной металл (кроме лития); из щелочно-земельных металлов – барий.
|
|
|
7. Масса галогена в навеске: 46,32· (1 – 0,3102) = 31,95 г.
Масса галогена после нагревания галогенида в атмосфере галогена: 31,95 + 10,65 = 42,6 г.
Из соотношения 31,95/42,6 = х/(х + 1), находим х = 3. Следовательно, галогениды имеют формулы: МеГ3 и МеГ4. Найдем молярную массу галогенида, обозначив молярную массу галогена А. В галогениде массой 46,32 г содержится 31,95 г галогена.
« М г « 3А г «
Мгалогенида = 46,32·3А/31,95 = 4,35А г/моль.
М(Ме) = 4,35А – 3А = 1,35А г/моль.
Методом подбора находим М(Ме):
если фтор, М(Ме) = 1,35·19 = 25,65 г/моль;
если хлор, М(Ме) = 1,35·35,5 = 47,92 г/моль;
если бром, М(Ме) = 1,35·80 = 108 г/моль;
если йод, М(Ме) = 1,35·127 = 171,45 г/моль.
Металлов с молярными массами 25,65 и 171,45 нет. Значит, искомыми металлами могут быть титан или серебро. Однако серебро не образует галогенидов типа AgBr3 и AgBr4. Титан – элемент 4 группы, может проявлять переменную степень окисления и образовывать галогениды TiCl3 и TiCl4. Значит МеГх – TiСl3, а МеГх+1 – TiСl4.
Хлорид титана (III) в основном используется как восстановитель. Его водные растворы легко окисляются на воздухе, поэтому их можно хранить только в инертной атмосфере.
Четыреххлористый титан является интенсивным дымообразователем, используемым в военном деле. Образование дыма происходит в результате гидратации и гидролиза TiCl4 водяными парами, находящимися в воздухе, и значительно интенсифицируется в присутствии аммиака:
TiCl4 + 2Н2О = TiО2 + 4HCl.
Четыреххлористый титан имеет большое значение и как сырье для производства металлического титана, находящего применение в качестве конструкционного материала, в частности в химической промышленности и ядерной технике:
TiCl4 + 2Mg = Ti + 2MgCl2.
Класс
1.Определим вещество Ж.
Пусть соединение содержит один атом калия, тогда справедлива пропорция:
39 – 36,69%
16х – 30,03%
Тогда х = 2
Определим третий элемент:
39 – 36,69%
Y – (100 – 36,69 – 30,03) = 33,28%
Y = 35,45 г/моль.
Элемент Х – хлор, газ А – Cl2. Его первое название - «галоген»
Соединение Ж– хлорит калия (KClO2)
Тогда соединение Б, названное в честь французского химика – бертолетова соль (KClO3).
Желтый газ Е – диоксид хлора, ClO2.
Реакции:
А ® Б 3Cl2 (А) + 6KOH = 5KCl + KClO3 (Б) + 3H2O
Б ® В 4KClO3 (Б) = 3KCl + KClO4 (В)
В ® Г KClO4 (В) = KCl (Г) + 2O2
Г ® А 10KCl (Г) + 8H2SO4 + 2KMnO4 = 5Cl2 (А) + 2MnSO4 + 6K2SO4 + 8H2O
Б ® Е 2KClO3 (Б) + H2C2O4 = 2ClO2 (Е) + 2KHCO3
В ® А KClO4 (В) + H2SO4 +7HCl = 4Cl2(А) + KHSO4 + 4H2O
Г ® Д KCl (Г) + H2SO4 = HCl(Д) + KHSO4
Ж ® А KClO2 (Ж) + 4HCl = 2Cl2 (А) + KCl + 2H2O
Е ® Ж 2ClO2 (Е) + 2KOH (PbO) = KClO3 + KClO2 (Ж) + H2O
Е ® А 2ClO2 (Е) = Cl2 (А) + 2O2
Д® А 14HCl(Д) + K2Cr2O7 = 3Cl2(А) + 2KCl + 2CrCl3 + 7H2O
Ж® Д 2KClO2 (Ж) + H2SO4 = 2HCl (Д) + K2SO4 + 2O2
2.Вероятно, в состав соединения входит только один атом хрома. На основании этих данных можно определить брутто-состав соединения. Пусть его формула CrClxHyOz.
X = 51,996*40/(19.5*35.453) = 3
Y = 51,996*4,5/(19,5*1,008) = 12
Z = 51,996*36/(19,5*15,999) = 6
Таким образом, брутто-формула соединения СrCl3(H2O)6
Такой состав могут иметь следующие координационные соединения:
[Cr(H2O)6]Cl3
[CrCl(H2O)5]Cl2*H2O
[CrCl2(H2O)4]Cl*2H2O
[CrCl3(H2O)3]*3H2O
При диссоциации 1 моль первого из них будет образовываться 4 моль ионов, а при диссоциации 1 моль второго вещества – 3 моль ионов, третьего – 2 моль ионов, последнее вещество электролитом не является.
По условию задачи для криоскопических определений использовали раствор с концентрацией 26.6/266.351 = 0.0997 моль/кг Н2О, а данные по измерению температуры замерзания соответствуют концентрации 0,194 моль/кг Н2О. Очевидно, концентрация частиц растворенного вещества в растворе в два раза больше, чем концентрация соли, что соответствует составу [CrCl2(H2O)4]Cl*2H2O
При нагревании до 150 оС происходит отщепление только кристаллизационной воды.
Формуле CrCl2(H2O)4+ соответствуют 2 изомера, содержащие хлорид-ионы в цис- и транс-положении, соответственно (координационный полиэдр иона хрома имеет форму октаэдра). Поскольку оба они имеют плоскость симметрии, они не обладают оптической активностью.
3.Определим газ Е.
М = 1,25*22,4 = 28 г/моль – по-видимому, этот газ азот, а речь идет о солях кислородсодержащих кислот азота.
2. Определим молярные массы анионов каждой из солей и их возможный состав:
А: 39*54,1/45,9 = 46 г/моль – NO2-. Соль – KNO2
Б: 39*61,4/38,6 = 62 г/моль – NO3-. Соль – KNO3
В: 39*43,5/56,5 = 30 г/моль. Так как кислоты HNO не существует, удвоим брутто-формулу – K2N2O2
Г: 39*49,4/50,6 = 38 г/моль – NO1.5-, соль K2N2O3
Д: 39*40/60 = 26 г/моль – K3NO4
Реакции:
HNO2 + NH3 = N2 + 2H2O
HNO3 + NH3 = NH4NO3, NH4NO3 ® N2O + 2H2O, N2O ® N2 + 1/2O2
(3HNO3 + 5NH3 = 4N2 + 9H2O)
3H2N2O2 + 2NH3 = 4N2 + 6H2O
3H2N2O3 + 4NH3 = 5N2 + 9H2O
3H3NO4 + 5NH3 = 4N2 + 12H2O
Структурные формулы
| HNO2 | HNO3 |

| 

|
| H2N2O2 | H2N2O3 |


| 
|
| H3NO4 | |

| |
4.Ионы жесткости – это ионы кальция и магния. Для их удаления применяют (а) кипячение; (б) добавление соды и гидроксида кальция; (3) ионный обмен; (4) электродиализ; (5) осмос.
Анализируемое равновесие:
M2+ + P3O105- = MP3O103-
Константа равновесия: [MP3O103-]/ ([M2+]*[ P3O105-]) = 106
По условию задачи равновесная концентрация ионов М составляет 4*10-4 моль/л, а равновесная концентрация комплекса (т.е. связанных ионов металла) – 4,6*10-3 моль/л
Тогда равновесная концентрация триполифосфат-анионов составит:
[ P3O105-] = 4,6*10-3/(4*10-4*106) = 1.15*10-5 моль/л
Количество триполифосфата натрия, которое следует добавить к 1 л воды, составит:
1,15*10-5 + 4,6*10-3 = 4, 6115*10-3 моль/л, а к 30 л жесткой воды следует добавить, соответственно, 0,138 моль реагента.
5.
метан-d1:
CH4 + Cl2 → CH3Cl + HCl (на свету)
CH3Cl + Mg → CH3MgCl
CH3MgCl + D2O → CH3D + Mg(OD)Cl
или
Na + D2O = NaOD + 1/2D2
СН3СООNa + NaOD → CH3D + Na2CO3 (сплавление)
метан-d4:
Al4C3 + 12D2O → 3CD4 + 4Al(OD)3
метан-d3:
CD4 + Cl2 → CD3Cl + DCl (на свету)
CD3Cl + Mg → CD3MgCl
CD3MgCl + H2O→CHD3 + Mg(OH)Cl
этан-d6:
2CD3Cl +2Na → C2D6 + 2NaCl
бензол-d6:
СаС2 + D2O → D-C≡C-D + Ca(OD)2
3D-C≡C-D → C6D6 (400 °C, активированный уголь)
или
D2O + SO3 = D2SO4
D2SO4(избыток) + С6Н6→ C6D6+Н2SO4
циклогексан-d12:
D2O → D2 + 1/2O2 (электролиз)
C6D6 + 3D2 → С6D12
Для установления изотопной чистоты может использоваться масс-спектрометрия, а также спектроскопия ядерного магнитного резонанса на протонах (1Н ЯМР).
6. 1) В протонных полярных растворителях фторид-ион плохой нуклеофил. По этой причине лучше использовать, например, ацетонитрил (для усиления нуклеофильных свойств). Но у фторида калия плохая растворимость в ацетонитриле, и чтобы фторид мог выступать в качестве нуклеофила, добавляют краун-эфир, образующий с ионами калия прочный комплекс.

2) Для введения фтора в боковую цепь ароматических соединений был разработан весьма универсальный способ с использованием бинарного вещества X.Выведем его формулу в виде АFx, тогда по условию 1 : x = ω(А)/М(А) : ω(F)/М(F) = (100 – 70,37)/М(А) : 70,37/19 = 1 : 0,125М(А). Т.е. 0,125М(А) = x или М(А) = 8x. Перебирая натуральные значения x, единственное рациональное решение получим при x = 4. М(А) = 32, X – SF4.

Большой недостаток такого подхода – высокая токсичность газообразного SF4. В альтернативном варианте используют гораздо более безопасный жидкий диэтиламинотрифторид (C2H5)2NSF3.
4) Фторирование 2,3-диметилпент-2-ена с помощью CoF3:

AlF3 вместо CoF3 использовать нельзя, т.к. Co(III), в отличие от Al(III), сильный окислитель.
Стадии роста цепи свободнорадикального фторирования настолько экзотермичны, что это приводит к быстрому росту общего количества свободных радикалов фтора вследствие очень малой энергии связи F-F. Накопление радикалов фтора происходит быстрее, чем их расходование, что неизбежно приводит к взрыву. Поэтому прямое фторирование невозможно. Эту трудность можно легко обойти, если использовать сильно разбавленные газовые смеси фтора и алкана в инертном газе и смешивать их постепенно.
7. Из массового содержания углерода найдём состав углеводородов Х, А-В.
Для А: n(C) : n(H) = 84.28/12.01 : 15.72/1.008 = 7.017: 15.595 = 1 : 2.222 = 9 : 20. Т.е. брутто-формула углеводорода А – С9Н20.
Для Х: n(C) : n(H) = 89.94/12.01 : 10.06/1.008 = 7.489 : 9.98 = 1 : 1.33 = 3 : 4. Учитывая, что углеводород А, продукт исчерпывающего гидрирования Х, содержит 9 атомов углерода, то брутто-формула углеводорода Х – С9Н12. Он содержит либо 4 двойные связи, либо 2 двойных и одну тройную связь, либо 2 тройных связи.
Для БиВ: n(C) : n(H) = 88.45/12.01 : 11.55/1.008 = 7.365: 11.458 = 1 : 1.556 = 9 : 14. Т.е. брутто-формула изомерных углеводородов БиВ– С9Н14. Это продукты присоединения 1 моля водорода к Х.
Двойные связи С=С с различным количеством заместителей не отличаются особой селективностью к гидрированию при гетерогенном катализе, поэтому, вероятно, 1 моль водорода присоединяется к тройной связи С≡С. В этом случае изомерные углеводороды БиВдолжны отличаются лишь конфигурацией образующейся связи С=С. Известно, что восстановление тройной связи в присутствии катализатора Линдлара (Pd/CaCO3 – Pb(OCOCH3)2) приводит к цис- (или Z-) алкену, а восстановление натрием в жидком аммиаке – к транс- (или Е-) алкену. Тогда искомые углеводороды содержат следующие фрагменты:

Поскольку углеводород Х после восстановления в Втеряет оптическую активность, то можно сделать вывод, что в Хуже присутствовал фрагмент, образующийся при восстановлении Х до В. Тогда искомые углеводороды должны содержать следующие фрагменты:

Остаётся дорисовать недостающую двойную связь:

Класс
1. 1. Очевидно, речь идет о диспропорционировании белого фосфора в щелочной среде:
P4 + 3NaOH + 3H2O = PH3 + 3NaH2PO2.
2. Судя по продуктам реакции, идет процесс гидролиза ковалентного галогенида:
PCl3 + 3H2O = H3PO3 + 3HCl.
3. Димеризация кислородсодержащих кислот может происходить либо при нагревании, либо при добавлении ангидрида кислоты:
2H3PO4 = H4P2O7 + H2O.
4. В полученной кислоте степень окисления фосфора +4, что для данного элемента нехарактерно. Тогда можно предположить, что в данной кислоте содержится фосфор +3 и фосфор +5:
PCl5 + H3PO3+ 3H2O = H4P2O6 + 5HCl.
5. Высокая степень окисления фосфора указывает на принадлежность соединения к пероксокислотам:
2H3PO4 + H2O2 = H4P2O8 + H2O.
Структурные формулы:
| Н3РО2 | Н3РО3 | Н4Р2О6 |

| 
| 
|
| Н4Р2О7 | Н4Р2О8 | |

| 
| |
2. Получение газа А путем восстановления водородом в момент выделения указывает на то, что это бинарное соединение с водородом. Молярная масса данного соединения составляет около 0,6*129,6 = 77,76 г/моль. Таким соединением могут быть арсин, AsH3, селеноводород, H2Se, герман, GeH4. Однако только в случае арсина на 0,04 моль арсина, получается 0,12 моль серебра.
AsH3 + 3AgNO3 = 3Ag + As + 3HNO3
2As + 3Zn + 6HCl = 2AsH3 + 3ZnCl2
AsH3 + 4H2O2 = H3AsO4 + 4H2O
H3AsO4 + 3AgNO3 = Ag3AsO4 + 3HNO3
3. 1. Определим металл А. Пусть на один атом цезия в соединении Е приходится один атом А. Тогда М(А) = 11,17*132,905/46,71 = 31,78 г/моль – такого металла нет. Пусть на один атом А приходится два атома цезия. Тогда М(А) = 63,564 г/моль, что соответствует меди.
2. Реакции:
А ® Б:2Сu (А) + O2 = 2CuO(Б)
А ® Г:2Сu (А) + O2 + 8NH3 + 2H2O = 2[Cu(NH3)4](OH)2 (Г)
Г ® В:[Cu(NH3)4](OH)2 (Г) + 5H2S = CuS(В) +4NH4HS + 2H2O
В ® Б:2СuS (В) + 3O2 = 2CuO (Б) + 2SO2
А ® Д:Сu (A) + CuBr2 = 2CuBr (Д)
Б ® З:СuO (Б) + 2HCl = CuCl2(З) + H2O
Ж ® В:2Сu (Ж) + O2 = 2CuO(В)
Г ® Е:2[Cu(NH3)4](OH)2 (Г)+ 6CsBr + SO2 = 2Cs2CuBr3 (Е) + 8NH3 + Cs2SO4 + H2O
Д ® Е:СuBr (Г)+ 2CsBr = Cs2CuBr3 (Е)
Е® Ж:2Cs2СuBr3 (Е) + 8HCl + H2O2 = 2Cs2CuCl4 (Ж) + 6HBr + 2H2O
З® Ж:СuСl2 (З) + 2CsCl = 2Cs2CuCl4 (Ж)
Д® З:2СuBr (Д) + 4HCl + H2O2 = 2CuCl2 (З) + 2HBr + 2H2O
3. Соединение Ж содержит дискретные октаэдрические анионы, а Е – полимеры из тетраэдров.
4. 2Cu(OH)2 + 2KOH + H2O2 = 2KCuO2 + 2H2O.
4. Найдём состав карбоновых кислот, образующихся при озонолизе.
n(NaOH) = 0.1*0.1492 = 0.01492 моль; n(NaOH) = n(RCOOH) + n(R’COOH)
Откуда находим среднюю молярную массу кислот: m(RCOOH)/[n(RCOOH) + n(R’COOH)] = 1/0.01492 = 67 г/моль. Считая, что при озонолизе кислоты образуются в соотношении 1:1, сумма молярных масс кислот равняется: 67*2 = 134 г/моль. На два радикала R и R’ приходится: 134 – 45*2 = 44 г/моль. Возможны два варианта:
1) CH3COOH и CH3CH2COOH (R = 15 г/моль, R’ = 29 г/моль);
2)HCOOH и CH3CH2CH2COOH.
Однако во втором случае образование муравьиной кислоты маловероятно из-за её дальнейшего окисления до CO2. Таким образом, кислоты, получающиеся при озонолизе – это уксусная и пропионовая. Эти кислоты могли быть получены при озонолизепент-2-ена или пент-2-ина.
Из массового содержания углерода найдём состав углеводородов А, Б и В:
n(C) : n(H) = 85.6/12.01 : 14.4/1.008 = 7.127: 14.286 = 1 : 2. Т.е. простейшая брутто-формула углеводородов А, Б и Всоответствует алкенам (СН2)n. Углеводород А – пент-2-ен.
Так как при озонолизе смеси А, Б и В, как и при озонолизеА, получается смесь уксусной и пропионовой кислот, то углеводороды Б и Вдолжны содержать те же фрагменты, что иА. Тогда Б – бут-2-ен, В – гекс-2-ен (или наоборот).

В задаче описывается первый пример реакции метатезиса (от греч. metathesis – «перестановка»), или, иначе говоря, диспропорционировая, алкенов (Calderon, N; Chen, H.Y.; Scott, K.W. (1967)."Olefin metathesis – A novel reaction for skeletal transformations of unsaturated hydrocarbons". Tetrahedron Letters 8 (34): 3327–3329). В настоящее время метатезис олефинов нашел широкое применение в лабораторной практике, а также в промышленном органическом синтезе.
Рассчитаем константу равновесия реакции.
2СН3СН=СНСН2СН3 → СН3СН=СНСН3 + СН3СН2СН=СНСН2СН3
Доли компонентов: 0.25 (бут-2ен), 0.25 (гекс-3-ен), 0.5 (пент-2-ен).
К = 0.25*0.25/0.52 = 0.25.
При обработке 3,3-диметилбут-1-енасмешанным катализатором WCl6/С2Н5АlCl2/C2H5OH образуются 2,2,5,5-тетраметилгекс-3-ен и этилен. За счёт выделения газообразного этилена из сферы реакции она не будет обратимой. 2,2,5,5-Тетраметилгекс-3-ен может быть получен с высоким выходом.

5. 1. Запишем уравнение реакции горения B в общем виде:
4CxHyOz + (4x + y – 2z)O2 = 4xCO2 + 2yH2O.
Исходя из условия, можно составить систему:
 (4x + y – 2z – 4)/(4x + 2y) = 100/114,3
(4x + y – 2z – 4)/(4x + 2y) = 100/114,3
2y/(4x + 2y) = 0,333, решая которую получим, что x = y и x = 16 – 8z.
Ограничивая последнее уравнение условием x > 0, получим единственное решение в натуральных числах: x = y = 8, z = 1. Т.о., B – C8H8O. Значит, на первой стадии в реакцию вступило эквивалентное количество окиси этилена, т.е.

Разница между молекулярными формулами A и B – два атома водорода. Следовательно, переход A → B – реакция каталитического дегидрирования, а первичные спирты дегидрируются в альдегиды:

Пусть n – число атомов кислорода в C, тогда M(C) = 100∙16n/24,74 = 64,67n. Т.е. ближайшее целое M будет при n = 3 (M(C) = 194 г/моль). Пусть CxHyO3 – общая формула C, тогда 12x + y + 16∙3 = 194. y = 146 – 12x. Единственно возможное по химическому смыслу решение уравнение имеет при x = 11, y = 14. Т.е. C – C11H14O3. А разница молекулярных формул между C(C11H14O3) и формальной суммой B и глицерина (C8H8O + C3H8O3 = C11H16O4) составляет H2O – молекулу воды. Известно, что спирты реагируют с альдегидами (обратимо) с образованием полуацеталей или ацеталей. Но т.к. глицерин – многоатомный спирт, а именно трехатомный, и реакция сопровождается отщеплением молекулы воды – образуется циклический ацеталь:

A – 2-фенилэтанол или β-фенилэтиловый спирт (запах роз), B – фенилацетальдегид или α-толуиловый альдегид (запах гиацинта), C – глицеринацеталь фенилацетальдегида (запах ландыша).
2. В качестве альтернативного промышленного способа получения B используют каталитическое окисление:
2C6H5CH2CH2OH + O2 ® 2C6H5CH2CHO + 2H2O.
3. Механизм реакции получения A из бензола – электрофильное ароматическое замещение:

6. 1. При бромировании двойной связи стирола образуется (1,2-дибромэтил)-бензол A:
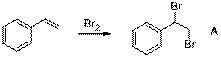
2. Далее происходит замещение брома и образуется 1-азидо-2-бромэтилбензол B. Возможны 2 варианта замещения брома: при первичном и вторичном атомах углерода. Наиболее выгодным будет замещение брома при вторичном атоме углерода, протекающее через бензильный карбкатион, обладающий повышенной стабильностью (по сравнению с первичным карбкатионом) за счет делокализации положительного заряда фенильным заместителем. Реакция протекает по механизму SN1:

3. При дегидрогалогенировании Bобразуется винилазид С.

4. При нагревании Собразуется вещество с брутто-формулой C8H7N. Определим X. По условию Х имеет три сигнала (иначе говоря, три типа) ароматических атомов водорода, из этого следует, что Х содержит монозамещённое бензольное кольцо. Дизамещённое бензольное кольцо содержало бы 2 или 4 типа атомов водорода. Тогда можно нарисовать 4 возможные структуры этого гетероциклического соединения.

Данные спектра ЯМР свидетельствуют, что в молекуле содержатся протоны двух типов: алифатические и ароматические. Таким образом, отпадают структуры 2, 3, 4, так как они содержат атомы водорода при двойной связи либо при атоме азота. Условию соответствует только структура 1. Таким образом, X – 3-фенил-2Н-азирин.
При нагревании вещества Сотщепляется азот, и образовавшийся нитрен присоединяется по двойной связи с замыканием цикла:

5. Рассчитаем массу полученного азирина:
Количество исходного соединения: ν = 26/104 = 0,25 моль.
Выход Xсоставляет η = 1*0,853*100 = 61,4%.
Таким образом, масса X: m = ν*0,614*117 = 17,96 г.
Источник: Alfred G. Hortmann, David A. Robertson, Baiba K. Gillard «A convenient procedure for the preparation of 2-Arylazirines»,J. Org. Chem., 37(2), 322–324 (1972).
7.
метан-d1:
CH4 + Cl2 → CH3Cl + HCl (на свету)
CH3Cl + Mg → CH3MgCl
CH3MgCl + D2O → CH3D + Mg(OD)Cl
или
Na + D2O = NaOD + 1/2D2
СН3СООNa + NaOD → CH3D + Na2CO3 (сплавление)
метан-d2:
2Li + D2 = 2LiD
4LiD + AlCl3 = LiAlD4 + 3LiCl
CH4 + 2Cl2 → CH2Cl2 + 2HCl (на свету)
2CH2Cl2 + LiAlD4 → 2CН2D2+ LiCl + AlCl3
метан-d4:
Al4C3 + 12D2O → 3CD4 + 4Al(OD)3
метан-d3:
CD4 + Cl2 → CD3Cl + DCl (на свету)
CD3Cl + Mg → CD3MgCl
CD3MgCl + H2O → CHD3 + Mg(OH)Cl
этан-d6:
2CD3Cl +2Na → C2D6 + 2NaCl
бензол-d1:
С6Н6 + Br2 → С6Н5Br + HBr (катализатор Fe или FeBr3)
С6Н5Br + Mg → С6Н5MgBr
С6Н5MgBr + D2O → С6Н5D + Mg(OD)Br
или
С6Н5COONa + NaOD → С6Н5D+ Na2CO3 (сплавление)
бензол-d6:
СаС2 + D2O → D-C≡C-D + Ca(OD)2
3D-C≡C-D → C6D6 (400 °C, активированный уголь)
или
D2O + SO3 → D2SO4
D2SO4(избыток) + С6Н6 → C6D6+Н2SO4
Для установления изотопной чистоты может использоваться масс-спектрометрия, а также спектроскопия ядерного магнитного резонанса на протонах (1Н ЯМР).
Дата добавления: 2018-02-18; просмотров: 471; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
