Заключительный (городской) этап. Теоретический тур. 1.Подумайте, для каких веществ характерны такие свойства
Класс
1.Подумайте, для каких веществ характерны такие свойства…
2. Если Вам трудно сразу определить среднюю молярную массу смеси (а это необходимо для расчета плотности газа), попробуйте решить «более жизненную» задачу: «У Вас имеется 2 яблока массой по 200 г и три груши массой по 150 г. Чему равна средняя масса фрукта?»
3. Подумайте, в каких случаях речь идет об оксидах неметаллов, в каких – об оксидах металлов… И как зависят свойства оксидов металлов от степени окисления металла.
6. Черный, розовый, голубой… Для соединений какого элемента характерны такие цвета?
Класс
1. Подумайте, на что указывает тот факт, что железная пластинка реагирует с фильтратом…
2. Обратите внимание, что в условии данной задачи нет слов «…Все указанные соединения содержат общий элемент».
4. Что является носителем электрического заряда в растворах электролитов? Как электропроводность зависит от концентрации этих частиц?
5. Золото – переходный металл (d-элемент), цианид-ион относится к псевдогалогенидам (в известной степени похож по свойствам на галогенид-ионы)… Возможно, это натолкнет Вас на нужные мысли…
7. Галогенид взаимодействует с галогеном… Вероятно, соответствующий металл имеет несколько устойчивых степеней окисления. Для каких металлов это характерно?
Класс
1. Наверное, не так много известно Вам соединений, названных в честь французских химиков…
|
|
|
2. На основании данных элементного анализа Вы легко определите брутто-формулу соединения. А воспользовавшись приведенной в задаче формулой – моляльность раствора. А далее подумайте, как свести одно с другим…
3. На основании данных о плотности легко определить газ Е. А дальше все становится совсем просто…
4. Обратите внимание, что комплексообразование в растворе – это равновесный процесс….
5. Вспомните способы синтеза незамещенных аналогов этих соединений из неорганических веществ – а затем замените в Ваших рассуждениях обычную воду на тяжелую…
6. Естественно, вещество Х должно быть достаточно устойчиво. И не проявлять слишком сильные окислительные свойства…
7. Аккуратный расчет позволит Вам с легкостью определить простейшую формулу углеводородов А и В, молекулярную формулу С. А дальше проверьте, о каком изомере С идет речь…
Класс
1.Здесь от Вас не ждут ничего, кроме разумной фантазии и… немного арифметики…
2. Подумайте, какие соединения получают с использованием вещества, получающегося при взаимодействии цинка с соляной кислотой…
3. Металлов древности не так уж и много (всего лишь 7). А поскольку его массовая доля в соединении, содержащем также цезий и, очевидно, бром известна, определить металл уже нетрудно.
|
|
|
4.Вспомните, как протекает процесс озонолиза.
5. Рассмотрите уравнение сгорания вещества А и изменение количества газовых молей в этой реакции…
6. Количество сигналов в спектре 1Н ЯМР указывает на число неравноценных атомов водорода. Далее же – обычная логика органического синтеза.
7. Вспомните способы синтеза незамещенных аналогов этих соединений из неорганических веществ – а затем замените в Ваших рассуждениях обычную воду на тяжелую…
Заключительный (городской) этап. Практический тур
Класс
Для начала проанализируйте, какие варианты наборов возможны, если все вещества, как следует из условия, растворимы в воде. А далеепроанализируйте признаки возможных реакций (изменение цвета, выделение газа, выпадение осадка)
Класс
Проанализируйте признаки возможных реакций (изменение цвета, выделение газа, выпадение осадка). Такой анализ удобно проводить в виде таблицы:
| K2Cr2O7 | Метил-оранж | I2 | FeCl3 | К4(Fe(CN)6) | |
| NaOH | Лимонно-желтый | Желтый | бесцветный | Бурый осадок | ------------ |
| HCl | ----------- | Красный | ----------- | ------------ | --------------- |
Как видите, растворы из второго набора можно и не использовать
|
|
|
Класс
Для выбора индикатора подумайте, какую реакцию среды будет иметь раствор в точке эквивалентности. Обратите внимание, что нейтрализация фосфорной кислоты происходит ступенчато…
Класс
Человеческий глаз вполне может заменить фотоколориметр при решении этой задачи…
Решения задач
Отборочный (районный) этап
Класс
1.Проверяемая тема: «Моль. Молярная масса. Число Авогадро», «Физические и химические свойства веществ»
1-1. Возможный вариант решения
М(х)= 2,7*23*6,02*1023/ 4,8*1023 =27,о9 (г/моль) => Al
Физические свойства: плотность, агрегатное состояние, пластичность.
Химические свойства: растворимость в кислоте, растворимость в воде.
1-2. Возможный вариант решения
М(х)= 1,8*2*2*3*6,02*1023/ 5,4*1023 =24,о8 (г/моль) => Мg
Физические свойства: плотность, агрегатное состояние, пластичность.
Химические свойства: растворимость в кислоте, растворимость в воде.
2. Темы: «Электронное строение атома», «Свойства элементов»
2-1. А – кислород, В – азот, С – бериллий.
| B2A5 | N2O5 | Оксид азота (V) | Оксид |
| CA | BeO | Оксид бериллия | Оксид |
| С2В2A6 | Be(NO3)2 | Нитрат бериллия | Соль |
2-2. А – углерод, В – литий, С – кислород.
| AC2 | СО2 | Оксид углерода (IV) | Оксид |
| B2C | Li2О | Оксид лития | Оксид |
| B2AC3 | Li2СО3 | Карбонат лития | Соль |
3. Темы: «Относительная плотность газа», «Средняя молярная масса газовой смеси»
|
|
|
3-1. D возд.(см.1) = (0,9*4+0,1*28) /29 = 0,221
D возд.(см.2) = (0,8*2+0,2*28 )/29 = 0,248
Плотность газовой смеси по воздуху обратно пропорциональна подъемной силе F↑ (средн. М (газ.см.) прямо пропорционально F↑). F↑ (см.1) > F↑ (см.2)
3-2. D возд.(см.1)= (0,95*4+0,05*28)/29 = 0,179
D возд.(см.2)= (0,72*2+0,28*28) /29 = 0,0767
Плотность газовой смеси по воздуху обратно пропорциональна подъемной силе F↑ (средн. М (газ.см.) прямо пропорционально F↑). F↑ (см.1) < F↑ (см.2)
4.Темы: «Моль. Молярная масса»
4-1. S=2*10-20*120*103*6,02*1023 / 144 =12,673684*106 м2
4-2. S=2*10-20*80*103*6,02*1023 / 170 =5,665882*106 м2
5.Тема: «Свойства химических веществ», «Расчеты по уравнениям химических реакций»
5-1. S + O2 → SO2
SO2 + 2NH3 + H2O → (NH4)2SO3
m((NH4)2SO3)= 3,2/32*116 = 11,6 г
5-2. 4P + 5O2 → 2P2O5
P2O5 + 6NH3 + 3H2O → 2(NH4)3PO4
m((NH4)3 PO4)= 3,1/31*149 = 14,9 г
Класс
1.Тема: «Свойствва химических веществ».
1-1. Один из вариантов решения задачи:
Br2 (бром), SО2 (оксид), HCl (кислота), AlCl3 (соль).
Br2 + H2O = НBr + НBrО;
SО2 + H2O = Н+ + НSО3-;
HCl = Н+ + Cl-;
Al3+ + H2O = AlОН2+ + Н+ .
1-2. Один из вариантов решения задачи:
Na (натрий), CaO (оксид), Ca(ОН)2 (гидроксид), К2СО3 (соль).
2Na + 2H2O = 2Na+ + 2ОН- + Н2 ;
CaO + H2O = Ca2+ + 2ОН- ;
Ca(ОН)2 = Ca2+ + 2ОН- ;
CO32- + H2O = HCO3- + 2ОН-.
2.Тема: «Закон Авогадро».
2-1. Так как колбы и условия одинаковы, то в них содержится одинаковое число молей газов. Разница масс колб равна разнице масс газов:
m аргона - m воздуха = n*40 - n* 20 = 2,8. Отсюда n = 0,14 (моль).
Значит количество молей газов в каждой колбе - 0,14 моль.
Сравнивая массы одинаковых количеств аргона и неизвестного газа, получаем: mAr – mx = 0,14 * 40 – 0,14 * M(x) = 1,68; M(x) = 28 (г/моль).
Этой молярной массе соответствуют газы: N2, СО, С2Н4 .
2-2. Так как колбы и условия одинаковы, то в них содержится одинаковое число молей газов. Разница масс колб равна разнице масс газов:
m воздуха – m Ne = n*29 - n* 20 = 1,08. Отсюда n = 0,12 (моль).
Значит количество молей газов в каждой колбе - 0,12 моль.
Сравнивая массы одинаковых количеств воздуха и неизвестного газа, получаем: mx – mвоздуха = 0,12 * M(x) – 0,12 * 29 = 1,8; M(x) = 44 (г/моль).
Этой молярной массе соответствуют газы: N2O, СО2, С3Н8 .
3.Тема: «Свойства химических веществ. Железо».
3-1. FeI2 à Fe(OH)2 à Fe(OH)3 à Fe2O3 à Fe à Fe2(SO4)3 .
1. FeI2 + 2KOH = Fe(OH)2¯ + 2KI
Fe2+ + 2ОН- = Fe(OH)2¯
2. 4Fe(OH)2 + 2H2O + О2 = 4Fe(OH)3
3. 2Fe(OH)3 = Fe2O3 + 3H2O
4. Fe2O3 + 2Al = 2Fe + Al2O3
5. 2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
2Fe + 12H+ + 3 SO42- = 2Fe3+ + 3SO2 + 6H2O
3-2. Fe(OH)3à Fe2(SO4)3 à FeSO4 àFeS àFeCl2 à FeCl3 .
1. 2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
2Fe(OH)3 + 6H+ = 2Fe3+ + 6H2O
2. Fe2(SO4)3 + Fe = 3FeSO4
2Fe3+ + Fe = 3Fe2+
3. FeSO4 + Na2S = FeS¯ + Na2SO4
Fe2+ + S2- = FeS¯
4. FeS + 2HCl = FeCl2 + H2S
FeS + 2H+ = Fe2+ + H2S
5. FeCl2 + Cl2 = 2FeCl3
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
4.Темы: «Свойства химических веществ», «Расчеты по уравнениям химических реакций», «Закон Авогадро».
4-1. С бромидом натрия реагирует только хлор:
2NaBr + Cl2 = 2NaCl + Br2
Объем хлора находим по массе выделившегося брома:
(0,48 : 160)* 22,4 = 0,0672 л или 67,2 мл.
Объемная доля хлора равна: 67,2 : 250 = 0,2688 или 26,88%.
Объемная доля гелия: 73,12%.
Значит в 1 л смеси содержится 0,2688 л хлора и 0,7312 л гелия.
Отсюда находим массу одного литра исходной смеси:
(0,2688: 22,4)* 71 + (0,7312:22,4)* 4= 0,852 + 0,1306= 0,983 (г).
4-2. С иодидом калия реагирует только хлор:
2КI + Cl2 = 2KCl + I2
Объем хлора находим по массе выделившегося иода:
(1,016: 254)* 22,4 = 0,0896 л или 89,6 мл.
Объемная доля хлора равна: 89,6: 150 = 0,597 или 59,7 %.
Объемная доля гелия: 40,3 %.
Значит в 1 л смеси содержится 0,597 л хлора и 0,403 л гелия.
Отсюда находим массу одного литра исходной смеси:
(0,597: 22,4)*71 + (0,403: 22,4)* 4 = 0,189 + 0,072 = 1,962 (г).
5.Темы: «Свойства химических веществ», «Расчеты по уравнениям химических реакций»,
5-1.CaCO3 + 2HNO3 = Ca(NO3)2+ H2O + СО2
100 г 44 г
100 г CaCO3 дадут привес стакана с раствором на 56 г (100-44)
25 г CaCO3 « « x г
этот привес равен: (25*56):100 = 14 г. Значит, чтобы весы остались в равновесии, такой же привес должен быть и во втором стакане.
2Al + 6HCl = AlCl3+ 3H2
54г 6 г
54 г Al дадут привес стакана с раствором на 48 г (54-6)
х г Al 14 г
Масса алюминия равна: (54*14): 48 = 15,75 (г)
5-2. 2NaHCO3 + H2SO4 = Na2SO4 + 2H2O + 2СО2
168 г 88 г
168 г NaHCO3 дадут привес стакана с раствором на 80 г (168-88)
6,3 г NaHCO3 « « х г
этот привес равен: (6,3*80):168 = 3 г. Значит, чтобы весы остались в равновесии, такой же привес должен быть и во втором стакане.
Fe + 2HCl = FeCl2 + H2
56г 2 г
56 г дадут привес стакана с раствором на 54 г (56-2)
х г « « 3 г
Масса железа равна: (56*3):54 = 3,11 (г)
Класс.
1.Тема: «Свойства неорганических веществ»
1-1. Возможно несколько вариантов правильных ответов. Ниже дан один из них.
1. Растворим все соли в воде. После этого для определения набора ((А) или (В)) можно во все пробирки добавить кислоту. Только в одном случае может наблюдаться выделение газа – в наборе В:
Na2CO3 + 2НCl = 2NaCl + CO2 + H2O
2. Если выдан набор А, во все пробирки можно добавить раствор нитрата серебра. В двух пробирках выпадет белый осадок, в одной – желтоватый. Так можно отличить пробирку, содержащую смесь ZnSO4 – NaBr:
NaBr + AgNO3 = AgBr + NaNO3
NaCl + AgNO3 = AgCl + NaNO3
NH4Cl + AgNO3 = AgCl + NH4NO3
3.Далее в две пробирки, содержимое которых еще нужно различить, добавить концентрированный раствор едкого натра. В пробирке, содержащей соль цинка, выпавший вначале осадок полностью растворится, а в пробирке, содержащей соль магния, гидроксид магния выпадет в осадок:
ZnSO4 + 4NaOH = Na2SO4 + Na2[Zn(OH)4]
MgSO4 + 2NaOH = Na2SO4 + Mg(OH)2
(NH4Cl + NaOH = NaCl + NH3 + H2O)
4. Если выдан набор В, пробирки, не содержащие карбонат натрия легко различить по результатам действия серной кислоты:
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3
1-2. Возможно несколько вариантов правильных ответов. Ниже дан один из них.
1. Растворим все соли в воде. После этого для определения набора ((А) или (В)) можно во все пробирки добавить кислоту. Только в одном случае может наблюдаться выделение газа – в наборе В:
К2CO3 + 2НCl = 2КCl + CO2 + H2O
2. Если выдан набор А, во все пробирки можно добавить раствор хлорида бария. Только в одном случае будет наблюдаться выпадение осадка. Так можно отличить пробирку, содержащую смесь ZnCl2 – (NH4)2SO4:
(NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
3.Далее в две пробирки, содержимое которых еще нужно различить, добавить концентрированный раствор едкого натра. В пробирке, содержащей соль алюминия, выпавший вначале осадок полностью растворится, а в пробирке, содержащей соль кальция, гидроксид кальция будет образовывать муть или осадок:
AlCl3 + 6NaOH = 3NaCl + Na3[Al(OH)6]
CaCl2 + 2NaOH = NaCl + Ca(OH)2
4. Если выдан набор В, пробирки, не содержащие карбонат калия, легко различить по результатам действия концентрированного раствора гидроксида натрия:
Al(NO3)3 + 6NaOH = 3NaNO3 + Na3[Al(OH)6]
MgCl2 + 2NaOH = 2NaCl + Mg(OH)2
2.Темы: «Химическое равновесие. Константа химического равновесия»
2-1.При нагревании будет протекать реакция разложения карбоната магния:
MgCO3 = MgO + CO2
Такая реакция будет протекать либо до установления равновесия (если карбонат магния к этому моменту разложится не полностью), константа которого описывается соотношением К = РCO2, либо до полного разложения соли. Определим количество соли и количество образовавшегося СО2:
Количество соли составляет 20/84 = 0,24 моль
Количество газа составляет n = pV/(RT) = 420*101300/760*10-4/(8,31*573,15) = 0,0012 моль
Следовательно, карбонат магния разложился далеко не полностью, система равновесная. Изменение количества соли не влияет на константу равновесия, следовательно, давление не изменится и по-прежнему будет составлять 420 мм рт. ст.
2-2.При нагревании будет протекать реакция разложения карбоната магния:
MgCO3 = MgO + CO2
Такая реакция будет протекать либо до установления равновесия (если карбонат магния к этому моменту разложится не полностью), константа которого описывается соотношением К = РCO2, либо до полного разложения соли. Определим количество соли и количество образовавшегося СО2:
Количество соли составляет 10/84 = 0,12 моль
Количество газа составляет n = pV/(RT) = 420*101300/760*10-4/(8,31*573,15) = 0,0012 моль
Следовательно, карбонат магния разложился далеко не полностью, система равновесная. Изменение объема ампулы не влияет на константу равновесия, следовательно, давление не изменится и по-прежнему будет составлять 420 мм рт. ст.
3.Темы: «Расчеты по уравнениям химических реакций», «Молярная концентрация»
3-1. Поскольку Юный Химик смог приготовить водный раствор этого вещества, искомым соединением мог быть только гидроксид щелочного или щелочноземельного металла.
Определим, в каких пределах лежит количество вещества гидроксида металла во взятой навеске. Объем кислоты, необходимый для нейтрализации раствора, лежит в пределах:
25 мл < V £ 30 мл. Соответственно, количество вещества кислоты составляет 2,5 ммоль < n £ 3,0 ммоль
Если был взят гидроксид щелочного металла, количество его гидроксида лежало в тех же пределах, а молярная масса составляла 100 > М ≥ 83 г/моль – таких щелочных металлов нет
Если был взят гидроксид щелочноземельного металла, количество его гидроксида было бы в 2 раза меньше (1,25 ммоль < n £ 1,50 ммоль), а молярная масса составляла 200 > М ≥ 166 г/моль – данному условию отвечает гидроксид бария (молярная масса 169 г/моль)
Определить металл можно и по окрашиванию пламени – барий окрашивает пламя в зеленый цвет
3-2. Поскольку Юный Химик смог приготовить водный раствор этого вещества, искомым соединением мог быть только гидроксид щелочного или щелочноземельного металла
Определим, в каких пределах лежит количество вещества гидроксида металла во взятой навеске. Объем кислоты, необходимый для нейтрализации раствора, лежит в пределах:
30 мл < V £ 33 мл. Соответственно, количество вещества кислоты составляет 3,0 ммоль < n £ 3,3 ммоль
Если был взят гидроксид щелочного металла, количество его гидроксида лежало в тех же пределах, а молярная масса составляла 66,67 > М ≥ 60,6 г/моль – таких щелочных металлов нет
Если был взят гидроксид щелочноземельного металла, количество его гидроксида было бы в 2 раза меньше (1,50 ммоль < n £ 1,65 ммоль), а молярная масса составляла 133,3 > М ≥ 121,2 г/моль – данному условию отвечает гидроксид стронция (молярная масса 121,6 г/моль)
Определить металл можно и по окрашиванию пламени – стронций окрашивает пламя в карминово-красный цвет
4.Темы: «Свойства неорганических веществ», «Расчеты по уравнениям химических реакций»
4-1. В описанных условиях будут протекать следующие реакции:
Cu + 2AgNO3 = 2Ag + Cu(NO3)2
Cu + 2Fe(NO3)3 = Cu(NO3)2 + 2Fe(NO3)2
Пусть в растворе содержалось по х моль солей. Тогда изменение массы пластинки составит:
-2*х/2*M(Cu) + x*M(Ag) = x*108 - x*63,5 = 0,5 г
Тогда x = 0,011 моль
По окончании реакции в растворе будет содержаться 0,011 моль нитрата меди, 0,011моль нитрата железа(II), 0,011 моль нитрата магния и вода.
Массы веществ составят:
Cu(NO3)2 – 0,011*187,5 = 2,0625 г
Fe(NO3)2 – 0,011*180 = 1,98 г
Mg(NO3)2 – 0,011*148 = 1,628 г
Н2О – 100*1,04 – 0,011*170 – 0,011*242 – 0,011*148 = 97,84 г
Общая масса раствора составляет 100*1,04 - 0,5 = 103,5 г
Массовые доли веществ по окончании реакции составляют
Cu(NO3)2 – 2,0625/103,5 = 2,00%
Fe(NO3)2 – 1,98/103,5 = 1,91%
Mg(NO3)2 – 1,628 /103,5 = 1,57%
Н2О – 94,52%
4-2. В описанных условиях будут протекать следующие реакции:
Sn + Hg(NO3)2 = Hg + Sn(NO3)2
Sn + 2Fe(NO3)3 = Sn(NO3)2 + 2Fe(NO3)2
Пусть в растворе содержалось по х моль солей. Тогда изменение массы пластинки составит:
-(x + x/2)*M(Sn) + x*M(Hg) = x*201 – 1,5*x*119 = 0,6 г
Тогда x = 0,027 моль
По окончании реакции в растворе будет содержаться 0,04 моль нитрата олова, 0,027 моль нитрата железа(II), 0,027 моль нитрата кальция и вода.
Массы веществ составят:
Sn(NO3)2 – 0,04*243 = 9,72 г
Fe(NO3)2 – 0,027*180 = 4,86 г
Ca(NO3)2 – 0,027*164 = 4,428 г
Н2О –100*1,06 – 0,027*325 – 0,027*242 – 0,011*164 = 86,263 г
Общая масса раствора составляет 100*1,06 - 0,6 = 105,4 г
Массовые доли веществ по окончании реакции составляют
Sn(NO3)2 – 9,72/105,4 = 9,22%
Fe(NO3)2 – 4,86/105,4 = 4,61%
Ca(NO3)2 – 4,428 /105,4 = 4,20%
Н2О – 81,84%
5.Темы: «Алканы», «Изомерия углеводородов»
5-1. По уравнению Менделеева-Клапейрона рассчитаем количество кислорода:
p*V = n*R*T, n= p*V/(R*T)
Учтём, что p = 101кПа, Т = 298 К, R = 8,31 Дж/(моль*К).
n (O2) = 101*27/(8,31*298) = 1.1 моль.
Запишем уравнение реакции горения алкана в общем виде:
СnH2n+2 + (1.5n + 0.5)O2 = nCO2 + (n+1)H2O
Составим пропорцию:
| 0.1 моль | 1.1 моль |
| 1 моль | (1.5n + 0.5) моль |
Получаем: 1.5n + 0.5 = 11 и n = 7, т.е. углеводород Х – С7Н16.
Гептан имеет 9 структурных изомеров:

Четыре из них могут образовать по три монохлорпроизводных, из них четвертичный атом углерода имеют 3,3-диметилпентан и 2,2,3-триметилбутан.
При свободнорадикальном галогенировании наиболее легко будет замещаться атом водорода при третичном атоме углерода, затем при вторичном и лишь затем при первичном. Тогда структуры монохлорпроизводных, образующихся в наибольшем количестве при хлорировании 3,3-диметилпентана и 2,2,3-триметилбутана на свету, выглядят так:

5-2. По уравнению Менделеева-Клапейрона рассчитаем количество кислорода:
p*V = n*R*T, n = p*V/(R*T)
Учтём, что p = 100кПа, Т = 303 К, R = 8,31 Дж/(моль*К).
n (O2) = 100*55,4/(8,31*303) = 2.2моль.
Запишем уравнение реакции горения алкана в общем виде:
СnH2n+2 + (1.5n + 0.5) O2 = n CO2 + (n+1) H2O
Составим пропорцию:
| 0.2 моль | 2.2 моль |
| 1 моль | (1.5n + 0.5) моль |
Получаем: 1.5n + 0.5 = 11 и n = 7, т.е. углеводород Х – С7Н16.
Гептан имеет 9 структурных изомеров:

Четыре из них могут образовать по три монохлорпроизводных, из них четвертичных атомов углерода не имеют 3-этилпентани 2,4-диметилпентан.
При свободнорадикальном галогенировании наиболее легко будет замещаться атом водорода при третичном атоме углерода, затем при вторичном и лишь затем при первичном. Тогда структуры монобромпроизводных, образующихся в наибольшем количествепри бромировании 3-этилпентана и 2,4-диметилпентанана свету, выглядят так:
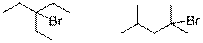
6.Проверяемые темы: «Свойства углеводородов».
6-1. При нагревании со спиртовым раствором щёлочи 4-метил-1-хлорпентан претерпевает отщепление хлороводорода, что приводит к алкенуА. Присоединение к нему НСl происходит по правилу Марковникова с образованием вещества В. Следующая стадия – вновь отщепление хлороводорода, происходящее по правилу Зайцева, т.е. с образованием наиболее замещённого алкена – 4-метилпент-2-ена С. В продуктах реакции будет преобладать транс-изомер 4-метилпент-2-ена. Это объясняется тем, что он образуется из более выгодной конформации, чем цис-изомер:

Следующие стадии – присоединение брома к алкену и элиминирование двух молекул бромоводорода, что приводит к алкинуЕ.
6-2. При нагревании со спиртовым раствором щёлочи 1-бром-5-метилгексан претерпевает отщепление бромоводорода, что приводит к алкенуА. Присоединение к нему НBrпроисходит по правилу Марковникова с образованием вещества В. Следующая стадия – вновь отщепление бромоводорода, происходящее по правилу Зайцева, т.е. с образованием наиболее замещённого алкена – 5-метилгекс-2-ена С. В продуктах реакции будет преобладать транс-изомер 5-метилгекс-2-ена. Это объясняется тем, что он образуется из более выгоднойконформации, чем цис-изомер:

Следующие стадии – присоединение брома к алкену и элиминирование двух молекул бромоводорода, что приводит к алкинуЕ.
7-1.Уравнение реакции:
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O
Определим количество перманганата калия, пошедший на титрование:
n(KMnO4) = C*V = 0.061*(8.05 + 8.10 + 8.10)/3 = 0.493 ммоль
Следовательно, во взятой аликвоте содержалось 0.493*5/2 = 1.233 ммоль перекиси водорода. Поскольку масса проанализированного раствора составляла 1.02 г, массовая доля перекиси водорода – 1.233*34/(1.02*10) = 4.11%.
Для повышения точности анализа следует увеличить объем анализируемого раствора (аликвоты), а для ускорения реакции – подогреть раствор.
7-2.Уравнение реакции:
2KMnO4 + 5(NH4)2C2O4 + 8H2SO4 =
= 2MnSO4 + 10CO2 + K2SO4 + 5(NH4)2SO4 + 8H2O
Определим количество перманганата калия, пошедший на титрование:
n(KMnO4) = C*V = 0.0101*(8.25 + 8.30 + 8.25)/3 = 0.0083 ммоль. Следовательно, во взятой аликвоте содержалось 0.0083*5/2 = 0.209 ммоль оксалата аммония. Поскольку масса проанализированного раствора составляла 1.10 г, массовая доля оксалата аммония – 0.209*34/(1.10*10) = 2.59%.
Для повышения точности анализа следует увеличить объем анализируемого раствора (аликвоты), а для ускорения реакции – подогреть раствор.
Класс.
1.Темы: «Свойства химических соединений», «Качественные реакции ионов»
1-1.Оптимальный реагент – азотная кислота:
BaSO4 + HNO3 – реакция не идет, остается осадок
BaCO3 + 2HNO3 = Ba(NO3)2 + CO2 + H2O – выделяется газ, соль растворяется полностью
CuSO4 – образуются гидратированные ионы меди, бесцветная соль образует голубой раствор
BaSO3 + 2HNO3 = Ba(NO3)2 + SO2 + H2O
И BaSO3 + 2HNO3 = BaSO4 + 2NO2 + H2O
Образуется газ, соль полностью не растворяется
1-2. Оптимальный реагент – разбавленная азотная кислота:
Сера – не смачивается водой, всплывает на поверхность
Параллельно идет реакция:
S + 2HNO3 = H2SO4 + 2NO
2K2CrO4 + 2HNO3 = K2Cr2O7 + 2KNO3 (желтый порошок образует оранжевый раствор)
3PbI2 + 8HNO3 = 3Pb(NO3)2 + 3I2 + 4H2O + 2NO – осадок растворяется, раствор приобретает бурую окраску
AgI – из-за малой растворимости видимых изменений не наблюдается
2.Темы: «Амфотерность». «Расчеты по уравнениям химических реакций»
2-1. 1. Определим газ. Мольный объем газа при указанных условиях составляет
V2 = V1*T2/T1 = 22,4*473,15/273,15 = 38,8 л
Молярная масса этого газа составит М = r*Vm = 1,83*38,8 = 71 г/моль. Следовательно, искомый газ – хлор
2. В реакцию вступило 1,35/9 = 0,15 моль бериллия и 2/38,8 = 0,05 моль хлора. Следовательно, после окончания реакции образовалось 0,05 моль хлорида бериллия и осталось 0,10 моль бериллия.
3. При обработке этой cмеси раствором едкого натра пойдут следующие реакции:
BeCl2 + 4КOH = 2КCl + К2[Be(OH)4]
Be + 2КOH + 2H2O = К2[Be(OH)4] + H2
В первую реакцию вступит 0,05*4 = 0,20 моль гидроксида калия, во вторую – 2*0,10 = 0,20 моль гидроксида калия. Всего прореагирует 0,40 моль гидроксида калия.
4. Масса вступившего в реакцию гидроксида калия составит 0,40*56 = 22,4 г. Масса раствора гидроксида калия – 22.4/0.20 = 112 г. Объем раствора – 112/1.18 = 95 мл
2-2. 1. Определим газ. Мольный объем газа при указанных условиях составляет
V2 = V1*T2/T1 = 22,4*473,15/273,15 = 38,8 л
Молярная масса этого газа составит М = r*Vm = 6,55*38,8 = 254 г/моль. Следовательно, искомый газ – иод
2. В реакцию вступило 2/65 = 0,03 моль цинка и 2/38,8 = 0,05 моль иода. Следовательно, после окончания реакции образовалось 0,03 моль иодида цинка и осталось 0,02 моль иода
3. При обработке этой cмеси раствором едкого натра пойдут следующие реакции:
ZnI2 + 4NaOH = 2NaI + Na2[Zn(OH)4]
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O
В первую реакцию вступит 0,03*4 = 0,12 моль гидроксида натрия, во вторую – 2*0,02 = 0,04 моль гидроксида натрия. Всего прореагирует 0,16 моль гидроксида натрия.
4. Масса вступившего в реакцию гидроксида натрия составит 0,16*40 = 6,4 г. Масса раствора гидроксида натрия – 6,4/0.20 = 32 г. Объем раствора – 32/1.12 = 28,6 мл
3.Тема: «Механизмы органических реакций»
3-1. 1 – В, 2 – Д, 3 – Б, 4 – А, 5 – Г
3-2. 1 – Д, 2 – В, 3 – А, 4 – Г, 5 – Б
4.Темы: «Электролиз солей карбоновых кислот», «Тепловые эффекты химических реакций»
4-1.Вначале смесь сложных эфиров подвергли омылению водным раствором карбоната натрия (соды), при этом получили водно-этанольный раствор ацетата натрия (из этилацетата) и валерата натрия (из этилпентаноата):
2RCOOC2H5 + Na2CO3 + H2O = 2RCOONa + CO2 + 2C2H5OH,
R = CH3 (метил радикал, входит в состав ацетатов и уксусной кислоты),
R = C4H9 (н-бутил радикал, входит в состав валериановой, иначе пентановой кислоты и валератов).
Электролиз водного или водно-спиртового раствора алканоата натрия идет по схеме (синтез или реакция Кольбе):
2RCOONa + 2H2O = 2CO2 + R–R + H2 + 2NaOH.
На катоде выделяется молекулярный водород и щелочь, а на аноде выделяется углекислый газ и алкан R–R (жидкий или газообразный).
В случае смеси алканоатов (R1COO– + R2COO–) возможна «перекрестная» реакция Кольбе с получением смеси продуктов: R1–R1, R1–R2, R2–R2. Следовательно, можно ожидать образование трех алканов: этана (продукт электролиза ацетата натрия), н-пентана (продукт «перекрестной» реакции) и н-октана (продукт электролиза валерата натрия). Жидкими при комнатных условиях будут только два алкана: н-пентан и н-октан.
Газ А – это смесь CO2, C2H6 и, возможно, O2 (продукт электролиза воды).
Жидкость Б – это смесь н-пентана и н-октана.
Определим количественный состав жидкой смеси. Пусть x – молярная доля пентана в смеси, тогда средняя молярная масса смеси равна M = 72*x + 114*(1 – x). При сжигании m граммов такой смеси выделится углекислого газа (m/M)*(5*x + 8*(1 – x))*44 граммов. Получаем уравнение:
0,138*44*(8 – 3*x)/(114 – 42*x) = 0,424 => x = 0,588; M = 89,3 г/моль.
Найдем теплоты сгорания пентана и октана:
C5H12 + 8O2 = 5CO2 + 6H2O, Qcomb(C5H12) = 5*Qобр(CO2) + 6*Qобр(H2O) – Qобр(C5H12) = 5*94,2+6*57,8-(10,5+6,14*5) = 776,6 ккал/моль пентана;
C8H18 + 12,5O2 = 8CO2 + 9H2O, Qcomb(C8H18) = 8*Qобр(CO2) + 9*Qобр(H2O) – Qобр(C8H18) = 8*94,2+9*57,8-(10,5+6,14*8) = 1214,2 ккал/моль октана.
Теплота сгорания 1 г Б будет равна Qcomb(Б) = (1/M)*(x*Qcomb(C5H12) + (1 – x)*Qcomb(C8H18)) =
= (1/89,3)*(0,588*776,6 + (1 – 0,588)*1214,2) = 10,7 ккал.
4-2. Вначале смесь сложных эфиров подвергли омылению водным раствором карбоната калия (потáша), при этом получили водно-этанольный раствор формиата калия (из этилформиата) и гаксаноата калия (из этилгексаноата):
2RCOOC2H5 + K2CO3 + H2O = 2RCOOK + CO2 + 2C2H5OH,
R = H (атом водорода, радикал муравьиной кислоты и формиатов),
R = C5H11 (н-пентил радикал, входит в состав капроновой, иначе гексановой кислоты и гексаноатов).
Электролиз водного или водно-спиртового раствора алканоата калия идет по схеме (синтез или реакция Кольбе):
2RCOOK + 2H2O = 2CO2 + R–R + H2 + 2KOH.
На катоде выделяется молекулярный водород и щелочь, а на аноде выделяется углекислый газ и алкан R–R (жидкий или газообразный). В случае формиата на аноде вместо алкана выделяется H2 («нулевой» член гомологического ряда алканов). В случае смеси алканоатов (R1COO– + R2COO–) возможна «перекрестная» реакция Кольбе с получением смеси продуктов: R1–R1, R1–R2, R2–R2. Следовательно, можно ожидать образование водорода (продукт электролиза формиата калия) и двух алканов: н-пентана (продукт «перекрестной» реакции) и н-декана (продукт электролиза гексаноата калия). Оба этих алкана будут жидкими при комнатных условиях.
Газ X – это смесь CO2, H2 и, возможно, O2 (продукт электролиза воды).
Жидкость Y – это смесь н-пентана и н-декана.
Определим количественный состав жидкой смеси. Пусть x – молярная доля пентана в смеси, тогда средняя молярная масса смеси равна M = 72*x + 142*(1 – x). При сжигании m граммов такой смеси выделится углекислого газа (m/M)*(5*x + 10*(1 – x))*44 граммов. Получаем уравнение:
0,157*44*(10 – 5*x)/(142 – 70*x) = 0,485 => x = 0,356; M = 117,1 г/моль.
Найдем теплоты сгорания пентана и декана:
C5H12 + 8O2 = 5CO2 + 6H2O, Qcomb(C5H12) = 5*Qобр(CO2) + 6*Qобр(H2O) – Qобр(C5H12) = 5*94,2+6*57,8-(10,5+6,14*5) = 776,6 ккал/моль пентана;
C10H22 + 15,5O2 = 10CO2 + 11H2O, Qcomb(C10H22) = 10*Qобр(CO2) + 11*Qобр(H2O) – Qобр(C10H22) = 10*94,2+11*57,8-(10,5+6,14*10) = 1505,9 ккал/моль декана.
Теплота сгорания 3 г Y будет равна Qcomb(Y) = (3/M)*(x*Qcomb(C5H12) + (1 – x)*Qcomb(C10H22)) =
= (3/117,1)*(0,356*776,6 + (1 – 0,356)*1505,9) = 31,9 ккал.
5.Темы: «Альдегиды», «Особые свойства муравьиной кислоты».
5-1. Последовательность происходящих химических процессов:
RCHO + 2[Ag(NH3)2]OH → RCOONH4 + H2O + 2Ag↓ + 3NH3
Ag + 2HNO3 → AgNO3 + NO2 + H2O
AgNO3 + NaCl → NaNO3 + AgCl↓
Стехиометрическая схема: RCHO → 2AgCl.
Тогда 0,11/(M + 29,02) = 2,148/(2∙143,32), где M – молярная масса R. Решая уравнение, получим M = – 14,34 < 0 – не удовлетворяет химическому смыслу. Единственный рациональный вариант, объясняющий такое несоответствие – кислота, находящаяся в растворе, тоже реагирует с [Ag(NH3)2]OH – т.е. муравьиная HCOOH.
По данным титрования можно вычислить ее содержание в растворе:
HCOOH + NaOH → HCOONa + H2O
с(HCOOH)∙5 = 0,05∙10; с(HCOOH) = 0,1 М; m(HCOOH) = 0,1∙0,05∙46,03 = 0,230 г.
HCOOH + 2[Ag(NH3)2]OH → CO2 + 2H2O + 2Ag↓ + 4NH3
Тогда 0,11/(M + 29,02) + 0,1∙0,05 = 2,148/(2∙143,32). Решая уравнение, получим M = 15,09, т.е. R = CH3, а исходный альдегид – уксусный CH3CHO.
Ответ: CH3CHO, 0,230 г HCOOH.
5-2. Последовательность происходящих химических процессов:
RCHO + 2[Ag(NH3)2]OH → RCOONH4 + H2O + 2Ag↓ + 3NH3 (1)
Ag + 2HNO3 → AgNO3 + NO2 + H2O (2)
AgNO3 + NaCl → NaNO3 + AgCl↓ (3)
Стехиометрическая схема: RCHO → 2AgCl.
Тогда 0,174/(M + 29,02) = 2,002/(2∙143,32), где M – молярная масса R. Решая уравнение, получим M = – 4,11 < 0 – не удовлетворяет химическому смыслу. Единственный рациональный вариант, объясняющий такое несоответствие – кислота, находящаяся в растворе, тоже реагирует с [Ag(NH3)2]OH – т.е. муравьиная HCOOH.
По данным титрования можно вычислить ее содержание в растворе:
HCOOH + NaOH → HCOONa + H2O (4)
с(HCOOH)∙5 = 0,05∙5,7; с(HCOOH) = 0,057 М; m(HCOOH) = 0,057∙0,07∙46,03 = 0,184 г.
HCOOH + 2[Ag(NH3)2]OH → CO2 + 2H2O + 2Ag↓ + 4NH3
Тогда 0,174/(M + 29,02) + 0,057∙0,07 = 2,002/(2∙143,32). Решая уравнение, получим M = 29,09, т.е. R = C2H5, а исходный альдегид – пропионовый C2H5CHO.
Ответ: C2H5CHO, 0,184 г HCOOH.
6.Тема: «Фенол».
6-1.Химические свойства вещества А говорят о его принадлежности к классу фенолов.
Для определения структуры А воспользуемся данными о его бромировании.
Рассмотрим три варианта:
1) вещество Всодержит 1 атом брома, тогдаM(В) = 80/0,695 = 115 г/моль, на остаток помимо брома приходится 115 – 80 = 35 г/моль, что не имеет решений для фенолов;
2) вещество Всодержит 2 атома брома, тогда M(В) = 60/0,695 = 230 г/моль, на остаток помимо брома приходится 230 – 160 = 70 г/моль, что не имеет решений для фенолов;
3) вещество Всодержит 3 атома брома, тогда M(В) = 240/0,695 = 345 г/моль, на остаток помимо брома приходится 345 – 240 = 105 г/моль – решение имеется. Молекулярный вес 2,4,6-трибромфенола равняется 331 г/моль, что отличается от вещества В на 14 г/моль, т.е. на группу СН2. Вещество А – один из изомеров метилфенола, а именно 3-метилфенол (мета-крезол), поскольку только он может образовать трибромпроизводное.

Уравнения реакций:

6-2. Химические свойства вещества А говорят о его принадлежности к классу фенолов.
Для определения структуры А воспользуемся данными о его бромировании.
Рассмотрим три варианта:
1) вещество Всодержит 1 атом брома, тогда M(В) = 80/0,668 = 119,7 г/моль, на остаток помимо брома приходится 119,7 – 80 = 39,7 г/моль, что не имеет решений для фенолов;
2) вещество Всодержит 2 атома брома, тогда M(В) = 160/0,668 = 239,5 г/моль, на остаток помимо брома приходится 239,5 – 160 = 79,5 г/моль, что не имеет решений для фенолов;
3) вещество Всодержит 3 атома брома, тогда M(В) = 240/0,668 = 359,3 г/моль, на остаток помимо брома приходится 359,3 – 240 = 109,3 г/моль – решение имеется. Молекулярный вес 2,4,6-трибромфенола равняется 331 г/моль, что отличается от вещества В на 28 г/моль, т.е. на группу С2Н4 или на две группы СН2.
Вариант 1. Вещество А – один из изомеров этилфенола, а именно 3-этилфенол, поскольку только он может образовать трибромпроизводное.

Вариант 2.Вещество А – один из изомеров диметилфенола, а именно 3,5-диметилфенол, поскольку только он может образовать трибромпроизводное.

Любое из этих двух решений является правильным.
Уравнения реакций (для 3-этилфенола):

7-1. Выпадение при добавлении аммиачного раствора оксида серебра серого осадка, постепенно образующего блестящий слой, указывает на то, что в пробирке № 5 находился ацетальдегид:
CH3CHO + 2[Ag(NH3)2]OH = CH3COONH4 + 2Ag + 3NH3 + H2O
Расслаивание будет наблюдаться в случае несмешивающегося с водой углеводорода – гексана – который легче воды и образует верхний слой. Следовательно, в пробирке № 1 – н-гексан
Взаимодействие с гидроксидом меди – качественная реакция на многоатомные спирты, к которым среди перечисленных реактивов относится глицерин:
2CH2OH-CHOH-CH2OH + Cu(OH)2 = Cu(C3H5O3)2 + 2H2O
Следовательно, в пробирке № 3 – глицерин
Окрашивание раствора при добавлении трихлорида железа – качественная реакция на фенолы. В пробирке № 4 – п-метилфенол:
FeCl3 + 6C7H7OH = H3[Fe(C7H7O)6] + 3HCl
Таким образом, содержимое пробирок:
№ 1 – н-гексан, № 2 – н-пропанол, № 3 – водный раствор глицерина, № 4 – водный раствор п-метилфенола, № 5 – водный раствор ацетальдегида.
7-2. Выпадение при добавлении аммиачного раствора оксида серебра серого осадка, постепенно образующего блестящий слой, указывает на то, что в пробирке № 4 находится формальдегид:
HCHO + 4[Ag(NH3)2]OH = (NH4)2CO3 + 4Ag + 6NH3 + 2Н2О
Расслаивание будет наблюдаться в случае несмешивающегося с водой углеводорода – гептана – который легче воды и образует верхний слой. Следовательно, в пробирке № 2 – н-гептан
Взаимодействие с гидроксидом меди – качественная реакция на многоатомные спирты, к которым среди перечисленных реактивов относится этиленгликоль:
2CH2OH -CH2OH + Cu(OH)2 = Cu(C2H4O2)2 + 2H2O
Следовательно, в пробирке № 5 – этиленгликоль
Окрашивание раствора при добавлении трихлорида железа – качественная реакция на фенолы. В пробирке № 3 – о-метилфенол:
FeCl3 + 6C7H7OH = H3[Fe(C7H7O)6] + 3HCl
Таким образом, содержимое пробирок:
№ 1 –изопропанол, № 2 – н-гептан, № 3 – водный раствор о-метилфенола, № 4 – водный раствор формальдегида, № 5 – водный раствор этиленгликоля.
Дата добавления: 2018-02-18; просмотров: 539; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
