Гомогенный и гетерогенный катализ
а) 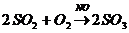 ,
,  б)
б)  ,
,
Ферментативный катализ:
Ускорение процесса под воздействием микроорганизмов -ферментов (энзимов). Биокатализ  . Активность, специфичность, избирательность.
. Активность, специфичность, избирательность.
Применение в промышленности (70%) (синтез аммиака, получение 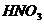 ,
,  , крекинг нефти, реакции гидрирования и окисления, пр.)
, крекинг нефти, реакции гидрирования и окисления, пр.)
Общие закономерности каталитических реакций.
1. Нерасходование и неизменность химической природы катализатора
2. Количество введенного катализатора
а) Гомогенные реакции – пропорциональность количеству.
б) Гетерогенные реакции – пропорциональность поверхности.
3. Катализатор не смещает химического равновесия
а) В равной мере ускоряется как прямая, так и обратная реакции, т.е. состояние равновесия достигается быстрее  .
.
б) Зависимости  и
и 
4. Селективность ( избирательность) действия катализатора
способность ускорять один из термодинамически возможных путей реакции. Мерой селективности служит доля реагента, превратившегося в целевой продукт (интегральная селективность) или отношение скорости образования целевого продукта к суммарной скорости превращения реагента по всем возможным направлениям.




5. Специфичность катализа -
состоит в том, что реакции данного типа ускоряются катализаторами только определенного химического состава (независимо от того являются они гомогенными или гетерогенными)
|
|
|
6. Образование лабильных промежуточных соединений
Катализ направляет реакцию по другому пути с иным числом и природой промежуточных стадий, иным составом и строением активированного комплекса.
а) Гомогенный катализ – промежуточные вещества стехиометрического состава.
б) Гетерогенный катализ – поверхностные соединения нестехиометрического состава.
Снижение величины энергии активации
– основная причина изменения скорости химической реакции.
а) Схема реакции
некаталитической: 
каталитической: 
б) Профиль пути реакции: 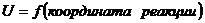
1) 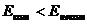
2)  , т.е.
, т.е. 
в)  , при
, при 
Промотирование и отравление катализаторов
Некоторые вещества, сами по себе не проявляющие каталитических свойств, при добавлении к катализатору способны усиливать или ослаблять его каталит. действие. Первые получили название промоторов, вторые – ядов (ингибиторов). Для твердых катализаторов сильнейшими ядами являются соединения 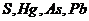 .
.
Основные механизмы взаимодействия реагентов с катализатором.
1. Стадии каталитической реакции
а) Многообразие стадий каталитического процесса.
б) Обязательные 2 стадии
1) взаимодействие активного центра катализатора с молекулой реагента с образованием промежуточного соединения катализатора с исходными веществами. Под активным центром катализатора понимают определенную группу атомов на поверхности катализатора, принимающую непосредственное участие в формировании химической связи (ковалентной, донорно-акцепторной или иной) с молекулами реагента.
|
|
|
2) распад промежуточного соединения с образованием продуктов реакции и высвобождением активного центра.
2. Механизмы каталитической реакции.
Все возможные механизмы можно свести к 2-ум схемам.
а) Слитный механизм – обратимое образование активированного комплекса, включающего и активный центр катализатора  и молекулы всех реагентов. Механизм процесса можно представить совокупностью стадий:
и молекулы всех реагентов. Механизм процесса можно представить совокупностью стадий:

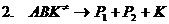
б) Раздельный (поэтапный) механизм – катализатор является как бы переносчиком атомов, атомных групп или электронов от молекулы одного реагента к молекуле другого:


в) Рассмотренные механизмы реализуются преимущественно в разных температурных областях. Реакции с поэтапным взаимодействием осуществляются преимущественно при повышенных температурах, По слитному механизму – при относительно невысоких температурах  .
.
|
|
|
Каталитическая активность
Мерой каталитической активностиявляется изменение скорости химической реакции в результате введения в систему катализатора
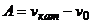 , где
, где  скорость реакции в присутствие и отсутствие катализатора, соответственно. Второй член
скорость реакции в присутствие и отсутствие катализатора, соответственно. Второй член  , обычно, существенно меньше
, обычно, существенно меньше  и им можно пренебречь, т.е.
и им можно пренебречь, т.е.  .
.
2. Удельной каталитической активностью называют каталитическую активность, отнесенную к единице количества катализатора
В гомогенном катализе : 
В гетерогенном катализе: 
3. Число оборотов катализатора. Любая каталитическая реакция включает по крайней мере 2 стадии:
1) взаимодействие активного центра катализатора с молекулой реагента и образование промежуточного соединения,
2) распад промежуточного соединения с образованием продуктов реакции и «свободного активного центра», который вновь вступает во взаимодействие с молекулами исходных веществ. Такие циклы могут повторяться многократно. Число циклов, образования-распада промежуточного соединения катализатора с молекулами исходных реагентов, происходящих на одном активном центре в единицу времени, и называют числом оборотов катализатора. Для гомогенных катализаторов число оборотов численно совпадает с их удельной каталитической активностью.
|
|
|
Дата добавления: 2018-02-18; просмотров: 658; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
