Кинетика диффузии при стационарном состоянии диффузионного потока.
КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ
Гетерогенными называют процессы, протекающие на границе раздела фаз (растворение, кристаллизация, фазовые переходы, химические реакции на границе двух фаз  , электрохимические реакции на границе электрод-раствор электролита, гетерогенные каталитические реакции).
, электрохимические реакции на границе электрод-раствор электролита, гетерогенные каталитические реакции).
По природе контактирующих фаз можно выделить 5 типов гетерогенных процессов: тв.-г., тв.-ж., тв.-тв., ж.-ж., ж.-г.
Особенности гетерогенных реакций
1. Скорость гетерогенной реакции зависит от величины и состояния поверхности. Поэтому правильнее ее относить не к единице объема реакционной системы, а к единице поверхности раздела фаз, т.е.  .
.
2. Многостадийность гетерогенных реакций.
а) Любая гетерогенная реакция включает, как минимум, 3 стадии:
1) подвод реагентов к границе раздела фаз
2) химическое взаимодействие на поверхности
3) отвод продуктов реакции в глубину объемной фазы
Могут иметь место и другие стадии, например: адсорбция реагентов и десорбция продуктов, ассоциация или диссоциация молекул, дополнительные химические превращения реагентов вблизи поверхности раздела фаз (комплексообразование, димеризация, протонирование и др.)
б) Если какая-либо из этих последовательных стадий протекает заметно медленнее, чем другие стадии, то именно она будет тормозить весь процесс и определять его скорость, т.е. являться лимитирующей стадией гетерогенного процесса.
|
|
|
3. Транспортные стадии, т.е. доставка реагентов в зону реакции и отвод продуктов осуществляются за счет диффузии.
Диффузией называют перемещение молекул вещества в неподвижной среде под действием разности концентраций или, как говорят, градиента концентрации в результате теплового движения.
Кинетические особенности гетерогенной реакции
1. Кинетическая область, диффузионная область.
2. В зависимости от условий проведения, кинетика одной и той же реакции может определяться как процессами диффузии, так и скоростью самого химического взаимодействия.
График зависимости  в широком интервале температур.
в широком интервале температур.
3. Области протекания реакции.
а) Диффузионная, переходная, кинетическая
б) Выяснение природы лимитирующей стадии
1) влияние температуры (температурный коэффициент константы скорости химической реакции (  ) и диффузии (
) и диффузии (  ), величина энергии активации
), величина энергии активации  )
)
2) влияние перемешивания
4. Кинетика в переходной области.
а)  для мономолекулярной реакции
для мономолекулярной реакции
б)  ,
, 
в) стационарный режим: 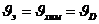

г) 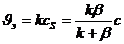

д) диффузионное и кинетическое сопротивление

е) анализ
1) 
2) 
Основные законы диффузии. Коэффициент диффузии
|
|
|
1. I –ый закон Фика
а) Движущая сила диффузии
1) Протекание любого химического процесса связано с разностью значений химического потенциала в различных частях системы, точнее с градиентом хим. потенциала, 
2) В случае идеальной системы имеем

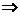

т.о. движущей силой процесса диффузии является разность концентраций или градиент концентрации
б) Диффузионный поток. Уравнение 1-го закона Фика

 - количество вещества, переносимого в единицу времени через единицу поверхности, например,
- количество вещества, переносимого в единицу времени через единицу поверхности, например, 
 - I-ое уравнение Фика
- I-ое уравнение Фика
 - коэффициент диффузии,
- коэффициент диффузии, 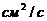
2. Коэффициент диффузии
а) Понятие коэффициента диффузии
 - количество вещества, переносимого в единицу времени через единичное поперечное сечение по нормали к поверхности при градиенте концентрации, равном единице.
- количество вещества, переносимого в единицу времени через единичное поперечное сечение по нормали к поверхности при градиенте концентрации, равном единице.
б)Уравнение Смолуховского-Эйнштейна-Стокса
Зависимость 
 .
.
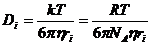 ,
,
1) Влияние природы растворителя, 
Если считать, что размеры сольватированных диффундирующих молекул мало отличаются в разных растворителях, то  .
.
2) Влияние размера диффундирующих частиц, 
3) Величины коэффициентов диффузии в различных средах

4) Зависимость 
Из уравнения Смолуховского может показаться, что коэффициент диффузии должнен возрастать пропорционально температуре. Но от температуры зависит и вязкость. В целом влияние температуры на  передается уравнением
передается уравнением
|
|
|
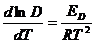
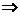
 ,
, 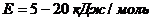
Температурный коэффициент, 
3. 2-ой закон Фика.
а) Уравнение 2-го закона Фика.
2-ой закон Фика устанавливает зависимость изменения концентрации диффундирующего вещества от времени для данного фиксированного расстояния от источника диффузии

б) Характер изменения концентрации
1) от расстояния от источника диффузии при разных  ,
,
2) от времени в данном сечении.
Типы диффузионных процессов
1. Стационарный режим диффузии
 ,
,  ; т.е. в данный объем входит и выходит из него одно и то же количество вещества. Концентрация меняется с расстоянием от поверхности диффузии, но в данном сечении сохраняет постоянное значение.
; т.е. в данный объем входит и выходит из него одно и то же количество вещества. Концентрация меняется с расстоянием от поверхности диффузии, но в данном сечении сохраняет постоянное значение.
2. Нестационарная диффузия.
 ,
, 
Кинетика диффузии при стационарном состоянии диффузионного потока.
1. Стационарный режим – концентрация диффундирующего вещества есть линейная функция расстояния от источника диффузии



2. Диффузионный слой,  .
.
а) Граничные условия: 
 или
или 
б) Понятие диффузионного слоя.
3. Пример – растворение в узкой трубке
|
|
|
а) Схема опыта.
б) Распределение концентраций по длине трубки,  .
.
в) Реальные примеры процессов, близких к стационарным
(растворение металлов в кислотах, растворение кристаллических тел в большом объеме при интенсивном перемешивании, электрохимическое осаждение металлов из раствора).
4. Скорость диффузии.
а) Схема диффузии из объема к поверхности 
б) 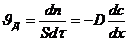


Для быстрых реакций 
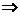
 .
.
в) Количество вещества, переносимого при стационарной диффузии.


5. Кинетика растворения твердого тела в жидкости.
а) Описание процесса растворения.
1) Схема процесса растворения с перемешиванием
2) Графическая зависимость  , диффузионный слой.
, диффузионный слой.
б) Скорость процесса растворения определяется изменением количества растворяемого вещества в единице объема.
 ,
,  но
но 
в) Кинетическое уравнение – уравнение 1-го порядка.
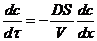
 ,
,  ,
,  ,
, 
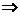
 – уравнение А.Н.Щукарева (1896г.)
– уравнение А.Н.Щукарева (1896г.)
г) Интегрирование уравнения Щукарева
1)  ,
, 
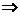

2)  ,
, 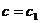
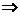

д) Эффективная константа скорости  :
:

К А Т А Л И З
Катализ – явление, связанное с изменением скоростей химических реакций в присутствии некоторых веществ (катализаторов), количество, а также химический состав которых сохраняются неизменными по завершении реакции.
Положительный катализ – просто катализ
Отрицательный катализ – ингибирование, ингибиторы.
Автокатализ, 
Дата добавления: 2018-02-18; просмотров: 1906; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
