Solutio Formaldehydi seu Formalinum
Получение:
Метиловый спирт насыщают кислородом и пропускают через раскаленную медную проволоку (медь-катализатор).

O2+Cu=>2CuO
CH3-ОН+CuO=>CH2O+Cu+H2O
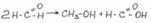
Для предотвращения разложения ( реакция дисмутации- см.выше) формальдегида к раствору добавляют 1% метилового спирта. При хранении раствора при температуре меньше 90С образуется белый осадок параформа, который не обладает действием формальдегида – ОБРАТНАЯ РЕАКЦИЯ НЕВОЗМОЖНА!
Свойства. Прозрачная бесцветная жидкость со своеобразным резким запвахом. Смешивается с водой и спиртом.
Подлинность:
1)Реакция “серебряного зеркала”.
К AgNO3 добавляют раствор аммиака до растворения образовавшегося осадка к полученному раствору прибавляют препарат и нагревают. По стенкам пробирки образуется металлическое серебро.
2AgNO3+2NH4OH=>Ag2O↓+2NH4NO3
Ag2O↓+4NH4OH=>2[Ag(NH3)2]OH+3H2O
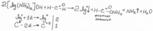
2)Получение ауринового красителя.
В выпарительную чашку помещают препарат, кристаллическую салициловую кислоту и концентрированную H2SO4.Постепенно появляется малиновое окрашивание.

Количественное определение:
Формальдегид может окисляться йодом.

Но реакция обратима, поэтому количественное определение- Метод йодометрии обратное титрование в щелочной среде.
ТНП помещают в банку с притертой пробкой (I2-летуч), добавляют избыток титрованного раствора йода и раствор щелочи и оставляют в темном месте на 10-15 мин.
I2+2NaOH=>NaI+NaIO+H2O

Затем раствор подкисляю серной кислотой, выделившийся йод оттитровывают Na2S2O3 до светло-желтой окраски, затем добавляют крахмал и продолжают титровать до обесцвечивания.
|
|
|
NaIO+NaI+H2SO4=>I2+Na2SO4+H2O
I2+2Na2S2O3=>Na2S4O6+2NaI
Применение.Наружно как антисептическое средство для дезинфекции рук, кожи, инструментов. используют для консервации биологических материалов.
Хранение. В хорошо закрытых банках при температуре не ниже 90С(образуется параформ) Для предохранения полимеризации и реакции дисмутации к раствору добавляют 1% метилового спирта.
Hexamethylentetraminum seu Urotropinum seu Methenaminum

Получение
Получают при формальдегида и аммиачной воды. Реакцию ведут при t=40 – 50. После окончания реакции среда должна быть оставаться щелочной и ощущаться запах аммиака. К раствору добавляют активированный уголь, фильтруют , выпаривают фильтрат в акуме до массы. После охлаждения кристаллизуется препарат. Его промывают , сушат и очищают перекристаллизации из спирта.

(CH2)6 N4 * 3AgNO3
(CH2)6 N4 * CaCI2
Может образовывать соли с минеральными кислотами
(CH2)6 N4 * HCI
Подлинность
1. Кислотный гидролиз и док-во выделяющихся продукт. реакции.
Препарат растворяют в воде добавляют H2SO4 и нагревают, ощущается характерный запах формальдегида, при добавления избытка щелочи ощущается запах аммиака.
|
|
|


2. Получение ауринового красителя.
Препарат помещают в выпарительную чашку, прибавляют концент. H2SO4 и нагревают , ощущается запах формальдегида и постепенно появляется малиновое окрашивание.
а) 
б) 
Количественное определение
По ГФ.
1. Метод нейтрализации. Обратное титрование
ТНП растворяют в воде и прибавляют избыток титровоного раствора H2SO4. Нагревают на водяной бане , затем раствор охлаждают и титруют раствором щелочи с 0,1 моль/л до желтого окрашивания. Индикатор м/ф

H2SO4 + 2NaOH = Na2SO4 + 2H2O
2. Метод нейтрализации, прямое титрование. Менее точен, но используют в аптеке.
ТНП помещают в колбу титрования, добавляют смешанный индикатор ( м /ф + метиловый синий в соот. 2:1) и титруют раствором HCI концентрацией 0,1 моль/л до перехода зеленой окраски в фиолетовый.
(CH2)6 N4 + HCI = (CH2)6 N4 + HCI
3. Если растворы с концентрацией более5% , то определяют методом рефрактометрии.
Применение. Используют как дезинфицирующее средство. Его действие основано на образовании в кислой среде формальдегида, который и оказывает дезинфицирующее действие. Применяется при заболевании мочевых путей (учитывать реакцию среды!) Обладает и противоподагрическим действием, поэтому применяют и при ревматизме. Применяют как противогриппозное средство. Формы приема: порошки,таблетки и в/в инъекции в виде 40%растворов.
|
|
|
Хранение. В хорошо закупоренных флаконах.
Глюкоза

Получение.
В результате гидролиза полимеров = полисахаридов - клетчатки или крахмала.
Свойства. Белый кристаллический порошок без запаха, сладкого вкуса. Легко растворим в воде.
Подлинность.
1.с реактивом Феллинга.
Препарат растворяют в воде, прибавляют раствор Феллинга и нагревают, образуется коричнево-красный осадок.
CuSO4 + 2NaOH = Cu(OH)2+ Na2 SO4

2. Реакция "серебряного зеркала"
RCOH +2 [Ag(NH3)2]OH = RCOONH4 + 2Ag + 3NH3 + H2O
3. Реакция конденсации с тимолом
В выпарительную чашку помещают препарат ( если раствор, то выпаривают ) прибовляют концентр. H2 SO4 (водоотнимающее средство) и тимол, нагревают. Постепенно появляется красное окрашивание.
Количественное определение
1. Метод йодометрии - обратное титрование в щелочной среде.
Точную навеску препарата растворяют в воде и прибавляют избыток I2 с концентрацией 0,1 моль/л и раствор щелочи.
I2 + 2NaOH=NaIO+H2O + NaI
R-COH + NaOI + NaOH = R-COONa + NaI +H2O чтобы прошла эта реакция раствор выдерживают 5-10 мин. в темном месте,
|
|
|
затем к раствору добавляют H2 SO4. Выделевшийся йод оттитровывают раствором Na2S2O3 с концентрацией 0,1моль/л до солеменно-желтой окраски, затем добавляют крахмал раствор становится синего цвета. Продолжают титровать до обесцвечивания.
NaI + NaIO +H2SO4= I2 + Na2SO4 + H2O
I2 + Na2S2O3 = 2NaI + Na2S4O6.
Если используют растворы глюкозы с концентрацией 5 % - рефрактометрии.
Применение. как питательное, общеукрепляющее вещество
Хранение. в плотно укупоренной таре при комнатной температуре.
ПРОСТЫЕ ЭФИРЫ
.
Димедрол
бета-диметиламиноэтилового эфира бензгидрола гидрохлорид.
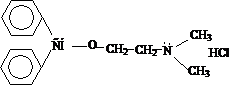
Свойства. Белый мелкокристаллический порошок без запаха. Очень легко растворим в воде, легко растворим в спирте и хлороформе.
Подлинность.
1. Реакция образования оксониевой соли
0,1 г препарата помещают в фарфоровую чашку,добавляют 1-2 капли концентрированной серной кислоты. Появляется ярко-желтое окрашивание ,постепенно переходящее в оранжевое. От добавления нескольких капель воды окраска исчезает.
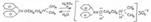
2. После кипячения раствора препарата с разбавленной хлороводородной кислотой выпадают кристаллы бензгидрола, которые после перекристаллизации и выпаривания имеют температуру плавления 62-670С
3. На CI -– с раствором нитрата серебра(см. выше).
Испытание на чистоту.
-- раствор препарата в воде д.б. прозрачным.
- не д.б. превышен предел кислотности и щелочности
- сульфатов и тяжелых металлов не более эталона
Количественное определение.
по ГФ кислотно-основное титрование в неводных средах.
Т.н.п. растворяют в ледяной уксусной кислоте, добавляют ацетат окисной ртути (для связывания выделяющейся соляной кислоты) и титруют раствором хлорной кислоты до зелёной окраски раствора. Индикатор – кристаллический фиолетовый.
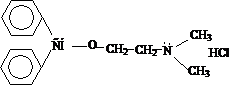 + HClO4 =
+ HClO4 = 
2HCl + Hg(CH3COO)2 = HgCl2+ 2CH3COOH
Внутриаптечный контроль
-метод нейтрализации в спирто-хлороформенной среде. Титруют раствором щелочи по индикатору фенолфталеину до розовой окраски раствора.
(дим)HCl + NaOH = (дим.) + NaCl + H2O
хлороформ добавляют для извлечения основания димедрола из реакционной среды, т.к. димедрол может вызвать преждевременное изменение окраски индикатора.
-метод аргентометрии по Мору (индикатор –хромат калия).
-метод аргентометрии по Фаянсу. Титруют в уксуснокислой среде по индикатору бромфеноловый синий.
-метод меркурИметрии или меркурОметрии по индикатору ДФК (дифенилкарбазон)
Применение. Противогистаминное средство, блокирующие Н1- рецепторы. Оказывает седативный эффект.Назначают при аллергических дерматозах, вазомоторном конъюктивите и рините, медикаментозных и других аллергиях.
Хранение. Сп.Б. В хорошо укупоренной таре, предохраняющей от действия света и влаги.
ВРД внутрь 0,1г, ВСД внутрь 0,25г
КАРБОНОВЫЕ КИСЛОТЫ
Calcii gluconas

Получение
Соль произв. глюконовой кислоты, которая получается окислением глюкозы. Для того что бы процесс шел в нужном напровлении проводят электролиз раствора глюкозы в присутствии CaCO3 и CaBr2

Свойства. Белый зернистый или кристаллический порошок без запаха и вкуса. Медленно растворим в воде, легко расторим в кипящей воде, практически нерастворим в спирте и эфире.
Подлинность.
1. На Са2+.
а)Крупинка соли внесена в бесцветное пламя, окрашивает его в кирпично-красный
б)оксалат NH4
препарат растворяет в горячей воде, охлаждают и добавляют оксалат аммония. Образуется белый мелкокристаллический осадок, растворимый в азотной и соляной кислоте и не растворимый в уксусной кислоте.

2.На глюконат
Препарат растворяют в воде и добавляют раствор FeCI3 образуется раствор светло-зеленого цвета.
Испытание на чистоту
-по мутности полученный раствор не должен превышать эталон№3
-раствор должен быть нейтральной реакции среды.
-не д.б. декстрина сахарозы
- хлоридов,сульфатов и тяжелых металлов не более эталона
Количественное определение
Метод трилонометрии.
ТНП растворяют в воде , прибавляют аммиачный буфер , индикатор кислотный хром темно-синий, титруют трилоном Б с концентрацией 0,05 моль/л до перехода красной окраски раствора в синюю.

Растворы кальция глюконата в условиях аптеки определяют рефрактометрически.
Применение. Источник ионов кальция, антиаллергическое средство.
Хранение. В хорошо укупоренной таре.
Acidum ascorbinicum (гамма лактон 2,3 дегидро-L-гулоновой кислоты)

Аскорбиновая кислота обладает кислотными свойствами за счет водорода в OH группе в 3-м положении : за счет ОН группы в 2м и 3м положении обладает свойством сильного восстановителя . Эти свойства используют в химическом анализе.
| о |
С -- ОН = C = О
|| | + 2Н+
С -- ОН С = О
| |
енольная кетонная
(в-ль) (ок-ль)
Для того что бы растворы акорбиной кислоты в процессе хранения , стерилизации не окислялся, добавляют стабилизатор - гидросульфит Na – NaHSO3
Свойства.Белый кристаллический порошок без запаха кислого вкуса. Легко растворим в воде, растворим в спирте, практически не растворим в эфире и хлороформе.
Подлинность
Реакции основаны на сильных восcтановительных свойствах аскорбиновой кислоты.
1. К раствору препарата прибавляют р-р Ag NO3. Образуется осадок черного цвета (серебро)
| |
С -- ОН C = O
|| +2Ag NO3 = | + 2HNO3 + 2 Ag
С -- ОН C = O
| |
2. К раствору препарата прибавляют раствор FeCI3 и раствор K3 [Fe(CN)6] образуется осадок синего цвета
| |
C - OH C = O
|| + 2FeCI3 = | + 2FeCI2 + 2HCI
C - OH C = O
| |
3FeCI2 + 2K3 [Fe(CN)6] = Fe3 [ Fe(CN)6]2 + 6KCI
син.
3. К раствору препарата прибавляют раствор Феллинга, образуется коричнего-красный осадок
| |
C – OH C = O
|| + 2Cu(OH)2 = Сu2O + | + H2O
C – OH C = O
| |
Количественное определение
1. Метод йодатометрии-по ГФ
Точную навеску препарата растворяют в воде в мерной колбе,берут разведение пипеткой, помещают в колбу для титрования ,подкисляют HCI добавляют 1% KI. Полученный раствор титруют раствором йодата калия с концентрацией 0,1 моль/л до появления синей окраски раствора. Индикатор- крахмал.
| + KIO3 = | + KI +3H2O
C-OH C=O
3 || 3 |
C-OH C=O fаскорбиновой кислоты=1/2
| |
KIО3 + 5KI + 6HCI = 3I2 + 6KCI + 3H2O
2C+ - 2e- 2C+2 в-ль 1/2
2. ВАК
1. Йодометрия.
Точную навеску препарата помещают в колбу для титрования, добавляют крахмал и титруют раствором I2 до синей окраски
! при титровании инъекционных растворов аскорбиновой кислоты надо помнить,что там присутствует стабилизатор NaHSO3 , который также реагирует с I2 для его нейтрализации добавляют раствор формальдегида.
| |
C-OH C=O
|| + I2 = || + 2HI
C-OH C=O
| |
О ОН
// /
C + Na – O - S – OH = H - C – O – S – ONa
/ \ // / //
H H О Н O
2. Метод нейтрализации.
Точную навеску препарата помещают в колбу для титрования, индикатор ф/ф и титруют раствором щелочи до розовой краски
| |
C-OH C-OH
|| + NaOH = || + H2O
C-OH C-ONa
| Fаскорбиновой 1 кислоты |
Применяют кислоту аскорбиновую в профилактических и лечебных целях при цинге, кровотечениях разной этиологии, инфекционных заболеваниях и интоксикациях, заболеваниях печени, почек и т.д. Назначают внутрь по 0,95-0.1г 3-5 раз в день. Внутримышечно и внутривенно вводят по1-3 мл 5% раствора натрия аскорбината.
Хранение. В хорошо укупоренной таре, предохраняя от действия света и кислорода воздуха. Устойчива в кристаллической форме, в растворах быстро разлагается.
Дата добавления: 2018-02-18; просмотров: 1267; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
