Ван-дер-Ваальс изотермаларын талдау
Дәріс 1-бөлім Термодинамиканың екінші бастамасы Термодинамиканың бірінші бастамасы энергияның сақталу және түрлену заңдарын сипаттағанымен, оқшауланған термодинамикалық жүйелердегі процестің жүру бағытына шектеу қоймайды. Бірақ табиғатта белгілі шарттарды қанағаттандыратын процестер ғана кездеседі. Табиғатта қандай процестер жүруі мүмкін– деген сұраққа термодинамиканың екінші бастамасы жауап береді. Бұл бастама термодинамикалық процестердің жүру бағытын анықтайды. 9.1 Қайтымды және қайтымсыз процестер Егер жүйедегі термодинамикалық процесс тура және кері бағытта жүріп, бастапқы қалыпқа қайта оралғанда қоршаған ортада ешқандай өзгеріс болмаса, ондай процесті қайтымды деп атайды. Кез-келген процесс қайтымды болу үшін ол тура бағытта жүрсе де, кері бағытта жүрсе де, барлық аралық күйлері тепе-теңдік болу керек. Егер процесс өте баяу жүрсе (газ баяу ұлғайғанда немесе сығылғанда), онда жүйенің осы процестің кез-келген уақытындағы күйін тепе-теңдік (квазастатикалық) деп, яғни, процесті қайтымды деп есептеуге болады. Іс жүзінде, кез-келген термодинамикалық процесс үйкеліс, жылуөткізгіштік, т.б. құбылыстармен қатар жүретіндіктен, жүйе энергиясының бір бөлігі (диссипацияланады) қоршаған сыртқы ортаға тарап кетеді. Сондықтан, нақты процестер әрқашан қайтымсыз болады. 9.2 Дөңгелек процестер Жылулық қозғалтқыш (машиналар) депжылу энергиясын механикалық жұмысқа түрлендіретін құрылғыны айтады. Барлық жылулық машиналар (іштен жанатын қозғалтқыш, бу және газ турбиналары, т.б.) дөңгелек, яғни, циклдік режимде жұмыс істейді. Дөңгелек процесс(немесе, цикл) деп жүйенің бірнеше аралық күйлерден өтіп, бастапқы күйге қайта оралатын процестерін айтады. 9.1 – суретттедөңгелек процестіp-V диаграммасындағы тұйықталған қисық арқылы бейнелеген. 9.1 – сурет.Бір циклде жасалған жұмыс Егер баллондағы газға жылу мөлшерін берсе, онда ол жылу термодинамиканың бірінші бастамасы ( ) бойынша ішкі энергиясының өзгерісіне ( ) және газдың ұлғаюы кезінде жасалатын жұмысқа ( ) жұмсалады. Егер процесс изотермиялық( және ), онда берілген жылу толығымен газдың жасайтын жұмысына кетеді. Газдың көлемі -ден -ге дейін ұлғайғанда жасалған пайдалы оң жұмыс диаграммадағы қисықпен шектелген аймақтың ауданымен өлшенеді.Газды 1 күйге қайта оралту үшін оныңкөлемі қисықпен бейнеленген процесс бойынша кішірейтіледі. Бұл процесс кезінде жасалған теріс жұмыс осы қисықтың астындағы аймақтың ауданымен анықталады.Егер газ көлемі ұлғайғанизотерматемпературасы Т1, оның сығылу изотермасының Т2 температурасынан үлкен болса ( ), онда толық жұмыс тұйықталғансызықпен шектелген аймақтың ауданына тең және оң болады. Олай болса, жылулық қозғалтқыш болғанда оң, ал T1<T2 болғанда теріс жұмыс жасайды. Кез-келген жылулық қозғалтқыштың жұмыс жасауы үшін қыздырғыш, суытқыш және жұмыс денесі қажет. 9.3 Карноның идеал жылулық машинасы Карно циклі деп тепе-теңдіктегі екі изотермиялық және екі адиабаталық ұлғаюлар мен сығылулардан тұратын қайтымдыдөңгелек процесті айтады. Карноның идеал жылулық машинасы жылуоқшаулағыш төсенішке орнатылған жұмыс денесімен (газбен) толтырылған цилиндрден, температурасы қыздырғыштан және температурасы суытқыштан тұрады. Карно цикліне талдау жасайық. 1) Күй параметрлері , және (9.2–сурет, диаграммадағы нүкте) цилиндр ішіндегі газдың көлемін цилиндрді қыздырғышқа қойып, одан алынған жылу есебінен -ге дейін өте баяу, изотермиялық әдіспен өсіреді. 2) Цилиндрді жылуоқшаулағыш төсенішке қойып, газды адиабаталық түрде ұлғайтады. Газ жұмысты ішкі энергия есебінен жасайтындықтан, оның температурасы суытқыштың температурасына дейін төмендейді. қисығы газдың адиабаталық ұлғаюын сипаттайды. 3) Газдың сығылу процесі де екі сатылы жүреді. Алдымен жұмыс денесі орналасқан цилиндрді суытқышпен жалғастырып, изотермиялық әдіспен сығады. Газ нүктемен белгіленген күйге жеткенде цилиндрді суытқыштан алып, жылуоқшаулағышқа қояды. Сығылу кезінде жасалған теріс жұмыс жылуға айналып, суытқышқа беріледі. қисығы газдың изотермиялық сығылуын сипаттайды. 4) Цилиндр жылуоқшаулағыш төсенішке қойылған соң, жұмыс денесін адиабаталық түрде одан әрі сығып, бастапқы күйге қайта алып келеді. 9.2 – сурет. Карно циклі Бұл процесте газдың температурасы Т2– ден Т1 – ге дейін өседі. қисығы газдың адиабаталық сығылу процесін сипаттайды. Температурасы қыздырғыштың бірдей болған газды қыздырғышпен қайта жалғап, циклді қайта бастайды. Газдың бір циклде жасаған жұмысы 4.2 – суреттегі « » фигура ауданымен анықталады: . (9.1)
|
|
|
|
|
|
|
|
|
|
|
|
Карно теоремасы
Жылулық қозғалтқыш циклінің үнемділігі жылулық пайдалы әсер коэффициенті (ПӘК немесе  ) арқылы сипатталады. Пайдалы әсер коэффициенті – бір циклде жасалғанA жұмыс пен қыздырғыштан жұмыс денесіне берілген Q1жылу мөлшерінің қатынасына тең физикалық шама. Карно циклі бойынша жұмыс істейтін қозғалтқыш үшін ПӘК:
) арқылы сипатталады. Пайдалы әсер коэффициенті – бір циклде жасалғанA жұмыс пен қыздырғыштан жұмыс денесіне берілген Q1жылу мөлшерінің қатынасына тең физикалық шама. Карно циклі бойынша жұмыс істейтін қозғалтқыш үшін ПӘК:
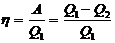 . (9.2)
. (9.2)
Бірқатар түрлендіруден соң Карно қозғалтқышының ПӘК-ін келесі түрге келтіруге болады:
 . (9.3)
. (9.3)
Соңғы екі формуладан келесі қатынасты табамыз:
 . (9.4)
. (9.4)
Олай болса,  болғанда ғана
болғанда ғана  болады. Бірақ температураны абсолюттік нөлге дейін төмендету мүмкін емес. Бұл Нернст теоремасы дәлелдеген термодинамиканың үшінші бастамасы. Сондықтан, әрқашан
болады. Бірақ температураны абсолюттік нөлге дейін төмендету мүмкін емес. Бұл Нернст теоремасы дәлелдеген термодинамиканың үшінші бастамасы. Сондықтан, әрқашан  болады. Карноның жылулық машинасы – идеал жылу машинасы. Мұндағы барлық процестер өте баяу өтетіндіктен, оларды қайтымды процессдеп қарастыруға болады. Температурасы әртүрлі денелер бір-бірінен оқшауланған. Сондықтан жылуөткізгіштік арқылы энергия жоғалмайды. Нақты машиналардың жұмыс жасауы кезінде энергияның қайтымсыз жоғалуы әрқашан қатар жүретіндіктен, олардың пайдалы әсер коэффициенті Карно машинасының пайдалы әсер коэффициентінен әрқашан аз болады:
болады. Карноның жылулық машинасы – идеал жылу машинасы. Мұндағы барлық процестер өте баяу өтетіндіктен, оларды қайтымды процессдеп қарастыруға болады. Температурасы әртүрлі денелер бір-бірінен оқшауланған. Сондықтан жылуөткізгіштік арқылы энергия жоғалмайды. Нақты машиналардың жұмыс жасауы кезінде энергияның қайтымсыз жоғалуы әрқашан қатар жүретіндіктен, олардың пайдалы әсер коэффициенті Карно машинасының пайдалы әсер коэффициентінен әрқашан аз болады:
 (9.5)
(9.5)
Жоғарыда келтірілген түсіндірмелер негізінде үш ережеден тұратын Карно теоремасы тұжырымдалады:
1) Карно циклінің  қыздырғыш мен суытқыштың температурасына ғана тәуелді;
қыздырғыш мен суытқыштың температурасына ғана тәуелді;
2)  жұмыс денесіне тәуелі емес (идеал газдың күй теңдеуі белгілі болғандықтан, ол үшін
жұмыс денесіне тәуелі емес (идеал газдың күй теңдеуі белгілі болғандықтан, ол үшін  есептеу жеңіл);
есептеу жеңіл);
3) қайтымды цикл бойынша жұмыс істейтін машиналар ПӘК-i қайтымсыз цикл бойынша жұмыс істейтін машиналардың ПӘК-iнен әрқашан артық болады:
 .
.
9.5 Клаузиус теңсіздігі
Карно теоремасына бойынша:
 немесе
немесе  .
.
Олай болса,
 немесе
немесе  .
.
Теңсіздіктің екі жағын  бөлшегіне көбейтсек, келесі өрнектерді аламыз
бөлшегіне көбейтсек, келесі өрнектерді аламыз
 немесе
немесе 
 немесе
немесе 
 ,
,
Мұндағы  – суытқышқа берілген жылу мөлшері;
– суытқышқа берілген жылу мөлшері;  – жұмыс денесінің суытқыштан қабылдаған. Жүйенің қандай да бір денеден алған жылу мөлшерінің сол дененің температурасына қатынасын
– жұмыс денесінің суытқыштан қабылдаған. Жүйенің қандай да бір денеден алған жылу мөлшерінің сол дененің температурасына қатынасын  , Клаузиус, келірілген жылу мөлшері деп атады.
, Клаузиус, келірілген жылу мөлшері деп атады.
Соңғы теңсіздік Клаузиус теңсіздігі деп аталады. Оның физикалық мағынасы: жүйенің циклде сырттан алған келтірілген жылуының элементар мөлшерлерінің қосындысы қайтымды циклдер үшін нөлге тең, ал қайтымсыз циклдер үшін нөлден кіші болады:
 . (9.6)
. (9.6)
.
9.6 Термодинамиканың екінші бастамасы
Термодинамиканың бірінші бастамасы энергияның сақталу және түрлену заңдарын сипаттағанымен, термодинамикалық процестердің жүру бағытын анықтауға мүмкіндік бермейді. Бұл бастама нәтижесі қандай да бір денеден алынған жылуды толығымен жұмысқа айналдыратын процестің мүмкіндігін жоққа шығармайды. Мысалы, термодинамиканың бірінші бастамасы бойынша белгілі жылу көзін суыту арқылы периодты жұмыс істейтін (мұхиттардың ішкі энергиясы есебінен) машина жасауға болады. Мұндай қозғалтқыш екінші текті мәңгі қозғалтқыш деп аталады.
Көптеген эксперименттердің нәтижелерін талдай отырып, ғалымдар екінші текті мәңгіқозғалтқыш жасау мүмкін емес деген тұжырымға келді. Бұл тұжырымдама термодинамиканың екінші бастамасы деген аталды.
Термодинамиканың екінші бастамасының өзара эквивалент бірнеше тұжырымдама бар. Келесі екі тұжырымдаманы талдайық:
1) жылуды толығымен жұмысқа айналдыратын периодты жылу машинасын жасау мүмкін емес

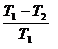 ; (9.15)
; (9.15)
2) жылу өздігінен температурасы жоғары денеден температурасы төмен денеге ғана өтуі мүмкін
 . (9.16)
. (9.16)
Бірінші формула екі тұжырымдаманы да түсіндіреді. Егер  болса (машина суытқышқа жылу бермесе), онда
болса (машина суытқышқа жылу бермесе), онда  , яғни, T2 = 0, бірақ абсолюттік нөлге тең температура алу мүмкін емес.
, яғни, T2 = 0, бірақ абсолюттік нөлге тең температура алу мүмкін емес.
Егер  болса (жұмыс денесі қыздырғыштан алған жылу мөлшерін толығымен суытқышқа берсе), онда
болса (жұмыс денесі қыздырғыштан алған жылу мөлшерін толығымен суытқышқа берсе), онда  , яғни,
, яғни, 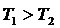 және
және  . Бұлай болуы мүмкін емес.
. Бұлай болуы мүмкін емес.
Термодинамиканың екінші бастамасы бірінші бастама секілді барлық жағдайда орындалатын әмбебап заң емес. Термодинамиканың бірінші бастамасы жылулық процестерге арналған энергияның сақталу заңы болағандықтан, оны кез-келген жүйе үшін қолдануға болады. Ал термодинамиканың екінші бастамасын өлшемдерішектеулі оқшауланған жүйелерге ғана қолдануға болады.
5-дәріс2-бөлім
Нақты газдар мен булар
Абстракциялық идеал газ ұғымын енгізу молекула-кинетикалық теорияны жасауға, тасымалдау құбылыстарын зерттеуге, жылусыйымдылықтарды есептеу мәселесін шешуге т.б. мүмкіндік берді. Төменгі қысымдар мен температураларда бұл теорияның қорытындылары эксперимент нәтижелерін жақсы түсіндіреді.
Қысым үлкен болғанда газ қатты сығылып, молекулалардың көлемдерінің қосындысы газдың көлемімен шамалас болады. Сонымен қатар, молекулалардың бір-бірінен қашықтығы молекуааралық күштерәсер ететін шамаға дейін азаяды.
10.1Ван-дер-Ваальс теңдеуі
Нақты газдардың күй теңдеуінде молекулалардың көлемі мен молекулааралық күштер ескерілуі керек. Сондықтан голландиялық физик Ван-дер-Ваальс идеал газ күйінің теңдеуіне екі түзету енгізді. Сол түзетулерді талдайық.
Молекула көлемін ескеру
Бөлшектер қатты жақындағанда олардың тебу күштері арта бастайды. Молекулалар бір-біріне кеңістіктегі алып тұрған орындарынан жақын орналаса алмайды. Сондықтан, газдың көлемі молекулалардың санына пропорционал b шамаға кем болу керек. Бір моль газдың көлемі келесі шамаға тең болады:
(  ). (10.1)
). (10.1)
Шар тәрізді молекулаларды барынша тығыз орналастырса да, олардың арасында қуыстар қалады. Олай болса,  тұрақтысы бір моль газдағы барлық молекулалардың көлемдерінің қосындысынан әрқашан артық болады.
тұрақтысы бір моль газдағы барлық молекулалардың көлемдерінің қосындысынан әрқашан артық болады.
10.2 Молекулалардың тартылыс күшін ескеру
Молекуалардың өзара тартылыс күші газ ішінде ішкі қысым деп аталатын қосымша қысым тудырады. Сондықтан күй теңдеуіндегі р қысымды (p+p1) шамасымен ауыстыру керек. Ван-дер-Ваальстің зерттеулері ішкі қысым молекулалар концентрациясының квадратына тура, мольдік көлем ( 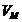 ) квадратына кері пропорционал болатынын көрсетті:
) квадратына кері пропорционал болатынын көрсетті:
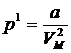 , (10.2)
, (10.2)
мұндағы а – газдың табиғатына тәуелді болатын тұрақты шама. Осы екі түзетуді Клапейрон теңдеуіне енгізсек, нақты газдың бір молі үшін күй теңдеуін аламыз (Ван-дер-Ваальс теңдеуі):
 . (10.3)
. (10.3)
Газдың кез-келген мөлшеріне (  ) арналған күй теңдеуінің түрі:
) арналған күй теңдеуінің түрі:
 , (10.4)
, (10.4)
мұндағы  мен
мен  – эксперимент арқылы анықталатын тұрақты шамалар;
– эксперимент арқылы анықталатын тұрақты шамалар;  – газ алып тұрған көлем. Ван-дер-Ваальс теңдеуін шығарарда бірқатар оңайлатулар енгізілгендіктен, бұл теңдеу нақты газ күйін жуықтап сипаттайды. Нақты газ күйін сипаттайтын басқа да теңдеулер бар. Бірақ олар күрделі болғандықтан мұнда қарастырылмайды.
– газ алып тұрған көлем. Ван-дер-Ваальс теңдеуін шығарарда бірқатар оңайлатулар енгізілгендіктен, бұл теңдеу нақты газ күйін жуықтап сипаттайды. Нақты газ күйін сипаттайтын басқа да теңдеулер бар. Бірақ олар күрделі болғандықтан мұнда қарастырылмайды.
Ван-дер-Ваальс изотермаларын талдау
Ван-дер-Ваальс теңдеуі  көлем бойынша үшінші дәрежелі теңдеу. Сондықтан p қысым мен T температураның берілген мәні үшін бұл теңдеудің үш түбірі болады. Түбірлердің екеуі комплекстік болуы мүмкін. Көлем нақты шама болғандықтан, р мен Т – ның кез-келген берілген мәнінде V бір немесе үш мәнге ие болуы мүмкін. Ван-дер-Ваальс теңдеулерін талдау үшін оның
көлем бойынша үшінші дәрежелі теңдеу. Сондықтан p қысым мен T температураның берілген мәні үшін бұл теңдеудің үш түбірі болады. Түбірлердің екеуі комплекстік болуы мүмкін. Көлем нақты шама болғандықтан, р мен Т – ның кез-келген берілген мәнінде V бір немесе үш мәнге ие болуы мүмкін. Ван-дер-Ваальс теңдеулерін талдау үшін оның  температуралар үшін изотермаларын салайық (10.1–cуреттегі 1,2,3,4 изотермалар). Графиктерді зерттеу арқылы келесі үш қорытынды жасауға болады:
температуралар үшін изотермаларын салайық (10.1–cуреттегі 1,2,3,4 изотермалар). Графиктерді зерттеу арқылы келесі үш қорытынды жасауға болады:
1. Температура (  ) жоғары болса, онда нақты газдың ) жоғары болса, онда нақты газдың  изотермасы идеал газ изотермасына ұқсас болады. изотермасы идеал газ изотермасына ұқсас болады.  болғандағы болғандағы  изобара изотермамен D нүктесінде қиылысады. Қысымның кез-келген р мәніндегі изобара изотермамен D нүктесінде қиылысады. Қысымның кез-келген р мәніндегі  температураға көлемнің V мәні сәйкес келеді, яғни, Ван-дер-Ваальс теңдеуінің бір ғана нақты түбірі болады.
2. Температуралар (Т2,Т3 және Т4) төмендеу болса, изотермаларда бүгілістер пайда болады. температураға көлемнің V мәні сәйкес келеді, яғни, Ван-дер-Ваальс теңдеуінің бір ғана нақты түбірі болады.
2. Температуралар (Т2,Т3 және Т4) төмендеу болса, изотермаларда бүгілістер пайда болады.  изобарамен 4 изотермаүш нүктеде (А,В,С)қиылысады. Бұл изобарамен 4 изотермаүш нүктеде (А,В,С)қиылысады. Бұл
|  10.1 – cурет. Ван-дер-Ваальс
изотермалары.
10.1 – cурет. Ван-дер-Ваальс
изотермалары.
|
нүктелер көлемнің р1 қысым мен Т4 температурадағы үш нақты мәндеріне (V1, V2, V3) сәйкес келеді.
3. Температура өсіп 4 изотермадан 3 және 2 изотермаларға ауысқан сайын қисықтардағы бүгіліс түзеле береді. А және С нүктелерінің ара қашықтығы азайып, 2 изотермада бір нүктеге – К бүгіліс нүктесіне бірігіп кетеді. Бұл нүктеден өтетін изобара  изотермаға жанама болады. Изотермасында бүгіліс нүктесі бар Т2 температура (сындық) критикалық температура деп аталады.
изотермаға жанама болады. Изотермасында бүгіліс нүктесі бар Т2 температура (сындық) критикалық температура деп аталады.
10.4 Заттың критикалық күйі. Фазалық ауысулар
Ван-дер-Ваальстың теориялық изотермаларының физикалық мәнін олардыңэксперименттік изотермаларымен салыстыра талдау арқылы түсінуге болады. 10.2–суретте қызыл сызықпен эксперименттік және көк сызықпен теориялық изотермалар берілген.
 10.2-сурет. Фазалық ауысулар
10.2-сурет. Фазалық ауысулар
| 1-2 және 3-4 аралықтарда екі қисық бірігіп кетеді. Ал 2-3 аралықта олардың айырмашылықтары байқалады. Эксперимент нәтижелері бойынша бұл аралықта көлем кішірейгенімен қысым өзгермейді. Бірақ, бұл уақытта газы толтырылған ыдыстың қабырғасында сұйықтық конденсирлене бастайды. 3 нүктеде газ сұйықтыққа айнала бастайды. Изотермияның  аралығына аралығына
|
сәйкес келетін жағдайда зат газ және сұйықтық болатын екі агрегаттық күйде болады. Бұл жағдайдағы газды қаныққан бу, ал оның қысымын қанығу қысымы деп атайды. Егер осы күйде көлем тұрақты болса, онда булану мен конденсация процестері тепе-теңдікте болады. Изотерманың 3-4 аралығы сұйықтыққа сәйкес келеді. Сұйықтықтың көлемі аз шамаға өзгерсе, қысым өте үлкен шамаға өзгереді. Сондықтан, оларды сығылмайтын орта ретінде қарастыруға болады. Жүйені теориялық изотермаларының  және
және 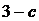 аралықтарына сәйкес күйге келтіру үшін арнайы жағдай орнату керек. Бірақ, бұл күйлер орнықты емес (метастабильді).
аралықтарына сәйкес күйге келтіру үшін арнайы жағдай орнату керек. Бірақ, бұл күйлер орнықты емес (метастабильді).  аралығында бу қысымы сол температурадағы қаныққан бу қысымынан артық болады. Бұл күйдегі буды аса қаныққан бу деп атайды.
аралығында бу қысымы сол температурадағы қаныққан бу қысымынан артық болады. Бұл күйдегі буды аса қаныққан бу деп атайды. 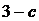 аралығында сұйықтықтың қысымы сол температурадағы қаныққан бу қысымынан төмен болады. Мұндай сұйықтық аса қызған сұйықтық деп аталады.
аралығында сұйықтықтың қысымы сол температурадағы қаныққан бу қысымынан төмен болады. Мұндай сұйықтық аса қызған сұйықтық деп аталады.
Егер әртүрлі температурадағы эксперименттік изотермалар сериясының горизонтальбөліктеріндегі шеткі нүктелерді жалғаса, онда қоңырау тәрізді қисық шығады (10.3 – сурет). Осы қисық пен К бүгіліс нүктесінің сол жағындағы изотермалар (  ) диаграмманы үш аймаққа бөледі: екіфазалық күй аймағына (қоңырау тәрізді қисықтың асты), сұйық күйге (сол жағы) және бу аймағына (оң жағы).
) диаграмманы үш аймаққа бөледі: екіфазалық күй аймағына (қоңырау тәрізді қисықтың асты), сұйық күйге (сол жағы) және бу аймағына (оң жағы).
 10.3 –сурет. Ван-дер-Ваальс изотермаларының сериясы
10.3 –сурет. Ван-дер-Ваальс изотермаларының сериясы
| Критикалық изотерманың үстіндегі аймақтағы газға қандай қысым берсе де, ол сұйыққа айнала алмайды. К нүктесіне сәйкес келетін 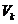 көлем мен көлем мен  қысым мәні критикалық деп аталады.
сұйықтықтың сығылуын сипаттай алады. Критикалық күй параметрлеры келесі өрнектермен анықталады: қысым мәні критикалық деп аталады.
сұйықтықтың сығылуын сипаттай алады. Критикалық күй параметрлеры келесі өрнектермен анықталады:
 . (10.5)
Мұндағы: а мен b –Ван-дер-Ваальс түзетулері, . (10.5)
Мұндағы: а мен b –Ван-дер-Ваальс түзетулері,
|
 –газдың универсал тұрақтысы. Сонымен,Ван-дер-Ваальс теңдеуі газ күйін, газдың сұйықтыққа айналу процесін және сұйықтықтың сығылуын сипаттай алады.
–газдың универсал тұрақтысы. Сонымен,Ван-дер-Ваальс теңдеуі газ күйін, газдың сұйықтыққа айналу процесін және сұйықтықтың сығылуын сипаттай алады.
Әдебиеттер:
Негізгі: 1 [317-335], 2 [141-152], 3 [165-181].
Қосымша: 12 [103-110].
Дата добавления: 2018-02-18; просмотров: 3151; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
