Методика проведения эксперимента
Кинетика каталитического разложения пероксида водорода на платиновых катализаторах
Реакция разложения водных растворов пероксида водорода: 2 Н2О2 → 2 Н2О + О2
при температуре, близкой к комнатной, протекает с заметной скоростью только в присутствии катализатора. Существуют многочисленные как гомогенные, так и гетерогенные катализаторы разложения пероксида водорода.
В гетерогенных процессах реагирующие компоненты находятся в разных фазах, и реакция происходит на границе раздела фаз, твердый катализатор – жидкость или газ. Металлические катализаторы (Pt, Pd, Ni, Co, Mo, Fe и др.) применяют как в виде компактных металлов (порошки, черни, коллоидные осадки), так и в виде металлов, нанесенных на поверхность носителей (уголь, силикагель, оксид алюминия и др.).
В случае гомогенного катализа активность катализатора определяют как скорость химической реакции, отнесенная к концентрации гомогенного катализатора.
Для гетерогенного катализатора необходимо учитывать количество активных центров на поверхности. Активность гетерогенного катализатора оценивают почислу молекул реагирующего вещества, которые превращаются в единицу времени на одномактивном центре катализатора при заданной температуре. Количество прореагировавших молекул определяют по известной константе скорости реакции, умноженной на концентрацию реагента в соответствующей степени.Если количество активных центров неизвестно, то проводят отнесение к единице массы активного компонента или к поверхности катализатора.
|
|
|
В научной литературе активность гетерогенного катализатора нередко оценивают по числу оборотов реакции (TOF, turn over frequency). Эта величина характеризует частоту превращения молекул реагента на одном активном центре катализатора.
Целью настоящей работы является изучение скорости разложения пероксида водорода на нанесенных платиновых катализаторах в зависимости от температуры, количества катализатора и природы носителя. Реакция протекает по первому или близкому к первому (0,7-1,2) порядку. Поэтому для оценки константы скорости можно пользоваться кинетическим уравнением первого порядка:

арабской цифрой обозначают номер реакции, а порядок – римской: первый – I.
Одним из наиболее распространенных методов изучения кинетики реакций, сопровождаемых выделением газообразного вещества, является газометрический метод. Поскольку изменение концентрации пероксида пропорционально количеству выделившегося кислорода, при газометрическом методе константу скорости удобнее рассчитывать через объемы выделившегося кислорода, а именно
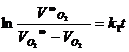 ,
,
где VO2 – объем кислорода в мл, выделившегося к моменту времени t,
|
|
|
VO2∞ - общий объем выделившегося в опыте кислорода (тут предполагается полное протекание реакции, а строго этого нет).
Типы выполняемых заданий:
1. Определение порядка реакции и константы скорости методом графического дифференцирования и по времени полураспада пероксида водорода.
2. Изучение зависимости константы скорости реакции от температуры и расчет энергии активации.
3. Изучение зависимости константы скорости от количества катализатора.
При выполнении всех заданий необходимо придерживаться определенного порядка нахождения кинетических данных (см. стр.5). Методы определения порядка реакции, константы скорости и энергии активации изложены на стр. 5-10.
Методика проведения эксперимента
Описание установки.
Опыты проводят на установке Уолтона-Шпитальского, схема которой показана на рис. 1. Измерительная система состоит из газометрической бюретки (Б) с уравнительной склянкой (В). Уравнительная склянка нужна для того, чтобы измерения объема проводить всегда при одном и том же давлении (атмосферном). Уравнительная склянка сообщается с газометрической бюреткой с помощью резинового шланга (Г). Реактор (А) резиновым шлангом соединен с измерительной системой: газометрической бюреткой (Б) и уравнительной склянкой (В). Для поддержания постоянной температуры реакции, в рубашку реактора подается вода из термостата, в котором поддерживается нужная температура.
|
|
|

Рис.1. Схема установки Уолтона-Шпитальского для изучения каталитического разложения пероксида водорода.
При проведении эксперимента используют реакторы двух типов (рис. 2):
а/ горизонтальный (“утка”), выполненный в виде «лодочки», который закрепляется зажимами на качалке, и
б/ вертикальный, который закрепляется в лапке штатива на магнитном перемешивающем устройстве.

Рис.2. Схемы реакторов, используемых в работе: а) горизонтальный;
б) вертикальный.
Для устранения влияния диффузионных факторов на кинетику процесса число качаний качалки должно быть не ниже 300 в минуту. Скорость перемешивания с помощью магнитной мешалки подбирается вручную: необходимые значения частоты вращения мешалки устанавливает сотрудник практикума на основании предварительных измерений.
Дата добавления: 2018-02-18; просмотров: 397; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
