Написать еще реакции минимум 1.17, 1.18,1.19 схем
Применение
Производные 1,2,4-триазина находят применение в различных областях, в том числе медицине и сельском хозяйстве.
Непосредственно на основе амино-1,2,4-триазинов продолжают создавать новые фармацевтические препараты, обладающие противовоспалительной и анальгизиоующей способностью, вируцидной активностью, антибактериальным действием, а так же препараты, которые применяют для лечения расстройства центральной нервной системы, малярии [17]. 5-аминотриазины нашли свое применение в качестве пестицидов. Так, 5-оксиамино-1,2,4-триазин-3(2Н)-он активен против широколистных, злаковых, однолетних и многолетних сорняков и обладает фунгицидным эффектом против Fusariumoxysporum[18].
Галогензамещенные триазины так же находят свое применение в качестве лекарственных препаратов и пестицидов. В последнее время как препараты обладающие противовоспалительным действием, предложены 3-хлор-5NHR-1,2,4-триазины [19]. 3,6-Дихлор-5NHR-1,2,4-триазин его применяют в качестве гербицидов и они не являются токсичными для риса, сои, хлопчатника, редиса, кукурузы[20].
Азомитины 1,2,4-триазинов обладают рострегулирующей и гербицидной активностями. Они могут использоваться в сельскохозяйственной практике для повышения урожая культур[15].
Схема 1.20

где R - фенил, n - хлорфенил, фурил, бутил.
Набрать схему в редакторе 1.20
Описываются новые производные 1,2,4-триазин-6-она общей формулы (схема 1.21) или их фармацевтически приемлемые кислотно-аддитивные соли, или стереохимические изомерные формы, где кольца А и В означают фенил; фармацевтическая композиция на их основе и применяется для лечения или предупреждения ВИЧ-инфекции [24].
|
|
|
Схема 1.21
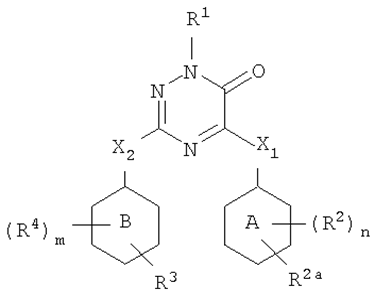
где n – 1, 2, 3, и в случае, когда кольцо А представляет фенил, n также может быть равно 4; m – 1, 2, 3, и в случае, когда кольцо В представляет фенил, m также может быть равно 4; R1 –водород, арил, формил; R2 –водород, гидрокси, галоген; R3 – циано, аминокарбонил, амино, галоген.
Предлагаемое изобретение относится к получению высокоэффективного антибиотика цефалоспоринового ряда цефтриаксона динатриевой соли гемигептагидрата 7-{[2-аминотиазол-4-ил)-2-син-метоксиимино]ацетамидо}-3-{[(2,5-дигидро-6-гидрокси-2-метил-5-оксо-1,2,4-триазин-3-ил)тио]метил}-3-цефем-4-карбоновой кислоты, соответствующей формуле

Обсуждение результатов эксперимента
Синтез 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазина
Нами был проведен синтез 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазина (5). Соединение (5) получено конденсацией тиосемикарбазида с калиевой солью a-кетокислоты, в данном случае фенилглиоксиловой кислоты. Калиевую соль фенилглиоксиловой кислоты получали, окислением ацетофенона перманганатом калия в водной щелочной среде. Реакцию проводили при интенсивном перемешивании, добавляя порцию щелочного раствора перманганата калия, после каждого обесцвечивания реакционной массы (схема 2.1):
|
|
|
Схема 2.1

Реакцию окисления прекращали после проверки обесцвечивания пятна реакционной смеси на фильтровальной бумажке. Калиевую соль фенилглиоксиловой кислоты (схема 2.2) не выделяли из реакционной смеси, после отделения осадка диоксида марганца, а использовали фильтрат в дальнейшем для конденсации с тиосемикарбазидом.
Схема 2.2.
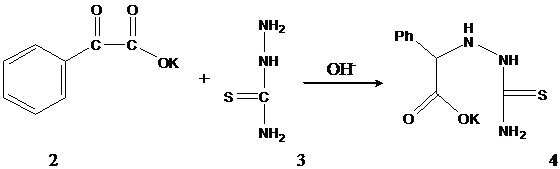
Процесс протекает через образование гидразона фенилглиоксиловой кислоты (4). Реакция проходит в течении 10-20 минут. Гидразон выделяют добавлением разбавленной соляной кислоты HCl на холоду или при небольшом нагревании. В дальнейшем сушат. Выход гидразона 75% .
Для увеличения выхода конечного продукта 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазина (5) гидразон фенилглиоксиловой кислоты из реакционной смеси не выделяли, а использовали в дальнейшем синтезе (схема 2.3). Конденсацию проводили при кипячении в водной щелочной среде.
Схема 2.3
 5
5
|
|
|
Структура 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазина (5) подтверждена методами рентгеноструктурного анализа, ИК-, ЯМР 1Н-спектроскопии и данными элементного анализа.
Соединение (5) представляет собой желтое кристаллическое вещество не растворимое в воде, растворимое в большинстве органических растворителей, стабильно при хранении.
Соединение (5) представляет собой желтое кристаллическое вещество не растворимое в воде, растворимое в большинстве органических растворителей, стабильно при хранении.
В ИК спектре соединения 5 характеристическое колебание карбонильной группы (С=О) триазинового кольца находится при 1693 см-1. Валентное колебание тионной группы расположено при 1263 см-1.

Рисунок 2.1 – ИК – спектр 5-оксо-3-тиоксо-6-фенил-2H,4H-1,24-триазина
«Скелетное» колебание триазинового кольца находится при 1110, 1050, 995 см-1, что соответствует литературным данным. Полосы поглощения связей С=С, С=N, N=N находятся при 1640, 1610, 1600 см-1. При 3150, 3064, 2900 см-1 находятся валентные колебания связи С-Н, а деформационные колебания связи С-Н проявляются при 1159, 1100 см-1 (плоскостные) и при 790, 780,740, 700 см-1 (внеплоскостные).
|
|
|
Масс- спектр подтверждает строение 5-оксо-3-тиоксо-6-фенил-2H,4H-1,24-триазина.

Рисунок 2.2. – Масс-спектр 5-оксо-3-тиоксо-6-фенил-2H,4H-1,2,4-триазина
Исходя из метода получения 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазина (5), возможно прохождение реакции и по атому азота аминогруппы тиосемикарбазида с карбонильной группой калиевой соли фенилглиоксиловой кислоты, которая может привести к 6-оксо-3-тиоксо-5-фенил-2H,4H-1,2,4-триазину. Исходя из литературных данных, температура плавления соединения (5) имеет большие расхождения от 220 до 260 оС. Для проверки правильности структуры синтезированного 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазина (5) нами сделан рентгеноструктурный анализ.
Дигидротриазиновый цикл (рис. 2.3) плоский с точностью 0.01 Å. Фенильный заместитель развернут относительно гетероцикла (торсионный угол С(2)-С(1)-С(4)-С(9) 33.0(2)°), несмотря на присутствие слабой внутримолекулярной водородной связи С(9)-Н…О(1) Н…О 2.41 Å С-Н…О 117° и аттрактивного взаимодействия Н(5)…N(3) 2.50 Å .
Кристаллы ромбические, при 200С a=11.206 Å, b=7.722 Å, c=21.165 Å, V=1831.5 Å3, Mr=205.24, Z=8, пространственная группа Pbca, dвыч=1.489 г/см3, m(MoKa)=0.319 мм-1, F(000)=848. Параметры элементарной ячейки и интенсивности 10467 отражений (2671 независимых, Rint=0.063) измерены на дифрактометре «Xcalibur-3» (MoKa излучение, CCD-детектор, графитовый монохроматор, w-сканирование, 2qмакс=600). Молекулы в кристалле образуют бесконечные зигзагообразные цепочки за счет межмолекулярных водородных связей.

Рисунок 2.3 - Молекулярное строение 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазина
Структура расшифрована прямым методом по комплексу программ SHELXTL. Положения атомов водорода выявлены из разностного синтеза электронной плотности и уточнены в изотропном приближении. Структура уточнена по F2 полноматричным МНК в анизотропном приближении для неводородных атомов до wR2 = 0.123 по 2631 отражениям (R1 = 0.044 по 1776 отражениям с F>4s(F), S = 0.951).
Длины связей в молекуле зависят от расположения атомов в молекуле. Так, анализируя представленные данные (таблица 2.1), можно сказать, что наибольшая длина связи в триазиновом кольце соединения (5) проявляется между атомами N(1)-C(2)= 1.381(2); наименьшая - N(3)-C(1)= 1.299(2).
Таблица 2.1 - Длины связей (Å) в структуре 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазина
| Связь | Длина связи, Å | Связь | Длина связи, Å |
| S(1)-C(3) | 1.662(2) | O(1)-C(2) | 1.215(2) |
| N(1)-C(3) | 1.357(2) | N(1)-C(2) | 1.381(2) |
| N(2)-C(3) | 1.346(2) | N(2)-N(3) | 1.353(2) |
| N(3)-C(1) | 1.299(2) | C(1)-C(2) | 1.474(2) |
| C(1)-C(4) | 1.479(2) | C(4)-C(5) | 1.387(2) |
| C(4)-C(9) | 1.397(2) | C(5)-C(6) | 1.378(3) |
| C(6)-C(7) | 1.377(3) | C(7)-C(8) | 1.372(3) |
| C(8)-C(9) | 1.386(3) |
Таким образом, структура соединения 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазина соответствует, полученной нами по предложенной методике.
При взаимодействии соединения 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазина (5) с нитритом натрия в кислой среде про 0 оС синтезирован 4-нитрозо-5-оксо-3-тиоксо-6-фенил-2Н-1,2,4-триазин (6) (схема 2.4):
Схема 2.4
 |
Реакция нитрозирования проходит в гетерогенной фазе, поэтому необходимо интенсивное перемешивание. В качестве кислоты брали соляную кислоту, которую помещали в реакционную смесь и осторожно прикапывали расчетное количество нитрита натрия в воде так, чтобы не наблюдалось выделение нитрозных газов. После добавления раствора нитрита натрия реакционную смесь фильтровали и осадок сушили на воздухе. Получили после очистки желтое кристаллическое вещество, нерастворимое в воде, но хорошо растворимое в ацетоне.
 Возможность прохождения реакции замещения в триазиновом кольце обусловлена сдвигом вправо таутомерного равновесия: 3-меркапто-5-гидрокси-6-фенил-2Н,4Н-1,2,4-триазин 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазин в кислой среде. В сущности реакции, которые рассматриваются, являются нитрозированием смешанных имидов кислот (схема 2.5).
Возможность прохождения реакции замещения в триазиновом кольце обусловлена сдвигом вправо таутомерного равновесия: 3-меркапто-5-гидрокси-6-фенил-2Н,4Н-1,2,4-триазин 5-оксо-3-тиоксо-6-фенил-2Н,4Н-1,2,4-триазин в кислой среде. В сущности реакции, которые рассматриваются, являются нитрозированием смешанных имидов кислот (схема 2.5).
Схема 2.5

А В
Кислая среда для сдвига таутомерного равновесия задается условиями проведения реакции (нитрозирование). Принципиально возможно замещение как по атому азота в положении 4 гетероцикла (что и наблюдается) , так и по атому азота в положении 2 кольца. Преобладает первое в силу более высокой электронной плотности на атоме N(4) гетероцикла (схема 2.6).
Предложен следующий механизм прохождения нитрозирования исходного соединения.
Первой и лимитирующей стадией нитрозирования является атака электрофила ON-Z (где Z=-OH2, -NO2, -Cl) на атом азота кольца. Атака электрофильного агента преимущественно проходит по sp3-гибридному атому азота триазинового кольца, находящегося в таутомерной форме А, учитывая меньшую нуклеофильность sp2-гибридного атома азота таутомерной формы Б.
Схема 2.6.

6
Определенный интерес представляет причины стабильности заместителей, в особенности атома серы, в гетероцикле в присутствии сильных окислителей (HNO2, N2O3 ) .Возможно, что защитную роль играет кислая среда (путем дальнейшего сдвига таутомерного равновесия в сторону кетоформы А) в результате меньшей окислительной способности тиоксогруппы по сравнению с меркаптогруппами и в особенности тиолят-анионами (-S-) .
Строение соединения 6 установлено по данным элементного анализа, ИК- и ЯМР 1Н спектроскопии.
В ИК спектре соединения 4-нитрозо-5-оксо-3-тиоксо-6-фенил-2Н-1,2,4-триазина (6) имеются характеристические полосы поглощения карбонильной группы при 1620 см-1 (nC=O) и тионной группы при 1185 см-1 (nC=S). Сохраняется полоса поглощения при 3430 см-1, которая относится к валентным колебаниям связи N(2)-H, что свидетельствует об отсутствии замещения по атому азота в положение 2 кольца. Спектр ЯМР 1Н приведен на рисунке 2.4.
Рис.2.4. -
Наличие в триазиновом кольце нескольких реакционных центров: нитрозогруппы, оксогруппы, тиоксогруппы предполагает проведение разнообразных реакций по каждой группе.
Нас заинтересовала иоксогруппа, которая может алкилироваться, замещаться нуклеофилами, окисляться.
В зависимости от условий окисления можно получить различные продукты окисления по тиоксогруппе: сульфокислоты, сульфохлориды, сульфоамиды, дисульфиды, провести окислительное отщепление тиоксогруппы.
Мы провели окисление 4-нитрозо-5-оксо-3-тиоксо-6-фенил-2Н-1,2,4-триазина (6) в мягких условиях, используя в качестве окислителя раствор Люголя в щелочной среде. В этих- условиях должно пройти окисление до соответствующего дисульфида.
3,3’-Бис[5-оксо-4-нитрозо-6-фенил-1,2,4-триазин]дисульфид (7) получен окислением соединения 6 свежеприготовленным раствором I2+KI в растворе карбоната натрия (Na2CO3). Реакцию проводили при перемешивании в течение 2-3 ч, поддерживая температуру 70-80 оС (водяная баня). После чего промывали осадок на фильтре раствором карбоната натрия Na2CO3 и сушили на воздухе (схема 2.7).
Схема 2.7
 6 7
6 7
Соединение 7 представляет собой желтое кристаллическое вещество, нерастворимое в воде. Строение установлено совокупностью данных элементного анализа, ИК-, ЯМР 1Н спектроскопии.
В ИК спектре соединения 7 исчезает характеристическая полоса поглощения при 1185 см-1, имеющая в ИК спектре исходного соединения 6 и отнесенная к валентным колебаниям тионной группы. Валентное колебание группы -N-N=O расположено при 1410 см-1, а для исходного соединения 6 – при 1500 см-1.
Экспериментальная часть
Дата добавления: 2018-02-15; просмотров: 668; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
