ТЕПЛОВОЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ.
ОСНОВНЫЕ ПОНЯТИЯ ЭНЕРГЕТИЧЕСКОГО БАЛАНСА ПРОЦЕССА ГОРЕНИЯ
Под тепловым эффектом реакции понимают количество теплоты, которое выделяется или поглощается системой в ходе реакции.
В тех случаях, когда теплосодержание системы после реакции уменьшается (реакция идет с выделением энергии), реакция является экзотермической. Если теплосодержание конечных продуктов выше исходных (реакция идет с поглощением энергии), реакция является эндотермической.
Теплосодержание системы определяется теплотой образования компонентов системы (продуктов горения и исходного вещества). Таким образом тепловой эффект реакции можно записать:
ΔHг = ∑ ΔH 0fпг − ∑ ΔHofгв,
где ΔHofпг и ΔHofгв — теплота образования продуктов горения и исходных горючих веществ соответственно.
Теплота образования веществ определяется по справочникам или рассчитывается исходя из структуры вещества.
Теплотой сгорания называется количество тепла, выделяющееся при полном сгорании единицы количества вещества при условии, что начальные и конечные продукты находятся в стандартных условиях.
Различают:
молярную Q — для одного моля (кДж/моль),
массовую Q′ − для одного килограмма (кДж/кг),
объемную Q″ − для одного кубического метра вещества (кДж/м³) теплоту сгорания.
В зависимости от агрегатного состояния воды, образовавшейся в процессе горения, различают высшую Qв и низшую Qн теплоту сгорания.
|
|
|
Высшей теплотой сгорания называется количество тепла, которое выделяется при полном сгорании единицы количества горючего вещества, включая тепло конденсации водяных паров.
Низшей теплотой сгорания называется количество тепла, которое выделяется при полном сгорании единицы количества горючего вещества при условии, что вода в продуктах горения находится в газообразном состоянии.
Молярную теплоту сгорания рассчитывают в соответствии с законом Гесса:
Qгор=  I ∆H0 fгв , кДж/моль
I ∆H0 fгв , кДж/моль
Для расчета молярной теплоты сгорания Q в массовую Q′ можно использовать формулу:
Q 1`гор=  , кДж/моль
, кДж/моль
где μ - молярная масса горючего вещества , кг/кмоль.
Для веществ в газообразном состоянии при пересчете из стандартной теплоты сгорания Q в объемную Q″ используют формулу:
Q 2гор=  μ
μ
где Vμ - объем кило моля газа, который при стандартных условиях составляет 22,4 м³/кмоль.
Для сложных горючих веществ или смесей можно вывести формулу определения теплоты сгорания исходя из состава и процентного содержания компонентов.
Достаточно точные результаты дает формула Менделеева для высшей теплоты сгорания:
Qв′ = 339,4·φ С + 1256,8·φН + 108,9(φS − φO – φN),
|
|
|
где φO, φN, φS, φС, φН — процентное содержание кислорода, азота, серы, углерода, водорода в горючем веществе.
Для низшей теплоты сгорания:
Qн′ = Qв′ – 25,1(9·φН + W%), кДж/кг,
где W% − содержимое влаги в горючем веществе.
Теплота сгорания имеет большое практическое значение при расчете пожарной нагрузки и параметров пожара.
Под пожарной нагрузкой (Рпож) понимают количество тепла, которое может выделиться при сгорании веществ и материалов, приходящихся на один квадратный метр поверхности пола помещения, МДж/м².
Пожарная нагрузка является количественной характеристикой, определяющей тепловое влияние пожара на строительные конструкции. Пожарную нагрузку рассчитывают как сумму произведений масс всех горючих материалов на их низшую теплоту сгорания, отнесенную к единице поверхности пола по формуле:
P=  ∙10-3 , МДж/м².
∙10-3 , МДж/м².
Низшая теплота сгорания также используется для определения пожарной опасности горючих веществ. Экспериментально доказано, что вещества являются негорючими, если они не относятся к взрывоопасным и их низшая теплота сгорания меньше, чем 2100 кДж/кг или 1830 кДж/м³.
ТЕМПЕРАТУРА ГОРЕНИЯ
Тепло, выделяющееся в зоне горения, расходуется на нагревание продуктов горения и теплопотери (к последним относятся предварительный нагрев горючего вещества и излучение из зоны горения в окружающую среду).
|
|
|
Максимальная температура в зоне горения, до которой нагреваются продукты горения, называется температурой горения.
В зависимости от условий, в которых протекает процесс горения различают калориметрическую, теоретическую, адиабатическую и действительную температуры горения.
Под калориметрической температурой горения понимают температуру, до которой нагреваются продукты горения при соблюдении следующих условий:
1) все тепло, выделившееся в процессе реакции, идет на нагревание продуктов горения;
2) происходит полное сгорание стехиометрической горючей смеси, коэффициент избытка воздуха (αв =1);
3) в процессе образования продуктов горения не происходит их диссоциация;
4) горючая смесь находится при начальной температуре 273К и давлении 101,3 кПа.
Теоретическая температура горения отличается от калориметрической тем, что в расчетах учитываются тепло потери на диссоциацию продуктов горения.
Диссоциацию продуктов горения нужно учитывать при температурах выше 1700°С.
Адиабатическая температура горения определяется для не стехиометрической горючей смеси (αв ≠1).
|
|
|
Действительная температура горения - это температура, до которой нагреваются продукты горения в реальных условиях.
Температуру горения используют при расчетах давления взрыва, для определения площади легко сбрасываемых конструкций, температуры пожара и других параметров.
Практическая работа №3
Тема: «Расчет теплоты сгорания веществ».
Цель работы: Усвоить основные понятия энергетического баланса процессов горения. Научиться делать расчет теплоты сгорания для разного типа горючего вещества (индивидуальные вещества, сложные вещества, газы)
Расчетные формулы
При расчетах теплового баланса на пожаре определяют, как правило, низшую теплоту сгорания(табл.2.1):
QB-QH=QИС (2.1),
где QB-высшая теплота сгорания; QH-низшая теплота сгорания;
QИС- теплота испарения воды, выделяющейся при сгорании вещества.
Таблица 2.1.
| Тип горючего вещества | Расчет теплоты сгорания | Размерность |
| Индивидуальное вещество |
Qн=  (2.2) (2.2)
| кДж/моль; |
| Вещества сложного Состава (формула Д.И.Менделеева) | Qн=339,4С+1257Н-108,9(О-S)-25,1(9H+W) (2.3) | кДж/кг |
| Смесь газов |
Qн=  Hi∙φri (2.4) Hi∙φri (2.4)
| кДж/моль; кДж/м3 |
Где  - соответственно теплоты образования одного кмоля i-го конечного продукта горения и
- соответственно теплоты образования одного кмоля i-го конечного продукта горения и  исходного вещества;
исходного вещества;
 ,
, 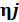 - соответственно количество кмолей
- соответственно количество кмолей  -гопродукта реакции и
-гопродукта реакции и  исходного вещества в уравнении реакции горения;
исходного вещества в уравнении реакции горения;
С, Н,S,W- соответственно содержание, % вес, углерода, серы, водорода, влаги в составе вещества;
О-сумма кислорода и азота ,% вес
QHi-низшая теплота сгорания  -го горючего компонента газовой смеси, кДж/моль; кДж/м3
-го горючего компонента газовой смеси, кДж/моль; кДж/м3
φri-содержание  -го горючего компонента в газовой смеси ,% об.
-го горючего компонента в газовой смеси ,% об.
Расчет теплоты сгорания газовоздушных смесей проводят по формуле по формуле
Qсмн=  Qнφr (2.5),
Qнφr (2.5),
где Qсмн- теплота сгорания газовоздушной смеси, кДж/м3, кДж/м3
QH-низшая теплота сгорания горючего вещества, кДж/м3, кДж/м3
φri- концентрация горючего в смеси, % об.
Удельная скорость (интенсивность) тепловыделения при горении:
q=QH∙m (2.6)
q- удельная интенсивность тепловыделения,кВт/м3;
m-массовая скорость выгорания, кг/(м2∙с).
Скорость тепловыделения при горении:
Q= QH∙m (2.7), где Q-интенсивность тепловыделения, кВт;
F-площадь горения, м3.
Примеры решения задач
Пример №1Определить низшую теплоту сгорания уксусной кислоты, если теплота ее образования 485,6 кДж/моль;
Решение: Для расчета по формуле (2.2) запишем уравнение горения уксусной кислоты в кислороде:
СН3СООН+2О2=2СО2+2Н2О;
QH=(2∙396,9+2∙242,2-1∙485,6)=792,6 кДж/моль=792,6∙103 кДж/моль;
Для расчета количества тепла, выделяющегося при горении 1кг горючего, необходимо полученную величину разделить на его молекулярную масса (64):
QH=792,6∙103/64=12384кДж/кг.
Пример №2
Рассчитать низшую теплоту сгорания органической массы состава:
С-62%, Н-8%, О-28%, S-2%.
Решение: По формуле Д.И.Менделеева (2.3)
QH=339,4∙62+1257∙8-108,9(28-2)-25,1∙9∙8=26460кДж/кг.
Пример №3
Определить низшую теплоту сгорания газовой смеси, состоящей из
СН4-40%, С4Н10-20%, О2-15%, Н2S-5%, NH3-10%, CO2-10%
Решение: Для каждого горючего компонента смеси по формуле (2.2) находим теплоты сгорания (табл.2.2)
Таблица 2.2.
| Уравнение реакции | Теплота образования горючего, 103 кДж/моль; | Теплота сгорания, 10-3 кДж/моль; |
| СН4+2О2=СО2+2Н2О | 333,5 | QH=1∙396,9+2∙242,2-333,5=547,8 |
| C4H10+5,6O2=4CO2+5H2O | 132,4 | QH=4∙396,9+5∙242,2-132,5=2666,1 |
| H2S+1,5O2=H2O+SO2 | 201,1 | QH=242,2+297,5=201,1=338,6 |
| NH3+0,75O2=1,4H2O+0,5N2 | 46,1 | QH=1,5∙242,2-46,1=317,2 |
По формуле (2.4) определим теплоту сгорания газовой смеси:
QH=1/100∙(547.8∙40+2666,1∙20+338,6∙5+317,2∙10)103=1020∙103 кДж/кг.
Для определения теплоты сгорания 1м3газовой смеси необходимо полученное значение разделить на объем, занимаемый 1 Кмолем газа при стандартных условиях(24,4м3):
QH=1020∙10 3/24,4=41803 кДж/кг.
Пример №4
Рассчитать теплоту сгорания 1м3 стехиометрической гексано - воздушной смеси.
Решение: Находим стехиометрический состав горючей смеси по уравнению реакции горения:
C6H14+9,5O2+9,5∙3,76N2=6CO2+7H2O=9,5∙3,76N
Весь объем вступивших в реакцию компонентов(1+9,5+9,5∙3,76) принимаем за 100%,а количество горючего (1кмоль) будет соответствовать стехиометрической концентрации:
Φст= 
Теплоту сгорания 1м3 гексана определим по формуле (2.2) или по табл. Приложения3.
QH=  103=170,1
103=170,1  103 кДж/м3
103 кДж/м3
Теплоту сгорания 1м3стехиометрической гексано- воздушной смеси определим по формуле (2.5.):
QH см=170,1∙103∙2,2/100=3742 кДж/м3
Пример №5
Определить интенсивность тепловыделения на пожаре органической массы (состав в примере 2), если скорость выгорания 0,015кг/(м2/с), а площадь пожара 150м2.
Решение: согласно формуле (2.7): QH=26460,0∙0,15∙150=59,5∙103кВт
Контрольные задачи
1. Определить низшую теплоту сгорания 1м3этана, пропана, пентана, гексана. Построить график зависимости от молекулярной массы горючего. Теплоты образования горючих веществ: этан-88,4кДж/моль, пропан-109,4 кДж/моль,бутан-132,4 кДж/моль,пентан-184,4 кДж/моль,гексан-211,2 кДж/моль.
2. Рассчитать теплоту сгорания 1м3ацетилено-воздушной смеси на нижнем и верхнем концентрационных пределах воспламенения, а так же при стехиометрической концентрации. КПВ ацетилена равна 2,0+81% Примечание: Построить график зависимости низшей теплоты сгорания от концентрации горючего в воздухе. При расчете теплоты сгорания смеси на ВКПВ необходимо учесть , что только часть горючего способна полностью окислиться в воздухе, остальное количество горючего не вступит в реакцию горения, вследствие недостатка окислителя.
3. Определить низшую теплоту сгорания 2кг древесины состава: С-49%, Н-8%, О-43%. Какова удельная интенсивность тепловыделения на пожаре, если массовая скорость выгорания составляет 0,01кг/(м2/с)?
4. Для условия предыдущей задачи определить изменения теплоты и удельной интенсивности тепловыделения при содержании влаги в древесине(сверх 100%)в количестве 3,5,10,15%. Скорость выгорания влажной древесины соответственно снизиться до 0,009; 0,008; 0,006; 0,005 кг/(м2/с). Построить график зависимости QH,q
от содержания влаги в горючем материале. Примечание: для решения задачи необходимо пересчитать состав древесины с учетом влаги таким образом, чтобы содержание всех компонентов равнялось100%.
5. Определить интенсивность тепловыделения кВт, при горении газовой смеси состава: СО-15%, С4Н8-40%, О2-20%, Н2-14%, СО2-11%., если скорость истечения 0,8м3/с.
Практическая работа №4
Тема: «Расчет температуры горения»
Цель работы: Изучить вещества с различной температурой горения. Уметь применять уравнение теплового баланса для определения температуры горения различных веществ.
Температура горения определяется из уравнения я теплового баланса:
QH=  рi∙Vпri(Tr-To) (2.8)
рi∙Vпri(Tr-To) (2.8)
При этом адиабатическая температура горения:
Тr*=Та + QH/  рi ∙Vпri+CpB ∆VB ; (2.9)
рi ∙Vпri+CpB ∆VB ; (2.9)
А действительная температура горения:
Тr=Та+ Qпr/  pi∙Vпri+ CpB ∆VB ;
pi∙Vпri+ CpB ∆VB ;
где, Тr* и Тr-соответственно адиабатическая и действительная температуры горения;
Т0-начальная температура;
Сpi , CpB-соответственно теплоемкости воздуха и i-того продукта горения;
Vпri-объем i-го продукта горения;
∆VB -избыток воздуха;
QH-низшая теплота горения вещества;
Qпr-теплота , пошедшая на нагрев продуктов горения. При этом
Qпr= QH(1-𝛈), (2.11)
𝛈-доля теплопотерь в результате излучения энергии, химического и механического недожога.
Расчет температуры горения по формуле (2.9) или (2.10) может быть проведен только методом последовательных приближений, поскольку теплоемкость газов зависит от температуры горения (табл.2.3.)
Таблица 2.3- Теплоемкость газов
| Определяемые параметры | Примечание | |
| 1 | Объем и состав продуктов горения | (§1.2) кмоль, м3 |
| 2 | Низшая теплота горения или количество тепла, пошедшего на нагрев продуктов горения (при наличии тепло потерь) | Qпr QH кДж/моль, кДж/кг |
| 3 | Среднее значение энтальпии продуктов горения | ∆Нср= Qн(пr)/  Vпri (2.12) Vпri (2.12)
|
| 4 | По средней энтальпии с помощью табл.1 ( если ∆Нср выражена к кДж/кмоль) или табл.2 ( если ∆Нср выражена к кДж/м3), ориентируясь на азот( наибольшее содержание в продуктах горения), определяем приближенно температуру горения Т1( табл1.,2) | |
| 5 | Рассчитываем теплосодержание продуктов горения с температурой, равной Т1(табл1,2) | Qпr=  i∙Vi (2.13) i∙Vi (2.13)
|
| 6 | Сравниваем Qпr c Qн(пr), если Qпr < Qн(пr),то задается Т1 >Т2( в этом случае, если если Qпr>Qн(пr),то задается Т1 <Т2) | ∆Нi –энтальпия итого продукта горения Vi-объем итого продукта горения |
| 7 | Рассчитываем Qпr по формуле (2.13) | |
| 8 | Расчет проводим до получения неравенства вида Q 1пr < Qн(пr),< Qн 2(пr), | |
| 9 | Интерполяцией определяем температуру горения | Тr=Т1+  ..(2.14) ..(2.14)
|
Действительная температура горения на пожаре для большинства газообразных, жидких и твердых веществ изменяется в достаточно узких пределах (1300+1800К).
В связи с этим расчет действительной температуры горения может быть значительно упрощен, если теплоемкость продуктов горения выбирать при температуре 1500К:
Тr=Т0+  ; (2.15)
; (2.15)
где 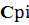 - теплоемкость i-го продукта горения при 1500К (табл.2.4
- теплоемкость i-го продукта горения при 1500К (табл.2.4
Таблица 2.4.
| Вещество | Теплоемкость | |
| кДж/(м3∙К) | кДж/(моль∙К) | |
| Двуокись углерода | 2.27 | 50,85∙10-3 |
| Двуокись серы | 2,28 | 51,07∙10-3 |
| Вода (пар) | 1,78 | 39,87∙10-3 |
| Азот | 1,42 | 31,81∙10-3 |
| Воздух | 1,44 | 32,26∙10-3 |
Примеры решения задач
Пример №1
Определить адиабатическую температуру горения этилового спирта в воздухе.
Решение: Расчет проводим по схеме, приведенной в табл. 2.3.
1. Так как горючее индивидуальное, для определения объема и состава продуктов горения запишем уравнение химической реакции горения:
С2Н5ОН+3О2+3∙3,76N2=2СО2+3Н2О+3∙3,76N2,
следовательно, продукты горения состоят из:
Vco2=3 моля, VН2О=3 моля, VN2=11,28моля, VПr=17,28 моля.
2. Низшую теплоту сгорания определим по формуле (2.2) Из табл.3приложениянаходим теплоту образования горючего- 278,2кДж/моль: Qн=3∙396,9+3∙242,2-278,2=1639,1 кДж/моль;
3. Средняя энтальпия продуктов горения:
∆Н ср = 
4. Так как ∆Н ср выражена в кДж/моль, по табл.1приложения выбираем, ориентируясь на азот, первую приближенную температуру горения Т1=25000С
5. Рассчитаем теплосодержание продуктов горения при 25000С по формуле (2.13):
Q 1пr=139,9∙3+115,1∙3+85,1∙11,28=1687,2 кДж/моль;
Сравниваем Qн и Qпr,так как Qпr> Qн выбираем температуру горения равной 24000С.
6. Рассчитываем теплосодержание продуктов горения при температуре равной 24000С:
Q 2пr=133,0∙3+109,6∙3+81,5∙11,28=1646,7 кДж/моль; так как Q2 пr> Qн, принимаем температуру равной 23000С
Q 3пr=126,9∙3+104,1∙3+77,8∙11,28=1570,6 кДж/моль.
7. Так как Q3 пr< Qн<Q2 пr определим температуру горения:
Тr *=2300+  0C
0C
Пример №2
Определить адиабатическую температуру горения органической массы, состоящей из: С-60%, Н-7%, О-25%, W-8%.
Решение:
1. Так как горючее представляет собой сложное вещество, состав продуктов горения рассчитываем по формулам(1.16 и 1.19):
Vco2=1.86∙60/100+1,12 м3/кг;
VН2О=11,2 ∙7/100+1,24∙8/100=0,88 м3/кг;
VN2=1/100∙7∙60+21(7-25/8)=5,01 м3/кг
2. Общий объем продуктов горения равен: VПr=7,01 м3/кг.
3. Определим низшую теплоту сгорания вещества по формуле Д.И.Менделеева (2.3):
Qн=339,4∙60+1157∙7-108,9∙25-25,1(9∙7+8)=23958,4 кДж/кг;
4. Определим среднюю энтальпию продуктов горения:
∆Н ср =23958,4/7,01=3417,7кДж/м3
5. Так как величина энтальпии рассчитана в кДж/м3. первую приближенную температуру выбираем по табл.2 приложения. Ориентируясь на азот, принимаем Т1=21000С
6. Рассчитаем теплосодержание продуктов горения при 21000С по формуле (2.13):
Q пр=5118,2∙1,12+4166,1∙0,88+3142,9∙5,01=25144,5 кДж/кг
7. Из сравнения Qн и Qпr,так как Qн  Qпр выбираем вторую приближенную температуру 19000С. Рассчитываем теплосодержание продуктов горения при 19000С:
Qпр выбираем вторую приближенную температуру 19000С. Рассчитываем теплосодержание продуктов горения при 19000С:
Q 2пr=5118,2∙1,12+3693,5∙0,88+2818,2∙5,01=22498,8 кДж/кг
8. Так как Q2 пr  Qн<Q1 пr определим температуру горения:
Qн<Q1 пr определим температуру горения:
Тr *=1900+  =20100С
=20100С
Пример №3
Рассчитать действительную температуру горения фенола (∆Нобр=4,2 кДж/моль), если потери тепла излучением составили 25%от Qн, а коэффициент избытка воздуха при горении-2,2
Решение:
1. Определим состав продуктов горения:
С6Н5ОН+7О2+7∙3,76N2;
V co2 =6 моль,
VН 2О=3 моля,
VN2=26,32моля,
∆Vв=(7+7∙3,76)(2,2-1)=39,98моля,
VПr=75,3моля.
2. Определим низшую теплоту сгорания фенола (формула2.2):
Qн=7∙396,9+3∙242,2-1∙4,2=3500,7 кДж/моль;
3. Так как по условию задачи 25% тепла теряется, то определим количество тепла , пошедшее на нагрев продуктов горения (теплосодержание продуктов горения при температуре горения)(формула 2.11.):
Q пr=33500,7(1-0,25)=2625,5 кДж/моль
4. По формуле (2.15)определим действительную температуру горения:
Тr=273+2625,5/10-3∙(50,85∙6+39,87∙3+31,81∙26,32+32,26∙39,98) =1302К.
Контрольные задачи
5. Определить как изменяется адиабатическая температура горения в гомологическом ряду предельных углеводородов (на примере метана, пропана, пентана, гептана). Построить график зависимости температуры горения от молекулярной массы горючего вещества.
6. Определить, как изменится адиабатическая температура горения древесины состава: С-49%, Н-8%, О-43%, если содержание влаги (сверх100%) составляет 0% ; 5%; 15%. Построить график зависимости температуры горения от влажности горючего
Примечание : при решении задачи необходимо состав древесины пересчитать так , чтобы количество всех компонентов ( в том числе воды) составляло 100%.
7. Определить: как измениться адиабатическая температура горения бензола в воздухе и окислительной среде, содержащей 25;30;40% кислорода. Построить график зависимости температуры горения от содержания кислорода.
8. Рассчитать действительную температуру горения газовой смеси, состоящей из 45%Н2; 30%С3Н8;15% О2; 10% N2, если потери тепла составили 30% от Qн, а коэффициент избытка воздуха при горении равен 1,8.
9. Определить количество сгоревшего антрацита (С=100%) в помещении объемом 180м3, если среднеобъемная температура возросла с 305 до 625К.
10. Рассчитать действительную температуру горения бутано- воздушной смеси стехиометрической концентрации и на нижнем концентрационном пределе воспламенения (1,9% бутана и 98,1% воздуха), если потери тепла излучением составили 20% от низшей теплоты сгорания.
11. Определить как измениться температура горения ацетилена при разбавлении его азотом в количестве 10; 20; 30%, если потери тепла излучением составляют 25% от низшей теплоты сгорания. Коэффициент избытка воздуха-1.2. Построить график зависимости температуры горения от содержания азота в ацетилене.
12. Определить время горения толуола, при котором температура в помещении объемом 400м3повыситься с 295 до 375К, если скорость его выгорания 0,015кг/(м2с), а площадь пожара 50 м3. При расчете пренебречь приращением объема продуктов горения над расходуемым воздухом.
Домашнее задание
Рассчитать температуру горения i-го вещества (табл. 2.4)
Таблица 2.4-Данные для выполнения д/з.
| № вари анта | Горючее вещество | Химическая формула | Состав окислит среды | Условия горения |
| 1. | СО-40%;С3Н8-50%; СО2-10% | воздух | ℒ=1,4
 =0,52 =0,52
| |
| 2. | С-80%; Н-5%; S-6%, W-9% | воздух | ℒ=1,6
 =0,3 =0,3
| |
| 3. | Пропионовая кислота | С3Н6О2 | Кислород25% Азот75% | ℒ=1,3
 =0,4 =0,4
|
| 4. | Глицерин | С3Н8О3 | Воздух | ℒ=1,0
 =0,35 =0,35
|
| 5. | Уксуснобутиловый эфир | С6Н12О2 | Воздух | ℒ=1,4
 =0,15 =0,15
|
| 6. | Этилбензол | С8Н10 | Воздух | ℒ=1,5
 =0,2 =0,2
|
| 7. | С-82%; Н-8%; О-5%; W-5% | Воздух | ℒ=1,0
 =0,35 =0,35
| |
| 8. | СО-60%; Н2-40% | Воздух | ℒ=1,8
 =0,4 =0,4
| |
| 9. | Аммиак | NH3 | Воздух | ℒ=1,0
 =0,2 =0,2
|
| 10. | Гексан | С6Н14 | воздух | ℒ=1,4
 =0.15 =0.15
|
| 11. | Нитроэтан | С2Н5NO2 | Воздух | ℒ=1,5
 =0,2 =0,2
|
| 12. | Гексиловый спирт | С6Н14O | Воздух | ℒ=2,0
 =0,1 =0,1
|
| 13. | С-80%; Н-12% S-3% N-5% | Воздух | ℒ=1,6
 =0,25 =0,25
| |
| 14. | C75% H-8% O-12% W-5% | Воздух | ℒ=1.0
 =0,4 =0,4
| |
| 15. | CH4-70% NH3-20% O2-10% | ℒ=1,8
 =0,2 =0,2
| ||
| 16. | Муравьиная кислота | СН2О2 | Воздух | ℒ=2,2
 =0,3 =0,3
|
| 17. | C-56% H-14% O-20% W-10% | Воздух | ℒ=1,0
 =0,4 =0,4
| |
| 18. | C78% H-12% O-10% | Воздух | ℒ=1,6
 =0,15 =0,15
| |
| 19. | СО-75% СН4-25% | Воздух | ℒ=1,9
 =0,2 =0,2
| |
| 20. | С3Н8-70% С4Н10-20% О2-10% | Воздух | ℒ=1,8
 =0,2 =0,2
| |
| 21. | C85% H-10% O-5% | Воздух | ℒ=1,4
 =0,3 =0,3
| |
| 22. | Амиловый спирт | С5Н12О | Воздух | ℒ=1,7
 =0,22 =0,22
|
| 23. | СО-40%;С3Н8-50%; СО2-10% | воздух | ℒ=1,4
 =0,52 =0,52
| |
| 24. | С-80%; Н-5%; S-6%, W-9% | воздух | ℒ=1,6
 =0,3 =0,3
| |
| 25. | Пропионовая кислота | С3Н6О2 | Кислород25% Азот75% | ℒ=1,3
 =0,4 =0,4
|
| 26. | Глицерин | С3Н8О3 | Воздух | ℒ=1,0
 =0,35 =0,35
|
| 27. | Уксуснобутиловый эфир | С6Н12О2 | Воздух | ℒ=1,4
 =0,15 =0,15
|
| 28. | Этилбензол | С8Н10 | Воздух | ℒ=1,5
 =0,2 =0,2
|
| 29. | С-82%; Н-8%; О-5%; W-5% | Воздух | ℒ=1,0
 =0,35 =0,35
| |
| 30. | СО-60%; Н2-40% | Воздух | ℒ=1,8
 =0,4 =0,4
| |
| 31. | Аммиак | NH3 | Воздух | ℒ=1,0
 =0,2 =0,2
|
| 32. | Гексан | С6Н14 | воздух | ℒ=1,4
 =0.15 =0.15
|
| 33. | Нитроэтан | С2Н5NO2 | Воздух | ℒ=1,5
 =0,2 =0,2
|
| 34. | Гексиловый спирт | С6Н14O | Воздух | ℒ=2,0
 =0,1 =0,1
|
| 35. | С-80%; Н-12% S-3% N-5% | Воздух | ℒ=1,6
 =0,25 =0,25
| |
| 36. | C75% H-8% O-12% W-5% | Воздух | ℒ=1.0
 =0,4 =0,4
| |
| 37. | CH4-70% NH3-20% O2-10% | ℒ=1,8
 =0,2 =0,2
| ||
| 38. | Муравьиная кислота | СН2О2 | Воздух | ℒ=2,2
 =0,3 =0,3
|
| 39. | C-56% H-14% O-20% W-10% | Воздух | ℒ=1,0
 =0,4 =0,4
| |
| 40. | C78% H-12% O-10% | Воздух | ℒ=1,6
 =0,15 =0,15
| |
| 41. | СО-75% СН4-25% | Воздух | ℒ=1,9
 =0,2 =0,2
| |
| 42. | С3Н8-70% С4Н10-20% О2-10% | Воздух | ℒ=1,8
 =0,2 =0,2
| |
| 43. | C85% H-10% O-5% | Воздух | ℒ=1,4
 =0,3 =0,3
| |
| 44. | Амиловый спирт | С5Н12О | Воздух | ℒ=1,7
 =0,22 =0,22
|
Дата добавления: 2018-02-15; просмотров: 4842; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
