Статическая обработка данных пассивного эксперимента. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «ЛИПЕЦКИЙ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «ЛИПЕЦКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» Кафедра металлургических технологий
МАТЕМАТИЧЕСКАЯ ОБРАБОТКА РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к практическим работам по курсу
«Основы научных исследований»
А.В. Карпов
Липецк
Липецкий государственный технический университет
2016
УДК 519.254 (07)
К265
РецензентА.Н. Роготовский, канд. техн. наук, доц.
А.В. Карпов
К265 Математическая обработка результатов экспериментов[Текст]: методические указания к практическим работам по курсу «Основы научных исследований» / А.В. Карпов. – Липецк: Изд-во Липецкий государственный технический университет, 2016. – 23 с.
Рассмотрен способ расчета константы равновесия химических реакций. Приведены основные методы обработки статистических данных при помощи расчета парной корреляционной связи и множественного линейного регрессионного анализа. Уделено внимание методам планирования экспериментов.
Предназначены для студентов 2 курса металлургического института, направления 22.03.02 «Металлургия», изучающих дисциплину «Основы научных исследований»
Табл. 3. Библиогр. :8 назв.
©ФГБОУ ВО «Липецкий
государственный технический
|
|
|
университет», 2016
Содержание
| 1. | Расчет константы равновесия химических реакций ……………………... | 4 |
| 2. | Статическая обработка данных пассивного эксперимента. Парная | |
| корреляционная связь ……………………………………………………….... | 8 | |
| 3. | Статическая обработка данных пассивного эксперимента. Множест- | |
| венный линейный регрессионный анализ …………………………………... | 11 | |
| 4. | Методы планирования эксперимента. Планы первого порядка ………... | 13 |
| Библиографический список ……………………………………………….. | 16 | |
| Приложения ……………………………………………………………….... | 17 | |
Расчет константы равновесия химических реакций
Равновесные соотношения указывают на пути протекания реакций, выявляют условия, термодинамически благоприятные для практической их реализации.
Подавляющее число процессов химических реакцийметаллургического передела протекают при постоянном или мало меняющемся давлении. В этом случае равновесие характеризуется энергией Гиббса. Энергия Гиббса – это часть внутренней энергии системы, которая может быть превращена в работу. Если исходные реагенты находятся в стандартном состоянии, т.е. их активности равны 1, изменение энергии Гиббса рассчитывается по уравнению (изотерма Вант-Гоффа):
|
|
|
 (1.1)
(1.1)
где 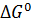 – стандартное изменение энергии Гиббса,
– стандартное изменение энергии Гиббса,  – универсальная газовая постоянная,
– универсальная газовая постоянная,  – температура,
– температура,  – константа равновесия, выраженная через равновесные активности.
– константа равновесия, выраженная через равновесные активности.
Величина 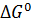 связана со стандартным изменением энтальпии
связана со стандартным изменением энтальпии  и энтропии
и энтропии  соотношением:
соотношением:
 , (1.2)
, (1.2)
По данному уравнению рассчитывается равновесие химических реакций и производится экспериментальное определение термодинамических свойств веществ.
Для газов за стандартное принято состояние вещества в виде идеального газа при давлении 0,1013 МПа(≈0,1 МПа,1 ат)и температуре 298 К. Для такого состояния в термодинамических таблицах имеются справочные данные о стандартном изменении  и абсолютной энергии
и абсолютной энергии  .
.
Если в стандартном состоянии вещества находятся в жидком или твердом состоянии, термодинамические данные соответствуют их фиктивному состоянию в виде идеального газа.
Если в реакциях присутствуют простые вещества, то для них  при всех температурах равны 0, но необходимо учитывать их абсолютную энтальпию.
при всех температурах равны 0, но необходимо учитывать их абсолютную энтальпию.
Входящие в уравнение (1.1) активности идеального газа соответствуют их парциальным давлениям. Поэтому для реакции
|
|
|

Константа равновесия (  ) определяется через парциальные давления (
) определяется через парциальные давления (  )
)

Тогда
 (1.3)
(1.3)
Для определения  реакций по уравнению (1.3) необходимо рассчитать по формуле (1.2) величину
реакций по уравнению (1.3) необходимо рассчитать по формуле (1.2) величину  . Для этого рассчитывают по табличным данным для стандартных условий изменение энтальпии
. Для этого рассчитывают по табличным данным для стандартных условий изменение энтальпии 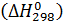 и энтропии
и энтропии  как сумму для продуктов и исходных компонентов с учетом величины и знака стехиометрических коэффициентов:
как сумму для продуктов и исходных компонентов с учетом величины и знака стехиометрических коэффициентов:


Стехиометрические коэффициенты продуктов реакций берутся со знаком плюс (+), а исходных веществ – минус (-).
Тогда имеем:
 (1.4)
(1.4)
Или после преобразования:

Тогда
 (1.5)
(1.5)
По уравнению (1.5) можно предсказать температуру, при которой величина  будет достаточно большой, а по уравнению (1.4) – приблизительно температуру начала реакции, решив его относительно
будет достаточно большой, а по уравнению (1.4) – приблизительно температуру начала реакции, решив его относительно  при условии, что
при условии, что
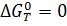 . Необходимо иметь в виду, что реакция протекает слева направо, если изменение энергии Гиббса имеет отрицательное значение.
. Необходимо иметь в виду, что реакция протекает слева направо, если изменение энергии Гиббса имеет отрицательное значение.
Выполненные по данной методике расчеты являются приблизительными, так как значения величин энтальпии и энтропии зависят не только от температуры, но и от теплоемкости, а последняя является функцией температуры, т.е.
|
|
|


Расчет термодинамических показателей реакции с учетом влияния температуры на изменение теплоемкости реагирующих веществ производится по методу Темкина-Шварцмана. Он основан на зависимости теплоемкости от температуры по уравнению
 (1.6)
(1.6)
Коэффициенты уравнения определяются экспериментально. Причем достаточно первых трех членов уравнения (1.6),тогда:

Уравнение Темкина-Шварцмана для расчета  имеет вид
имеет вид

где  – суммы коэффициентов уравнений теплоемкости для реагентов и продуктов реакции.
– суммы коэффициентов уравнений теплоемкости для реагентов и продуктов реакции.
Значения  берутся также из справочных данных термодинамических таблиц. При суммировании значений
берутся также из справочных данных термодинамических таблиц. При суммировании значений  их величины умножаются на стехиометрические коэффициенты. При этом продукты реакции берутся со знаком плюс
их величины умножаются на стехиометрические коэффициенты. При этом продукты реакции берутся со знаком плюс  , а исходные реагенты – минус (-).
, а исходные реагенты – минус (-).  – интегралы Темкина-Шварцмана, зависят только от температуры. Их значения приведены в справочной литературе.
– интегралы Темкина-Шварцмана, зависят только от температуры. Их значения приведены в справочной литературе.
Если давления при проведении реакции возрастают, или их состояние близко к насыщенному пару, газы перестают быть идеальными и константу равновесия необходимо определять через активности. Поэтому константа равновесия для реальных газов рассчитывается по следующей методике. Введено понятие летучести  . Отношение летучести к парциальному давлению называется коэффициентом летучести
. Отношение летучести к парциальному давлению называется коэффициентом летучести 

При давлении 1 ат

Тогда

Из данного уравнения получаем


где 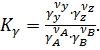 (1.7)
(1.7)
Коэффициенты летучести для реагирующих веществ определяют исходя из приведенной температуры  и приведенного давления
и приведенного давления  . Для водорода
. Для водорода  и
и  . Значения
. Значения 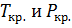 принимают по справочным данным. Для каждого вещества находят значения
принимают по справочным данным. Для каждого вещества находят значения  по табличным данным, т.е.
по табличным данным, т.е.

В приложениях приведены термодинамические характеристики некоторых веществ:
- в приложении 1 -  ;
;
- в приложении 2 – интегралы Темкина-Шварцмана;
- в приложении 4 и 5 - 
Алгоритм расчета константы равновесия для реальных газовых смесей:
1. Рассчитывается  , используя данные прил. 1;
, используя данные прил. 1;
2. Рассчитывается  по методу Темкина-Шварцмана. Значения интегралов
по методу Темкина-Шварцмана. Значения интегралов  берутся из прил. 2, константы
берутся из прил. 2, константы  – в уравнении теплоемкости из прил. 1;
– в уравнении теплоемкости из прил. 1;
3. Определяется  из уравнения:
из уравнения:  ;
;
4. Для каждого реагента рассчитывается приведенная температура  и приведенное давление
и приведенное давление  . Значения
. Значения 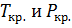 берутся из прил.1. По величинам
берутся из прил.1. По величинам  по данным прил.4 и 5 определяются коэффициенты летучести
по данным прил.4 и 5 определяются коэффициенты летучести  для реагирующих веществ;
для реагирующих веществ;
5. По формуле (1.7) рассчитывается  ;
;
6. Определяется для данной реакции реальная константа равновесия при заданной температуре и давлении:  .
.
Задача 1.Рассчитать константу равновесия по методу Темкина-Шварцмана. Уравнение реакции, давление и температура ее протекания приведены в приложении 3.
Статическая обработка данных пассивного эксперимента.
Парная корреляционная связь
Анализ результатов наблюдений статистическими методами позволяет построить математическую модель процесса в рассматриваемом интервале изменения параметров.
В ходе опытов параметры процесса подвержены воздействию неконтролируемых факторов, что приводит к разбросу в значениях наблюдаемых величин. Разброс значений случайной величины характеризуется ее дисперсией и среднеквадратическим отклонением.
Дисперсия определяется по уравнению
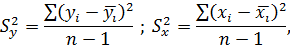
где  - наблюдаемая величина, результат
- наблюдаемая величина, результат  -го наблюдения, среднеарифметическое всех наблюдений величины;
-го наблюдения, среднеарифметическое всех наблюдений величины;
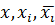 – фактор, его текущее значение и среднеарифметическая величина;
– фактор, его текущее значение и среднеарифметическая величина;
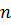 – число наблюдений.
– число наблюдений.
Среднеквадратическое отклонение рассчитывается по формуле

По смыслу среднеарифметическое отклонение отвечает абсолютной ошиб-ке.
Для количественной оценки тесноты линейной связи между величинами рассчитывается коэффициент парной корреляции  , а также уравнение регрессии и доверительные интервалы. Расчет производится по формуле:
, а также уравнение регрессии и доверительные интервалы. Расчет производится по формуле:

где  – величины, между которыми устанавливается связь;
– величины, между которыми устанавливается связь;
 – показатели
– показатели  -го опыта, их среднеарифметические значения, среднеквадратические отклонения.
-го опыта, их среднеарифметические значения, среднеквадратические отклонения.
Если 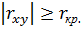 , с вероятностью
, с вероятностью  , где
, где  – уровень значимости, можно утверждать, что между величинами
– уровень значимости, можно утверждать, что между величинами 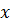 и
и  существует линейная зависимость.
существует линейная зависимость.
Если  , то прямолинейная связь между
, то прямолинейная связь между  и
и 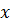 отсутствует и зависимость не описывается исходным уравнением.
отсутствует и зависимость не описывается исходным уравнением.
Если линейная связь подтверждена, то она аппроксимируется уравнением регрессии вида

где 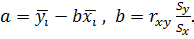
Когда исходное уравнение является частным случаем, т.е. значение свободного члена (  равняется нулю, то в этом случае константу
равняется нулю, то в этом случае константу  можно рассчитывать по упрощенной формуле метода наименьших квадратов (МНК)
можно рассчитывать по упрощенной формуле метода наименьших квадратов (МНК)

Доверительные интервалы контактов  и
и  рассчитывают по уравнениям:
рассчитывают по уравнениям:


где  ;
;
 – значение зависимой величины, полученное из уравнения регрессии;
– значение зависимой величины, полученное из уравнения регрессии;
 – критерий Стьюдента при уровне значимости
– критерий Стьюдента при уровне значимости  и степени свободы
и степени свободы  .
.
Адекватность математической модели оценивается сравнением расчетного значения коэффициента парной корреляции с критическим. При этом уровень значимости не должен быть ниже 5% (вероятность 95% и более).
Также рассчитывают коэффициент вариации  ,он служит для сравнения величин рассеяния двух вариационных рядов
,он служит для сравнения величин рассеяния двух вариационных рядов

По смыслу коэффициент вариации отвечает относительной ошибке эксперимента.
Для оценки тесноты нелинейной связи между  используется корреляционное отношение
используется корреляционное отношение

где  – остаточная дисперсия;
– остаточная дисперсия;  – количество коэффициентов в нелинейной регрессии.
– количество коэффициентов в нелинейной регрессии.
Остаточная дисперсия характеризует рассеяние наблюдений относительно полученного уравнения регрессии
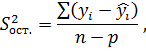
где  – значение величины, полученное из уравнения регрессии.
– значение величины, полученное из уравнения регрессии.
Очевидно, что 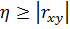 .
.
Чем ближе корреляционное отношение к коэффициенту парной корреляции, тем более линейной является связь между зависимой  и независимой
и независимой  величинами.
величинами.
В случае нелинейной связи между величинами форма ее устанавливается методом наименьших квадратов в виде полинома

Алгоритм метода наименьших квадратов основан на поиске уравнения, минимизирующего выражение

Задание 2. Рассчитать коэффициент парной корреляциирежима работы и показателей работы доменной печи, оценить его значение, вывести уравнение регрессии, определить доверительные интервалы констант.
Матрица заданий приведена в табл. 1, исходные данные к заданиям– прил.6, критические значения коэффициента парной корреляции – прил. 7, значения критерия Стьюдента – прил.8.
Дата добавления: 2018-02-15; просмотров: 496; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
