Основные понятия термодинамики
Первоначально термодинамика возникла как наука о закономерностях превращения тепла в работу при помощи тепловых двигателей. Круг вопросов, которые изучает термодинамика, связан с тепловой формой движения материи, т.е. с хаотическим движением атомов и молекул. Термодинамика основывается на нескольких законах (или началах), которые получены путем обобщения огромного числа опытных фактов, касающихся макроскопических свойств вещества.
Основным объектом внимания термодинамики является термодинамическая система, т.е. любая совокупность физических тел. Состояние этой системы описывается с помощью ограниченного числа макроскопических величин или физических параметров. К ним относятся давление р, температура Т, объем V.
Для разных частей системы параметры могут принимать, вообще говоря, различные значения: так температуры в различных местах выбранного объема газа могут отличаться друг от друга. В этом случае говорят, что температура является неравновеснымпараметром. Если же параметры системы одинаковы для различных ее частей и сохраняются неизменными длительное время, то такое состояние системы называется равновесным.Строго говоря, термодинамика обязана рассматривать только равновесные состояния, т.к. в противном случае макроскопические значения параметров теряют свой смысл.
В то же время термодинамику интересуют процессы передачи теплоты и совершение механической работы, т.е. для нее важны изменения в выбранной системе или переход из одного состояния в другое, т.е. процессы, протекающие в системе. Для удовлетворения этих противоречивых требований используется два приема: во-первых, любое изменение состояния рассматривается как квазиравновесное, т.е. состоящее из ряда последовательных равновесных состояний, причем параметры двух близких состояний отличаются друг от друга на бесконечно малую величину; во-вторых, термодинамика широко использует понятие функции состояния, т.к. знание самой функции и ее значения в некоторый начальный момент времени позволяют предсказать состояние системы в любой последующий момент времени безотносительно к условиям перехода из начального положения системы в конечное.
|
|
|
Внутренняя энергия U системы молекул складывается из энергии хаотического движения молекул (поступательного и вращательного), а также колебательного движения атомов в молекулах, потенциальной энергии, обусловленной взаимодействием молекул.
Для идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется только кинетической энергией движения всех его молекул.
|
|
|
Внутренняя энергия идеального газа есть сумма энергий движения всех молекул
U =  = N <e > = n NA <e > =
= N <e > = n NA <e > =  NA <e >, (4.1)
NA <e >, (4.1)
где N – число молекул в газе, NA – число Авогадро, n - число молей газа, m –масса газа, M – молярная масса газа.
Тогда
U = 
 k NA T =
k NA T = 
 R T. (4.2)
R T. (4.2)
Изменение внутренней энергии идеального газа
dU = 
 R dT ,
R dT ,
где dT - изменение температуры газа,
или
DU =  =
= 
 R DT. (4.3)
R DT. (4.3)
Изменить состояние тела можно передавая энергию от одного тела термодинамической системы к другому. Передача энергии может происходить двумя качественно различными способами: путем совершения работы А или путем передачи теплоты Q.
Работа - есть мера изменения механической энергии при силовом воздействии между телами. Совершение работы всегда сопровождается перемещением тела или его макроскопических частей.
Энергия, переданная от одного тела к другому путем теплообмена, называется теплотой, отданной одним телом другому.
Элементарная работа dA, совершающаяся при расширении газа на dV, рассчитывается по формуле
dA = p dV , (4.4)
а работа, совершающаяся при расширении газа от V1 до V2 , по формуле
|
|
|
А =  p dV , (4.5)
p dV , (4.5)
где р - давление, которое производится на газ внешними силами (внешнее давление); V1 , V2 - начальный и конечный объем газа.
Теплоемкости идеальных газов
Для определения количества теплотыdQ, переданного термодинамической системе для изменения ее температуры, введем понятия теплоемкостей. В зависимости от способа измерения количества вещества в системе подразделяют удельную теплоемкость, молярную теплоемкость и теплоемкость.
Удельной теплоемкостью называется физическая величина с, численно равная теплоте dQ, которую сообщают единице массы однородного тела для повышения его температуры на dT.
c = 
 . (4.6)
. (4.6)
Молярной теплоемкостью называется физическая величина С, численно равная теплоте dQ, сообщенной одному молю вещества для изменения его температуры на dT.
C = 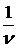
 . (4.7)
. (4.7)
где n = 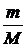 - число молей.
- число молей.
Очевидно, что С = M c .
Теплоемкостью тела (системы) называется физическая величина, численно равная теплоте dQ, которую сообщают всему телу (системе) для повышения его температуры на dT,
С=  . (4.8)
. (4.8)
|
|
|
Tогда С = c m и С= С n .
Первое начало термодинамики
Существование двух способов передачи энергии термодинамической системе позволяет закон сохранения энергии представить в виде
DU = A' + Q , (4.9)
где DU - изменение внутренней энергии, A' - работа, совершенная над системой внешними силами, Q - переданная системе теплота,
или
Q = DU + A , (4.10)
где А = – A’ - работа, совершаемая самой системой против внешних сил.
Отсюда вытекает следующая формулировка первого начала термодинамики: теплота, переданная системе в процессе изменения ее состояния, расходуется на изменение ее внутренней энергии и на совершение работы против внешних сил.
Первое начало термодинамики записывают также для изменения состояния системы, вызванного сообщением ей малой теплоты dQ, совершением ей малой (элементарной) работы dA и приводящего к малому изменению внутренней энергии dU
dQ = dU + dA . (4.11)
Обратим внимание на различие в записях малых величин (dQ, dU, dA).
Внутренняя энергия является однозначной функцией состояния термодинамической системы, т.е. значение внутренней энергии в каком-либо произвольно выбранном состоянии не зависит от способа перевода ее в это состояние. Изменение внутренней энергии dU представляет собой полный дифференциал. Работа и теплота не являются функциями состояния и поэтому dQ, dA не являются полными дифференциалами.
Дата добавления: 2018-02-15; просмотров: 382; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
