Молекулярно-кинетическая теория газов
ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
Введение
Настоящая часть курса посвящена молекулярной физике и основам теории теплоты - термодинамике. Молекулярная физика изучает те свойства вещества, которые обусловлены его молекулярным строением.В ней рассматриваются превращения, вещества, связанные с изменением энергии его молекул, изменения агрегатного состояния тел и т. д.
При изложении основных идей современной молекулярно-кинетической теории вещества и общих закономерностей тепловых явлений будем исходить из трех основных положений.
1. Все тела состоят из мельчайших частиц - атомов и молекул.
2. Атомы и молекулы находятся в состоянии непрерывного движения. Движение это является вечным, не прекращаясь ни при каких условиях.
3. Молекулы различных веществ по-разному взаимодействуют между собой. Взаимодействие это существенно зависит от типа молекул и от расстояний между ними. В частности, зависимостью молекулярных сил от межмолекулярных расстояний объясняется качественное различие разных агрегатных состояний тел (газ, жидкость, твердое тело).
Различают два вида движения: движение тела как целого и хаотическое тепловое движение молекул тела, происходящее независимо от того, движется ли тело как целое или нет.
Тепловое движение будем характеризовать средней кинетической энергией одной молекулы εкин, а взаимодействие между молекулами - потенциальной энергией взаимодействия uпот.
|
|
|
В твердых телах молекулы расположены близко друг к другу, и поэтому свойства этих тел существенно зависят от величины uпот.
Плотность газов при обычных давлениях и температурах в тысячи раз меньше плотности твердых и жидких тел. Это свидетельствует о том, что в газе средние расстояния между молекулами примерно в 10 раз больше, чем в конденсированных телах. При таких расстояниях между молекулами можно ожидать, что их взаимодействие будет играть очень малую роль, т.е. средняя кинетическая энергия молекул εкин будет значительно больше абсолютного значения средней потенциальной энергии |uпот|.
При достаточно больших расстояниях между молекулами газа, т.е. в случае достаточно разреженных газов, энергией межмолекулярного взаимодействия uпот можно вообще пренебрегать., т.е. физические свойства достаточно разреженных газов не должны зависеть от их химической природы. Конечно, здесь имеются в виду те свойства, которые не зависят от масс молекул, различных для разных веществ.
Движение каждой молекулы тела может быть описано законами классической механики. Однако число молекул во всяком теле чрезвычайно велико, а направление и величина скорости каждой из них в данный момент случайны. Свойства молекул, образующих тело, подчиняются статическим закономерностям и могут быть изучены с помощью статистического метода.
|
|
|
Наряду со статическим методом для изучения физических явлений применяется термодинамический метод.
Термодинамика изучает условия превращения энергии из одного вида в другой и характеризует эти превращения энергии с количественной стороны.
Совокупность рассматриваемых тел, обменивающихся энергией как между собой, так и с другими (внешними) телами, называется термодинамической системой. В основе термодинамического метода исследования лежит понятие о состоянии термодинамической системы. Состояние системы определяется совокупностью значений этих величин, характеризующих физические свойства системы и называемых ее термодинамическими параметрами.
Состояние термодинамической системы называется стационарным,если значения всех термодинамических параметров системы не изменяются во времени. Стационарное состояние системы называется равновесным,если его неизменность во времени не обусловлена протеканием каких-либо процессов во внешних по отношению к системе телах.
|
|
|
Исследования показывают, что для каждого тела термодинамические параметры взаимно связаны. Например, удельное электрическое сопротивление, вязкость и многие другие свойства тела зависят от их температуры. Поэтому оказывается, что равновесное состояние термодинамической системы однозначно определяется заданием значений ограниченного числа ее термодинамических параметров, называемых параметрами состояния.
Важнейшими параметрами состояния химически однородной системы являются: плотность ρ, давление р и температура T'. Между основными параметрами состояния существует связь, наливаемая уравнением состояния:
f(р, ρ, T) = 0.
Зная уравнение состояния вещества и используя законы термодинамики, можно изучать свойства веществ в различных агрегатных состояниях.
Между статистическим и термодинамическим методами существуют глубокие связи. Современная физика развивается на базе тесного сочетания обоих методов.
Рассмотрим некоторые свойства идеальных газов.
Идеальнымназывается газ, между молекулами которого отсутствуют силы взаимного притяжения, при соударениях молекулы газа ведут себя как абсолютно упругие шарики исчезающе малых размеров.
|
|
|
Р.Бойль (1662 г.) и Э.Мариотт (1676 г.) экспериментально установили, что произведение давления газа на занимаемый им объем при постоянной температуре есть величина постоянная:
pV = const при m = const и T = const.
Гей-Люссак (1802 г.) нашел, что объем газа пропорционален его абсолютной температуре(при постоянных m и р), т.е.
 = const при m = const и р = const,
= const при m = const и р = const,
давление также пропорционально абсолютной температуре(при постоянных m и V), т.е.
 = const при m = const и p = const.
= const при m = const и p = const.
Эти законы справедливы для достаточно разреженных газов, т.е. для газов, в которых средние расстояния между молекулами значительно превышают диаметры молекул.
Рассмотрим следующее соотношение (уравнение Клапейрона):
 = const при m = const.
= const при m = const.
Легко видеть, что оно объединяет законы Бойля-Мариотта и Гей-Люссака.
С помощью уравнения Клапейрона можно рассчитывать процессы, при которых меняются все три величины р, V, Т одновременно, а не только какая-либо их пара.
В дальнейшем мы будем это уравнение, связывающее основные величины, характеризующие газ,- р, V и Т, -называть уравнением состояния.
В 1874 г. Д.И.Менделеев получил уравнение состояния для произвольной массы любого газа называемое уравнением Менделеева-Клапейрона.
pV = vRT = 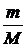 RT,
RT,
где R= 8,31 Дж/К Моль - универсальная газовая постоянная.
Молекулярно-кинетическая теория газов
1.1. Скорости молекул газа
Молекулы газа в каждый момент времени отличаются друг от друга своим местоположением и характером своего движения. Каждая молекула будет двигаться со скоростью  , отличающейся от скоростей других молекул по величине и по направлению, при этом различные значения скоростей не равновероятны.
, отличающейся от скоростей других молекул по величине и по направлению, при этом различные значения скоростей не равновероятны.
В качестве характеристики движения всей совокупности молекул, введем понятия средней квадратичной скорости и среднейскорости молекул.
Кинетическая энергия поступательного движения молекул идеального газа Епост есть сумма кинетических энергий поступательного движения εi пост всех его N молекул:

Введя понятие средней квадратичной скорости
 (1.1)
(1.1)
можно записать выражения для кинетической энергии поступательного движения всех молекул
 (1.2)
(1.2)
и для средней кинетической энергии поступательного движения одной молекулы
 (1.3)
(1.3)
Средняя арифметическая скорость молекул газа определяется из соотношения
 (1.4)
(1.4)
1.2. Основное уравнение кинетической теории газов
В кинетической теории газов предполагается, что давление газа на стенку сосуда создается за счет упругих ударов молекул газа об эту стенку. При упругом ударе сохраняется кинетическая энергия молекул, и, следовательно, скорость молекулы до и после ее удара об стенку.
 Определим давление, возникающее в результате удара молекул о стенки сосуда. Рассмотрим произвольную молекулу массой mi, имеющую скорость
Определим давление, возникающее в результате удара молекул о стенки сосуда. Рассмотрим произвольную молекулу массой mi, имеющую скорость  , находящуюся в кубическом сосуде с длиной ребра а и объемом V = a3(рис.)
, находящуюся в кубическом сосуде с длиной ребра а и объемом V = a3(рис.)

При абсолютно упругом ударе о грань куба ABCD изменение импульса молекулы
Δ(miui) = - 2 miuxi ,
при этом импульс силы, действующий на стенку сосуда
fi δti = 2 miuxi ,
а сила, действующая на стенку
fi =  ,
,
где δti - продолжительность удара.
Отскочив от грани ABCD, молекула полетит к противоположной грани, отскочив от нее, вновь вернется к грани ABCD через время Δti. Средний импульс силы< fi>Δti, действующий на грань ABCD за время Δti
< fi>Δti = fi δti = 2 miuxi.
Между двумя последовательными соударениями молекула пройдет путь 2а со скоростью uxi за время

Тогда средняя сила < fi>, действующая на грань куба со стороны одной молекулы
< fi> =  =
=  ,
,
а со стороны всех молекул
<Fx> =  =
=  =
=  ,
,
где <uквx > - проекция средней квадратичной скорости на ось х, N - число молекул в объеме куба.
Давление, оказываемое газом на стенку ABCD сосуда
 .
.
Аналогично для граней ABEF и EBCG

Движение молекул газа хаотично, следовательно
р = рx = рy = рz
 .
.
С другой стороны
 ,
,
следовательно
 ,
,
тогда 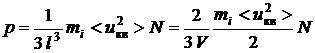 .
.
Учитывая, что средняя кинетическая энергия поступательного движения молекулы

и концентрация молекул  ,
,
получим
 . (1.5)
. (1.5)
Данное выражение является основным уравнением кинетической теории газов.
Из уравнения Менделеева-Клапейрона  .
.
Тогда

 ,
, 

 .
.
Тогда средняя энергия поступательного движения одной молекулы


 (1.6)
(1.6)
Подставив полученное выражение в основное уравнение кинетической теории газов, получим
p = n k T. (1.7)
Дата добавления: 2018-02-15; просмотров: 594; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
