Соотношение между массовыми и объёмными долями
Идеальной газовой смеси
Из определений (8) и (10) и формулы (27) путём применения очевидных преобразований можно получить следующие формулы для пересчёта массовых и объёмных долей идеальной газовой смеси друг в друга.
Для массовых долей будем иметь:
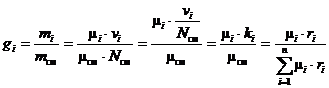 . (35)
. (35)
Для объёмных долей:
 . (36)
. (36)
После умножения и числителя и знаменателя (36) на  , получим искомую формулу:
, получим искомую формулу:
 . (37)
. (37)
Приложение 4
Обратимые и равновесные процессы
По учебной программе сведения Приложения 4 не требуются для сдачи экзамена или зачета.
Приложение 5
Удельные объёмные и мольные теплоёмкости
Помимо удельных массовых в расчётах иногда используются удельные объёмные и удельные мольные теплоёмкости. Они определяются по формулам аналогично (10.2) и (10.3) (см раздел 10). Будем считать, что рассматриваемое вещество, масса которого М, кг, занимает объём V, м3, и число его молей равно N, моль.
Тогда по определению для средних удельных теплоёмкостей после деления (9.1) на V и N будем иметь:
 , или
, или  , (1)
, (1)
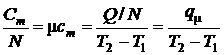 , или
, или  , (2)
, (2)
где  и
и  – средние удельные теплоёмкости в интервале температур от Т1 до Т2 объёмная и мольная соответственно, Дж/(нм3 · К), Дж/(моль · К); q′ и qμ – теплоты, которые необходимо подвести к 1 м3 и 1 молю вещества соответственно, чтобы нагреть его от Т1 до Т2, Дж/нм3, Дж/моль.
– средние удельные теплоёмкости в интервале температур от Т1 до Т2 объёмная и мольная соответственно, Дж/(нм3 · К), Дж/(моль · К); q′ и qμ – теплоты, которые необходимо подвести к 1 м3 и 1 молю вещества соответственно, чтобы нагреть его от Т1 до Т2, Дж/нм3, Дж/моль.
Определение истинных объёмных и мольных теплоёмкостей вводится по формулам, подобным (10.3)
|
|
|
Как уже отмечалось, ведущую роль в расчётах играют теплоёмкости при постоянном давлении и постоянном объёме. Условные обозначения различных удельных теплоёмкостей приводятся в табл. 1.
Таблица 1
Условные обозначения различных удельных теплоёмкостей при постоянном давлении (нижний индекс р), постоянном объёме (нижний индекс υ)
И для произвольного процесса, когда одновременно изменяются
И давление и объём(без индекса)
|
Наименование теплоёмкости |
Размер- ность | Обозначение теплоёмкостей | |||||
| Процесс при р = const | Процесс при υ = const | Процесс при р = var и υ = var**) | |||||
| средняя | истинная | средняя | истинная | средняя | истинная | ||
| Массовая | Дж/(кг · К) | сpm | ср | сυm | сυ | сm | с |
| Объёмная*) | Дж/(м3 · К) | с′pm | с′р | с′υm | с′υ | с′m | с′ |
| Мольная | Дж/(моль·К) | μсpm | μср | μсυm | μсυ | μсm | μс |
Примечания к таблице 1:
*)Для газов и газовых смесей удельная объёмная теплоёмкость обычно рассчитывается по формуле (1) для нормальных условий, то есть для объёма Vо, который этот газ (или газовая смесь) занимал бы при нормальных условиях (н.у.): ро = 101325 Па и tо = 0 оС. Один кубический метр газа, находящегося при н.у., называется нормальным метром кубическим и обозначается 1 нм3.
|
|
|
**) var – означает изменение величины (от латинского variare – изменяться).
Соотношения между удельными теплоёмкостями для газов и газовых смесей
При проведении расчётов, связанных с газами и газовыми смесями, всегда известной величиной является молярная масса газа μ (или кажущаяся молярная масса смеси μсм), кг/моль. Зная эту величину легко получить удобные формулы для пересчёта удельных теплоёмкостей одного типа в другой.
Для этого воспользуемся двумя следующими соотношениями. Из определения молярной массы вещества (это масса одного моля) следует, что:
М = μ · N, (3)
где М – масса вещества, кг; N – число молей вещества, моль; μ – молярная масса вещества, кг/моль.
Из следствия закона Авогадро известно, что 1 моль любого идеального газа занимает при н.у. объём 22,4 · 10–3 нм3/моль. Из этого следует, что плотность любого идеального газа при н.у. определяется соотношением:
 , (4)
, (4)
где ρо – плотность газа при н.у., кг/нм3; μ – молярная масса газа, кг/моль.
|
|
|
Воспользовавшись (4) можно вычислить объём, который газ (или газовая смесь) будет занимать при н.у.:
 , (5)
, (5)
где Vо – объём, который газ будет занимать при н.у., нм3; М – масса газа, кг.
Из определений средних теплоёмкостей (9.1) и (1), (2) получаем путём очевидных преобразований:
 , м3/кг;
, м3/кг; 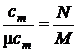 , моль/кг;
, моль/кг;  , моль/м3, (6)
, моль/м3, (6)
где М, V, N – масса, объём и число молей рассматриваемого вещества соответственно, кг, м3, моль.
Подставляя в правые части равенств (6) выражения, которые вытекают из (3) и (5) получаем формулы пересчёта теплоёмкостей для газов и газовых смесей, считая V = Vo (см. примечание табл. 1):
 , нм3/кг;
, нм3/кг;
 , моль/кг; (7)
, моль/кг; (7)
 , нм3/моль.
, нм3/моль.
Повторив рассуждения для истинных теплоёмкостей, получаем аналогичные соотношения:
 , нм3/кг;
, нм3/кг;
 , моль/кг; (8)
, моль/кг; (8)
 , нм3/моль.
, нм3/моль.
Дата добавления: 2018-02-15; просмотров: 3046; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
