VI. ПУТИ ОБМЕНА БЕЗАЗОТИСТОГО ОСТАТКА АМИНОКИСЛОТ
В ходе катаболизма аминокислот происходит отщепление аминогруппы и выделение аммиака. Другим продуктом дезаминирования аминокислот служит их безазотистый остаток в виде α-кетокислот. Катаболизм аминокислот происходит практически постоянно. За сутки в норме в организме человека распадается примерно 100 г аминокислот, и такое же количество должно поступать в составе белков пищи.
Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируваткиназы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2 и Н2О с выделением энергии. Такой путь проходят преимущественно аминокислоты пищи.
При недостатке глюкозы в организме фосфоенолпируват включается в глюконеогенез (см. раздел 7). Это происходит при голодании, длительной физической работу при сахарном диабете и других тяжёлых хронических заболеваниях, сопровождающихся распадом собственных белков организма. Скорость глюконеогенеза из аминокислот регулируется гормонами. Так, под действием глюкагона увеличивается активность регуляторных ферментов процесса, а кортизол индуцирует синтез ферментов глюконеогенеза в печени. Активация глюконеогенеза из аминокислот происходит и при преимущественно белковом питании.
|
|
|
А. Гликогенные и кетонные аминокислоты
Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат
Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в
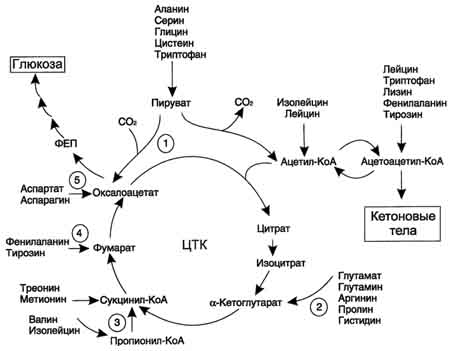
Рис. 9-22. Включение безазотистого остатка аминокислот в общий путь катаболизма.
490
процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот.
Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называюткетогенными.
Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, илигликокетогенными(рис. 9-22, табл. 9-5).
|
|
|
Б. Анаплеротические реакции
Безазотистые остатки аминокислот используются для восполнения того количества метаболитов общего пути катаболизма, которое затрачивается на синтез биологически активных веществ. Такие реакции называют анаплеротическими. На рисунке 9-22 выделены пять анаплеротических реакций:
1. 
Фермент пируваткарбоксилаза (кофермент - биотин), катализирующий эту реакцию, обнаружен в печени и мышцах.
2. Аминокислоты → Глутамат → α-Кетоглутарат
Превращение происходит во многих тканях под действием глутаматдегидрогеназы или аминотрансфераз.
3. 
Пропионил-КоА, а затем и сукцинил-КоА могут образоваться также при распаде высших жирных кислот с нечётным числом атомов углерода (см. раздел 8).
4. Аминокислоты → Фумарат
5. Аминокислоты → Оксалоацетат
Реакции 2, 3 происходят во всех тканях (кроме печени и мышц), где отсутствует пируваткарбоксилаза, а реакции 4 и 5 - в основном в печени. Реакции 1 и 3 (рис. 9-22) - основные анаплеротические реакции.
Вопрос 55
Вопрос 55
В организме человека подвергается распаду около 70 г аминокислот в сутки, при этом в результате реакций дезаминирования иокисления биогенных аминов освобождается большое количество аммиака, являющегося высокотоксичным соединением. Поэтомуконцентрация аммиака в организме должна сохраняться на низком уровне. Действительно, уровень аммиака в крови в норме не превышает 60 мкмоль/л (это почти в 100 раз меньше концентрации глюкозы в крови). В опытах на кроликах показано, что концентрацияаммиака 3 ммоль/л является летальной. Таким образом, аммиак должен подвергаться связыванию в тканях с образованием нетоксичных соединений, легко выделяющихся с мочой.
|
|
|
Один из путей связывания и обезвреживания аммиака в организме, в частности в мозге, сетчатке, почках, печени и мышцах,– этобиосинтез глутамина (и, возможно, аспарагина). Глутамин и аспарагин выделяются с мочой в небольшом количестве. Было высказано предположение, что они выполняют скорее транспортную функцию переноса аммиака в нетоксичной форме. Ниже приводитсяхимическая реакция синтеза глутамина, катализируемого глутаминсинтетазой.

Механизм этой синтетазной реакции, подробно изученный А. Майсте-ром, включает ряд стадий. Синтез глутамина в присутствии глутамин-синтетазы может быть представлен в следующем виде:

Биосинтез аспарагина протекает несколько отлично и зависит от природы ферментов и донора аммиака. Так, у микроорганизмов и в животных тканях открыта специфическая аммиакзависимая аспарагинсинтетаза, которая катализирует синтез аспарагина в две стадии:
|
|
|

Часть аммиака легко связывается с α-кетоглутаровой кислотой благодаря обратимости глутаматдегидрогеназной реакции. Если учесть связывание одной молекулы аммиака при синтезе глутамина, то нетрудно видеть, что в организме имеется хорошо функционирующая система, связывающая две молекулы аммиака:

Глутамин, кроме того, используется почками в качестве резервного источника аммиака (образуется из глутамина под действием глутаминазы), необходимого для нейтрализации кислых продуктов обмена при ацидозе и защищающего тем самым организм от потери с мочой используемых для этих целей ионов Na+.
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80–85% от всегоазота мочи. Основным и, возможно, единственным местом синтеза мочевины является печень. Впервые Г. Кребс и К. Гензеляйт в 1932 г. вывели уравнения реакций синтеза мочевины, которые представлены в виде цикла, получившего в литературе названиеорнитинового цикламочевинообразования Кребса. Следует указать, что в биохимии это была первая циклическая системаметаболизма, описание которой почти на 5 лет опеределило открытие Г. Кребсом другого метаболического процесса – цикла трикарбоновых кислот (см. ранее). Дальнейшие исследования в основном подтвердили циклический характер биосинтеза мочевины впечени. Благодаря исследованиям Г. Коена, С. Ратнер и сотр. были уточнены промежуточные этапы и ферментные системы, катализирующие образование мочевины.
Таким образом, весь цикл мочевинообразования может быть представлен следующим образом. На первом этапе синтезируется макроэрги-ческое соединение карбамоилфосфат – метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пи-римидиновых нуклеотидов (соответственно ДНК и РНК) и аргинина (соответственно белка и мочевины):

На втором этапе цикла мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина;реакцию катализирует орнитин-карбамоилтрансфераза (КФ 2.1.3.3).
На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозави-симая,– это конденсация цитруллина и аспарагиновой кислоты с образованием аргининосукцината (эту реакциюкатализирует аргининосукцинат-синтетаза). Аргининосукцинат распадается в следующей реакции на аргинин и фумарат при участии другого фермента – аргининосукцинатлиазы. На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы.
Необходимо подчеркнуть, что аргиназа содержится в печени тех животных, которые экскретируют с мочой мочевину как основной и конечный продукт азотистого обмена. В печени птиц, например, аргиназа отсутствует, поскольку птицы вместо мочевины выделяютмочевую кислоту. Орни-тиновый цикл мочевинообразования с учетом новых данных представлен на рис. 12.5.
Суммарная реакция синтеза мочевины без учета всех промежуточных продуктов может быть представлена в следующем виде:

Данная реакция сопровождается снижением свободной энергии (ΔG0 = –40 кДж), поэтому процесс всегда протекает в направлении синтеза мочевины. Следует указать, что синтез мочевины энергетически дорого обходится организму. На синтез одной молекулымочевины требуется

Рис. 12.5.Орнитиновый цикл синтеза мочевины в печени.
затрата четырех высокоэнергетических фосфатных групп: две молекулы АТФ расходуются на синтез карбамоилфосфата и одна – наобразование аргининоянтарной кислоты, при этом АТФ расщепляется на АМФ и РРi, который при гидролизе также образует двемолекулы Рi.
Из приведенной схемы процесса мочевинообразования нетрудно видеть, что один из атомов азота мочевины имеет своим источником свободный аммиак (через карбамоилфосфат); второй атом азота поступает из ас-партата. Аммиак образуется главным образом в процессе глутаматде-гидрогеназной реакции. В процессе пополнения запасов аспартата участвуют три сопряженные реакции: сначала фумарат под действием фумаразы присоединяет воду и превращается в малат, который окисляется при участии малатдегидрогеназы с образованием оксалоацетата; последний в реакции трансаминирования с глутаматом вновь образует аспартат.
Вопрос 56
Дата добавления: 2018-02-15; просмотров: 3810; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
