ЗАКОН ГЕССА И СЛЕДСТВИЯ ИЗ НЕГО. МЕТОДЫ РАСЧЕТА ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
Термохимияпредставляет собой раздел химической термодинамики, в котором рассматривается применение первого закона термодинамики для вычисления тепловых эффектов различных физико-химических процессов: химических реакций, фазовых переходов, растворения.
Любая химическая реакция сопровождается поглощением или выделением теплоты – тепловым эффектом. Термохимическими называют такие уравнения химических реакций, в которых наряду с формулами веществ, участвующих в реакции, указывается тепловой эффект реакции.
Тепловой эффект реакции – теплота, которая выделяется или поглощается в результате химической реакции при соблюдении следующих условий:
1) отсутствие полезной работы;
2) неизменность давления или объема системы;
3) постоянство температуры до и после реакции.
То есть реакция должна протекать в изобарно-изотермических или изохорно-изотермических условиях.
Определить тепловой эффект реакции можно по закону Гесса, который формулируется следующим образом:
Если из одних и тех же веществ получать продукты реакции различными путями, то суммарный тепловой эффект не зависит от пути процесса, а определяется начальным и конечным состоянием системы при постоянстве давления или объема, т. е. энтальпия – функция состояния. В общем виде закон Гесса можно представить при помощи схемы (Рис.1.1.1).
Тогда: ∆Н = ∆Н1 + ∆Н2 + … ∆Н6.
 |
Рис. 1. 1.1.Изменение теплового эффекта процесса в соответствии с законом Гесса (точки 1 и 2 обозначают исходное и конечное состояние системы, тепловой эффект этой реакции будет ∆Н).
Если реакция происходит при постоянном объеме, тепловой эффект отождествляется с изменением внутренней энергии:
∆U = ∆U1 + ∆U2 + … ∆Uк.
Закон Гесса используется для различных термохимических процессов. Он позволяет вычислить тепловые эффекты при отсутствии экспериментальных данных.
За стандартное состояние вещества принимают стабильное состояние вещества при Р = 1 атм, Т = 298,16 К.
Определение тепловых эффектов по теплоте образования. Для определения теплового эффекта в термохимических уравнениях пользуются следствиями из закона Гесса.
Первое следствие: тепловой эффект химической реакции равен разности теплот образования продуктов реакции и теплот образования исходных веществ, взятых с учетом стехиометрических коэффициентов.
Тепловой эффект химической реакции будет иметь вид:
 , (1.1.1)
, (1.1.1)
где–  суммы теплот образования продуктов реакции и исходных веществ.
суммы теплот образования продуктов реакции и исходных веществ.
Стандартная теплота образования (энтальпия образования) в расчете на один моль вещества обозначается через  (индекс «f» – от английского formation – образование).
(индекс «f» – от английского formation – образование).
В большинстве случаев теплоту образования определяют в изобарных условиях и вместо понятия «теплота образования» используют термин энтальпия образования – теплота, необходимая для образования соединения из простых веществ. Теплота образования простых веществ принята равной нулю.
Стандартная теплота образования зависит от агрегатного состояния и аллотропной модификации веществ.
Итак, для расчетов тепловых эффектов реакций необходимо знать теплоты образования исходных веществ и продуктов реакции. Как же получают данные о теплотах образования? Таких путей два – экспериментальный и расчетный.
Экспериментальные значения теплоты образования определяют в калориметре.
Приведем пример расчетного способа определения теплоты образования и теплового эффекта химической реакции на примере глюкозы С6Н12О6, теплоту образования которой  можно определить из теплоты образования простых веществ:
можно определить из теплоты образования простых веществ:
6С(графит) + 6Н2(г) +3О2(г) → С6Н12О6(тв.)
используя следующие данные:
1. 6С(графит) + 6О2(г) = 6СО2(г);  ,1= 6(–392,9) = –2357,5
,1= 6(–392,9) = –2357,5  .
.
2. 6Н2(г) + 3О2(г) = 6Н2О(ж); =  ,2 =6(–285,3) = –1713,9
,2 =6(–285,3) = –1713,9  .
.
3. С6Н12О6(тв.) + 6О2(г) = 6СО2(г) + 6Н2О(ж); =  ,3 –2800,6
,3 –2800,6  .
.
Теплота образования глюкозы составит:
 =
=  ,1 +
,1 +  , 2 –
, 2 –  .,3 = –2357,5 +
.,3 = –2357,5 +
+(– 1713,9) – (– 2800,6) = –1270,8 кДж/моль
Определение тепловых эффектов по теплоте сгорания.Теплоту сгорания при стандартных условиях в расчете на 1 моль (стандартную мольную энтальпию сгорания) обозначают через ∆Нсг или ∆Нс (от английского слова conbustion – сгорание).
Теплотой сгорания называется тепловой эффект реакции окисления данного соединения кислородом до образования высших оксидов элементов или соединений этих элементов.
Тепловой эффект реакции можно определить по теплоте сгорания веществ, участвующих в реакции.
Для этой цели пользуются вторым следствиемиз закона Гесса, которое формулируется так: тепловой эффект химической реакции равен разности теплоты сгорания исходных веществ и теплоты сгорания продуктов реакции с учетом стехиометрических коэффициентов:
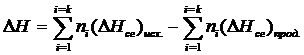 (1.1.2)
(1.1.2)
Значения теплот сгорания используют для определения тепловых эффектов реакций, главным образом органических веществ.
Теплоту сгорания, так же как и теплоту образования, измеряют при помощи калориметра.
Третье следствиеиз закона Гесса позволяет рассчитывать тепловые эффекты и гласит: энтальпия химической реакции равна разности энергий разрываемых и образующихся химических связей:
 =
= 
где Qвозг – теплота возгонки.
В этом методе расчета сначала предполагают разложение исходных простых веществ на атомы, а затем образование из них конечного газообразного соединения. Первый этап связан с затратой энергии на разрыв связей в исходных простых веществах, а второй – с выделением энергии образования новых связей.
Энергией связи называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечное расстояние.
При расчете тепловых эффектов химических реакций, протекающих в водных растворах, следует учитывать диссоциацию химических соединений. Для тех химических соединений, которые диссоциирует в растворе, в расчетах нужно брать стандартные теплоты образования соответствующих ионов, а для тех, которые не диссоциируют, - стандартные теплоты образования соединений. Стандартная теплота образования иона в водном растворе – это тепловой эффект образования гидратированного иона из простых веществ.
Ион гидроксония H3O+ обычно в термохимических уравнениях пишут в виде H+aq. Теплота образования иона H+aq условно принята равной нулю.
Контрольные вопросы
1. Что изучает термохимия? Назовите русских ученых и укажите их вклад в развитие термохимии.
2. Определите понятие "тепловой эффект химической реакции".
3. Приведите термодинамическую и термохимическую формы записи уравнений химической реакции термического разложения карбоната кальция, если при ее протекании при 298 К поглощается 177,4 кДж/моль тепла.
4. Сформулируйте закон Гесса. Укажите его научное и практическое значение. Докажите, что закон Гесса – частный случай первого закона термодинамики. Докажите, при каких условиях этот закон не противоречит первому закону термодинамики.
5. Есть ли противоречие между первым законом термодинамики, утверждающим, что теплота является функцией процесса, и законом Гесса, утверждающим, что теплота от пути процесса не зависит?
6. Объясните, почему в химических реакциях поглощается (выделяется) теплота. Выведите соотношение, связывающее Qp и QV для:
1) идеальных газов;
2) реальных газов;
3) жидких и твердых тел. Может ли Qp равняться QV?
7. Что называется теплотой образования химического соединения?
8. Как рассчитываются тепловые эффекты реакции, которые не могут быть найдены опытным путем? Какие данные для этого необходимы?
9. Какими эмпирическими уравнениями зависимости теплоемкости от температуры пользуются при выводе интегрального уравнения Кирхгофа? Какова область (p и T) применения этих эмпирических уравнений?
10. Что представляет собой энергия разрыва связей? Как, используя энергии разрыва связи и теплоту сублимации углерода, рассчитать тепловой эффект химической реакции?
11. Почему метод расчета тепловых эффектов по энергиям разрыва связей является приближенным? Чем объяснить различия в энергиях разрыва одних и тех же связей, определяемых различными авторами?
12. Напишите формулу для расчета теплового эффекта реакции по теплотам образования химических соединений.
13. Что называется теплотой сгорания химического соединения? Приведите примеры.
Дата добавления: 2018-02-15; просмотров: 6312; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
