ТЕРМОДИНАМИКИ. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ И ЕГО ПРИЛОЖЕНИЯ
САРАТОВСКИЙ ВОЕННЫЙ ИНСТИТУТ ХИМИЧЕСКОЙ И БИОЛОГИЧЕСКОЙ БЕЗОПАСНОСТИ
Дмитриенко Т.Г., Родзивилова И.С.
СБОРНИК ВОПРОСОВ И ЗАДАЧ
ПО ХИМИЧЕСКОЙ ТЕРМОДИНАМИКЕ
Учебное пособие
Саратов - 2007

 Учебное пособие представляет собой сборник примеров и задач по разделу физической химии «Химическая термодинамика» и предназначено для курсантов технологической и экологической специальностей и студентов.
Учебное пособие представляет собой сборник примеров и задач по разделу физической химии «Химическая термодинамика» и предназначено для курсантов технологической и экологической специальностей и студентов.
Учебное пособие построено по классическому принципу: каждая глава начинается с подробного теоретического раздела, за которым следуют примеры решения типовых задач и задачи для самостоятельного решения. В приложении приведены список основных физико-химических формул по разделу «Химическая термодинамика», избранные таблицы термодинамических данных.
Пособие составлено в соответствии с программой курса "Физическая химия" для технологической специальности кандидатом химических наук Дмитриенко Т.Г. и доцентом кафедры физической и органической химии технологического института СГТУ, кандидатом химических наук Родзивиловой И.С.
Рецензенты: кафедра «Технология электрохимических производств» технологического института Саратовского государственного технического университета
Заведующая кафедрой ТИ СГТУ,
профессор, доктор химических наук Соловьева Н.Д.
Ó Саратовский военный институт химической и биологической безопасности, 2007 г.
СОДЕРЖАНИЕ
| Введение. Предмет и задачи физической химии. Основные задачи химической термодинамики…………………………………… | 5 | |
| 1 | Основные понятия химической термодинамики. Первый закон термодинамики и его приложения………… | 10 |
| 1.1 | Закон Гесса и следствия из него. Методы расчета тепловых эффектов химических реакций………………………………………. | 26 |
| 1.2 | Зависимость теплового эффекта химической реакции от температуры. Теплоемкость. Уравнение Кирхгоффа…………………… | 40 |
| 2 | Второй закон термодинамики……………………………………… | 54 |
| 2.1 | Энтропия и ее свойства. Определение самопроизвольности и равновесия процессов в изолированных системах……………….. | 57 |
| 2.2 | Характеристические функции. Энергия Гиббса и энергия Гельмгольца. Расчет термодинамических потенциалов в открытых системах…………………………………………………………………. | 63 |
| 3 | Химическое равновесие. Закон действующих масс. Константа равновесия. Способы выражения констант равновесия…………... | 97 |
| 3.1 | Уравнение изотермы Вант-Гоффа. Определение направленности химических процессов по уравнению изотермы…………………... | 105 |
| 3.2 | Уравнения изобары и изохоры химической реакции. Расчет констант равновесия и тепловых эффектов химических реакций по уравнению изобары | 109 |
| 3.3 | Зависимость константы равновесия от температуры. Метод Шварцмана-Темкина | 113 |
| 3.4 | Расчет равновесного состава | 117 |
| 4 | Многовариантные задачи | 142 |
| 5 | Справочные термодинамические таблицы | |
| 6 | Список основных расчетных формул |
ВВЕДЕНИЕ. ПРЕДМЕТ И
ЗАДАЧИ ФИЗИЧЕСКОЙ ХИМИИ. ОСНОВНЫЕ ВОПРОСЫ
ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Физическая химия – наука о закономерностях химических процессов и химических явлений. Она объясняет эти явления на основе фундаментальных положений физики и стремится к количественному описанию химических процессов. Физическая химия изучает происходящие в этих системах изменения, сопровождающиеся переходом химической формы движения в различные физические формы движения – тепловую, электрическую, лучистую и др. Физическая химия изучает химические процессы не сами по себе, а в неразрывной связи с сопровождающими их физическими явлениями – выделением (поглощением ) теплоты, энергии излучения, прохождением электрического тока.
Основная задача физической химии – предсказание временного хода химического процесса и конечного результата на основании данных о строении и свойствах молекул веществ.
Возникновение физической химии относится к середине XVIII века – когда существовала основа для выделения и дальнейшего развития физической химии как самостоятельной науки.
Первый в мире курс физической химии был создан нашим великим соотечественником Ломоносовым. В 1752 году им было написано «Введение в истинную физическую химию», в которой он дал определение содержания и задач физической химии:
«Физическая химия – наука, объясняющая на основании положений и опытов физических причину операции в сложных телах».
В настоящее время физическая химия представляет самостоятельную дисциплину со своими методами исследования и является теоретической базой химико-технологических дисциплин.
Физическая химия рассматривает две группы вопросов:
– изучение свойств и строения различных веществ в зависимости от их химического состава и химического строения;
– изучение химических реакций и других форм взаимодействия между веществами в зависимости от их химического состава и строения, а также от внешних условий.
Содержание курса обычно условно делят на несколько основных разделов:
1. Строение вещества. В этот раздел входит учение о строении атомов и молекул; учение об агрегатных состояниях вещества.
2. Химическая термодинамика. Этот раздел базируется на трех основных законах термодинамики. Первый закон термодинамики позволяет определить тепловой и общий энергетический баланс химического процесса, рассчитать количество выделяемой и поглощаемой энергии. Второй закон термодинамики позволяет определить возможность самопроизвольного протекания процесса, а также смещение равновесия под влиянием внешних условий. Третий закон термодинамики дает возможность рассчитать абсолютные энтропии веществ определить изменение энтропии фазовых переходов.
3. Учение о растворах. Этот раздел рассматривает природу растворов, их внутреннюю структуру и важнейшие свойства, зависимость свойств растворов от концентрации и химической природы компонентов, вопросы растворимости.
4. Электрохимия. Этот раздел позволяет изучить особенности свойств растворов электролитов, процессы электролиза, работу гальванических элементов, химических источников тока и электрохимическую коррозию металлов.
5. Химическая кинетика и катализ изучает механизм химических реакций как в гомогенной, так и в гетерогенной среде, скорость протекания различеых процессов и влияния таких факторов, как концентрация, температура, излучение и т.д.
Раздел физической химии, в котором изучается переход энергии из одной формы в другую, от одной части системы к другой, энергетические эффекты, сопровождающие различные физические и химические процессы, направление и пределы самопроизвольного протекания самих процессов, называется химической термодинамикой.
Термодинамика как наука возникла в конце первой половины XIX столетия. Она базируется на трех законах, из которых все остальные положения данной науки можно получить путем логических рассуждений (Схема 1.1)

Схема 1.1. Взаимосвязь законов термодинамики
Первый закон термодинамики непосредственно связан с законом сохранения энергии. Он позволяет рассчитывать тепловые балансы различных процессов, в том числе и химических реакций.
Второй закон термодинамики– закон о возможности протекания самопроизвольных процессов. На основании второго закона термодинамики можно предсказать, при каких внешних условиях возможен процесс и в каком направлении он будет протекать.
Третий закон термодинамики– закон об абсолютном значении энтропии, позволяющий вычислить константу равновесия химической реакции и, как cледствие, максимально возможный выход продукта реакции.
Объектами исследования в термодинамике являются только макроскопические системы и не рассматривается молекулярная структура вещества, характер сил взаимодействия между молекулами, механизм процесса.
Термодинамика изучает объекты только в состоянии термодинамического равновесия.
Химическая термодинамика позволяет:
1) рассчитать тепловой эффект процесса, на базе которого можно определить тепловой баланс технологического цикла, а затем и всего производства;
2) определить возможность, направление и полноту протекания самопроизвольных процессов и условия равновесия;
3) рассмотреть оптимальные условия проведения процесса и его изменения в зависимости от внешних условий, главным образом от температуры и давления.
Практическая значимость химической термодинамики заключается в том, что на базе ее законов и положений находят числовые значения параметров, которые дают количественные представления о происходящих процессах.
ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ
ТЕРМОДИНАМИКИ. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ И ЕГО ПРИЛОЖЕНИЯ
Термодинамическая система – это тело или группа тел, находящихся во взаимодействии и отделенные видимой или воображаемой поверхностью раздела от окружающей среды.
Различают следующие системы:
изолированная - не обменивающаяся с окружающей средой ни веществом,
ни энергией;
закрытая - обменивающаяся с окружающей средой только энергией, но невеществом;
открытая - обменивающаяся с окружающей средой и веществом, и энергией.
Свойства системы можно разделить на две группы: экстенсивные и интенсивные.
Экстенсивные свойства пропорциональны массе системы. Если массу системы удвоить, то и экстенсивные свойства соответственно увеличатся вдвое. К экстенсивным свойствам можно отнести внутреннюю энергию, энтропию, теплоемкость, объем.
Интенсивные свойства, например, температура, давление, молярная теплоемкость, молярный объем не зависят от массы системы.
Различают гомогенные и гетерогенные системы. Гомогенной называют такую систему, внутри которой нет поверхности раздела, отделяющей друг от друга части системы, различающиеся по свойствам.
Системы, внутри которых такие поверхности раздела имеются, называются гетерогенными.
Окружающая среда – это все тела вне системы.
Система характеризуется некоторыми физическими и химическими свойствами: давлением (р); объемом (V); температурой (Т); концентрацией вещества (с) и т.д. Эти свойства называются параметрами системы. Параметры связаны между собой уравнением, которое называется уравнением состояния: ¦(р,V, T)=0.
В химической термодинамике часто применяется модель идеального газа.
Свойства идеальных газов описываются уравнением Менделеева – Клапейрона:
PV =ΔnRT (1.1)
где Р – давление; V – объем занимаемый n молями газа; n – число молей газа;
Т – абсолютная температура; R – универсальная газовая постоянная.
Свойства смеси идеальных газов описывается уравнением Дальтона при Т = const:
Р = Р1 + Р2 + P3 + … + Рi =  Pi, (1.2)
Pi, (1.2)
Pi = Pxi, (1.3)
где Р – общее давление газов; Pi – парциальное давление i-го компонента;
xi – молярная доля i-го компонента,
и уравнением Амага:
V = V1 + V2 + V3 + … + Vi =  Vi, (1.4)
Vi, (1.4)
Vi = Vxi, (1.5)
где V – общий объем смеси газов; Vi – парциальный объем i-го компонента;
xi – молярная доля i-го компонента;
 xi =
xi =  , (1.6)
, (1.6)
где ni – число молей i-го компонента;
Vi P = PiV. (1.7)
Свойства реальных газов описываются уравнением Ван-дер-Ваальса для одного моля газа:
 , (1.8)
, (1.8)
где n молей:
 , (1.9)
, (1.9)
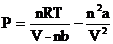 , (1.10)
, (1.10)
где a – постоянная, учитывающая взаимное притяжение молекул,
 , (1.11)
, (1.11)
b – постоянная, учитывающая собственный объем молекул,
b = 2/3 ps3 NA; (1.12)
b =  , (1.13)
, (1.13)
где Тк – критическая температура газа; pк – критическое давление газа;
NA – постоянная Авогадро; s - кинетический диаметр газов и молекул газов.
Уравнение Ван-дер-Ваальса можно представить в вириальной форме:
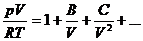 (1.14)
(1.14)
где В и С – второй и третий вириальные коэффициенты соответственно.
Процесс, при котором после ряда изменений система возвращается в начальное состояние, называется круговым процессом или циклом.
Равновесный процесс – это непрерывный бесконечно медленный ряд равновесных состояний, через которые проходит система в прямом и обратном направлении и при этом совершается максимальная работа.
Процесс, который можно провести в прямом и обратном направлении без изменения не только в системе, но и в окружающей среде, называется обратимым. Сравнивая понятия обратимого и равновесного процессов, можно заключить, что эти понятия отражают свойства одного и того же процесса. Поэтому между ними не проводятся различия.
Если же в результате протекания процесса в прямом и обратном направлениях в самой системе останутся какие-либо изменения, то процесс называется необратимым. Неравновесный процесс будет необратим. процессов без трения) являются в той или иной степени необратимыми.
Изотермическимназывается процесс, протекающий при постоянстве температуры, T = const.
Изобарным –при постоянстве внешнего давления, p = const.
Изохорным– при постоянстве объема системы, V= const.
Изоэнтропийным – при постоянстве энтропии системы, S = const.
Адиабатным– при отсутствии обмена энергией в форме теплоты между системой и окружающей средой, Q = 0.
Изобарно-изотермическим – при p,T = const.
Изохорно-изотермическим – при V, T = const.
Изобарно-изоэнтропийным – при p,S = const.
Изохорно-изоэнтропийным – при V,S = const.
Термодинамический процесс – любое изменение одного или нескольких параметров системы.
Теплота и работа – характеризуют определенные способы передачи энергии.
Теплота – это молекулярно – микроскопический способ передачи энергии.
Работа характеризует способ передачи энергии, обусловленный действием над макроскопическими телами. Работа – это произведение обобщенной силы на бесконечно малое изменение обобщенной координаты, это произведение интенсивного параметра на бесконечно малое изменение экстенсивного.
Таким образом, теплота и работа – два способа передачи энергии, но с различными формами перехода.
В термодинамике широко используют функции состояния – функции, которые не зависят от пути процесса, а определяются начальным и конечным состоянием системы.
Функцией состояния является внутренняя энергия.
Внутренняя энергия определяет общий запас энергии всех частиц системы, включающей энергию поступательного и вращательного движения молекул, межмолекулярное притяжение и отталкивание, внутримолекулярную, электронного возбуждения, внутриядерную, лучистую.
Величина внутренней энергии зависит от природы, массы вещества и параметров системы – Р, V, T.
Нулевое значение внутренней энергии невозможно, так как для этого необходимо систему перевести в состояние, лишенное внутренней энергии, что абсурдно. По этой причине всегда рассматривают изменение внутренней энергии ∆U, то есть разность внутренней энергии между ее конечным U2 и начальным U1 состояниями:
∆U = U2 – U1
Через dU обозначается бесконечно малое изменение внутренней энергии. Величина dU является полным дифференциалом, поскольку она является функцией состояния, не зависит от перехода и определяется лишь начальным и конечным состояниями системы.
Внутренняя энергия выражается через параметры состояния системы, к которым относятся температура и объем:
U = f(V, T).
Полный дифференциал внутренней энергии как функции состояния выражается формулой:
 (1.15)
(1.15)
Для химических и физико-химических процессов передача теплоты часто происходит при Р = cоnst. Поэтому большое практическое значение по сравнению с внутренней энергией приобретает энтальпия, тоже являющаяся функцией состояния.
Энтальпия определяется выражением:
∆Н = ∆U + P∆V (1.16)
или dH = dU + РdV (1.17)
Энтальпия, как и внутренняя энергия, – функция состояния, а dH – полный дифференциал:
 (1.18)
(1.18)
Нулевое начало термодинамики определяет условие равновесного состояния системы: при неизменных внешних условиях система в равновесном состоянии не изменяется во времени: если система находится в состоянии равновесия, то в равновесии находятся и все части этой системы.
Равенство температуры во всех частях системы, находящейся в равновесии, называют нулевым началом термодинамики.
От этой формулировки нулевого начала термодинамики можно перейти и к другим – при соприкосновении двух конденсированных тел, теплота самопроизвольно переходит от более нагретого к менее нагретому телу до тех пор, пока они не придут в термодинамическое равновесие и не будут иметь одинаковую температуру.
В случае систем: если каждая из двух систем находится в тепловом равновесии с другой или другими системами, то эти две (и более) системы также находятся в тепловом равновесии.
Из нулевого начала термодинамики следует, что определенная фиксированная температура системы возможна лишь для состояния равновесия.
Температура и теплота – разные понятия. Теплота представляет собой одну из форм энергии, а температура – условная мера теплового состояния.
Первое начало термодинамики по существу есть выражение закона сохранения энергии и устанавливает связь между количеством теплоты, полученной или отданной в процессе, работой и изменением внутренней энергии системы. Существует несколько формулировок первого начала термодинамики:
1.Невозможно создать вечный двигатель первого рода, т.е. такую периодически действующую машину, которая производила бы работу без определенных затрат молекулярной энергии.
2.Разные формы энергии переходят друг в друга в строго эквивалентных соотношениях.
3.В любой изолированной системе запас внутренней энергии остается постоянным..
4. Невозможно получить работу без затраты энергии.
Первое начало термодинамики можно представить в виде следующего аналитического выражения:
dQ = dU + dW (1.19)
или Q =  U + dW (1.20)
U + dW (1.20)
Поэтому I закон можно сформулировать и так:
5. Теплота, сообщаемая системе, идет на приращение внутренней энергии и на работу, совершаемую системой.
Уравнение I закона можно записать и так:
dU = dQ – dW (1.21)
и прочитать: изменение внутренней энергии системы является следствием передачи теплоты и совершения работы.
В случае идеальных газов и работы расширения:
dQ = dU + PdV (1.22)
Для изохорных процессов, когда dV = 0 и V = const, получаем:
dQV = dU (1.23)
Равенство (1.23) означает, что в изохорно-изотермических процессах теплота процесса равна изначально внутренней энергии, являющейся функцией состояния.
Используя равенство (1.22), можно выразить теплоту через энтальпию:
dH = dU + PdV + VdP (1.24)
Для изобарных условий на основе первого начала термодинамики:
dU = dQ – PdV (1.25)
Поэтому
dQp = dH (1.26)
Из равенства (1.26) следует, что в изобарно – изотермических процессах теплота процесса равна изменению энтальпии.
Вывод:для изохорно-изотермического процесса тепловые эффекты можно выразить через изменение внутренней энергии, а для изобарно-изотермического – через изменение энтальпии, то есть через изменение термодинамических функций состояния.
Рассмотрим взаимосвязь Qp и QV. В результате химической реакции в газовой фазе может измениться число молей
Dn = ånкон. – ånисх., (1.27)
где nкон. и nисх. – число молей продуктов реакции (конечных) и исходных (начальных) веществ соответственно.
Уравнение для моля идеального газа: P∆V = ∆nRT
∆U = ∆H – ∆nRT (1.28)
dU = dH – ∆ nRT (1.29)
Теплоту, выделяемую или поглощаемую в результате химической реакции, можно определить расчетным путем, не прибегая к эксперименту. Для этой цели необходимо рассмотреть закон Гесса и следствия из этого закона, а затем познакомиться с методом расчета тепловых эффектов по теплоте образования или сгорания сложных веществ в стандартных условиях (давление 1,013 × 105 Па, температура 250С или 298,16К).
Контрольные вопросы
1. Что является предметом изучения физической химии и каковы ее задачи на современном этапе?
2. Охарактеризуйте этапы развития физической химии.
3. Какой вклад внесли в развитие физической химии русские ученые?
4. Какие вопросы изучает термодинамика? Каково происхождение этого термина?
5. Рассмотрите основные понятия и определения в термодинамике:
· термодинамическая система; открытая, закрытая, изолированная термодинамическая система; параметры состояния;
· термодинамический процесс: изотермический, изохорный, изобарный, адиабатический процессы.
6. Охарактеризуйте сущность методов, используемых в физической химии.
7. Какую модель вещества принято называть идеальным газом? Запишите уравнение состояния идеального газа для одного и n молей.
8. Каков физический смысл универсальной газовой постоянной? Почему она является универсальной величиной? Укажите ее численные значения при различных единицах измерения давления и объема.
9. Запишите аналитически зависимость давления идеального газа от температуры в изохорическом процессе. Изобразите эту зависимость графически для n1 и n2 молей ( n2> n1) газа при постоянных V1 и V2 (V1 > V2).
10. Сформулируйте закон, передающий связь Т и V в изобарическом процессе, приведите его аналитическое и графическое изображение при p1, p2, p3, если p1< p2< p3 для n1 и n2 молей газа (n1 > n2).
11. Какова модель реального газа и в чем ее отличие от модели идеального газа?
12. Приведите уравнение Ван-дер-Ваальса для одного моля газа. Какова размерность и физический смысл величин “b” и “a/V2” в этом уравнении? Какой физический смысл имеют два сомножителя, стоящие в левой части уравнения? Какой вид имеет уравнение для n молей газа?
13. Приведите уравнение состояния реального газа с вириальными коэффициентами.
14. Дайте определения понятиям: полная и внутренняя энергия, теплота и работа. Приведите единицы их измерений.
15. Можно ли определить абсолютное значение внутренней энергии?
16. Дать определение понятия “система”. Система – закрытая и открытая. Изолированная система. Макро- и микропараметры системы. Дать определение понятия “теплота”, можно ли говорить о запасе теплоты? Докажите математически, что бесконечно малое изменение теплоты в общем случае не является полным дифференциалом. Укажите те частные случаи, когда dQ обладает свойствами полного дифференциала.
17. Перечислите все виды энергетических взаимодействий и запишите аналитическое выражение для каждого из них.
18. Что называется потенциалом и координатой состояния системы? Какова их роль при характеристике энергетического взаимодействия системы с окружающей средой?
19. Дать определение понятия “работа”. Можно ли говорить о запасе работы? Докажите, что в общем случае бесконечно малое изменение работы dW не является полным дифференциалом. Укажите те частные случаи, когда dW обладает свойствами полного дифференциала.
20. Дать определение функции состояния. Показать, что любой параметр состояния можно рассматривать как функцию состояния. Показать, что теплота и работа не являются функциями состояния. Какие из перечисленных величин – внутренняя энергия, теплота, работа – являются функциями состояния?
21. Какие формулировки первого закона термодинамики вам известны? Приведите все формулировки I-го закона термодинамики и напишите его аналитические выражения для бесконечно малого и конечного изменения состояния открытой, закрытой и изолированной системы.
22. Охарактеризуйте теоретическое и практическое значение I-го закона термодинамики.
23. Можно ли представить себе процесс, протекающий при постоянном объеме, за счет которого получается работа?
24. Будет ли изменяться внутренняя энергия идеального газа при постоянной температуре, если этот газ подвергнуть изотермическому сжатию или расширению?
25. Выведите математические выражения для изменения внутренней энергии, теплоты, работы и изменения энтальпии в изотермическом, изохорном, изобарном и адиабатическом процессах для n молей идеального газа. Выведите уравнения состояния идеального газа для каждого из этих случаев. Заполните приведенную ниже таблицу:
| Условия проведения процесса | DU | Q | A | DH | Уравнение состояния |
| Изотермический | |||||
| Изохорный | |||||
| Изобарный | |||||
| Адиабатический |
Сравните графически работу расширения n молей идеального газа в
изобарном, изотермическом и адиабатическом процессах, если начальный и
конечный объемы одинаковы.
26. На основании каких данных рассчитывается изменение внутренней энергии и энтальпии при изменении температуры, если при этом не происходят химические реакции и фазовые превращения?
27. Можно ли представить себе процесс, протекающий при постоянной температуре и сопровождающийся изменением внутренней энергии? Приведите пример.
28. Может ли производить работу изолированная система? Ответьте на следующие вопросы:
a) Какая работа будет производиться в изолированной системе, состоящей из двух частей А и В, разделенных перегородкой, при выравнивании давлений?
b) Если в изолированной системе протекает химическая реакция, производится ли при этом работа?
29. Объясните, почему в химических реакциях поглощается (выделяется) теплота. Выведите соотношение, связывающее Qp и Qv для:
а) идеальных газов; б)для реальных газов; в) жидких и твердых тел.
Может ли Qp равняться Qv?
30. Какой физический смысл имеет функция энтальпия? Можно ли определить ее абсолютное значение? Какими свойствами обладает эта функция?
31. Какие свойства называются экстенсивными и интенсивными? Какими из этих свойств обладают следующие функции: объем¸ давление, температура, плотность, внутренняя энергия, теплота, работа, энтальпия, показатель преломления и теплоемкость.
32. В каких случаях изменение внутренней энергии и изменение энтальпии имеют физический смысл теплового эффекта химического процесса?
33. От каких параметров (Т, р, V) и как зависит внутренняя энергия реальных газов?
34. Приведите аналитические выражения первого закона термодинамики через калорические коэффициенты.
35. Укажите физический смысл и размерность калорических коэффициентов и приведите их выражения и связь для идеальных и реальных газов.
36. Как связаны между собой DH и DU, Qv и Qp? В каком случае их различием можно пренебречь?
Дата добавления: 2018-02-15; просмотров: 3247; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
