ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РЕАКЦИЙ
Правило Вант-Гоффа:в области невысоких температур (0÷300) 0 С при увеличении температуры на 100 скорость реакции возрастает в 2 – 4 раз
γ = (2-4) - температурный коэффициент показывает, во сколько раз увеличивается скорость при повышении температуры на 100
 или
или  при С = const (для приблизительных расчётов)
при С = const (для приблизительных расчётов)
 gэкзотерм.< gэндотерм. J DrН>0
gэкзотерм.< gэндотерм. J DrН>0
DrН<0
Т
Аррениус: К реакции приводит столкновение лишь активных молекул, энергия которых больше определённой величины энергии Ea ,необходимой для ослабления и перестройки связей, т.е. для перехода веществ в состояние активированного комплекса
Активированный комплекс – переходное состояние системы (старые связи ослабли, новые не сформировались), для его образования необходима энергия Еа
Для реакции: АВ + ДС → АД + ВС

 А – В А….В А - Д
А – В А….В А - Д

 +
+
|
|
|
Д – С Д….С В - С
исходные активированный продукты
молекулы комплекс реакции

Для обратимой реакции АВ + ДС = АД + ВС (Еаэкз ˂ Еаэнд): ∆rHпр = Hкон. – Hнач = Еапр - Еаобр Þ связь термодинамических и кинетических параметров
Величина Еа отражает влияние природы исходных частиц на скорость реакции (чем прочнее связи, тем труднее их разорвать, тем больше Еа и меньше скорость). Определяют на основании значений Есвязей.
Еа большинства реакций (40 ÷400) кДж/моль.
Доля активных частиц растет под действием:
тепловой, световой, электрической энергий, рентген. лучей и др.
При увеличении Т число активных частиц ↑ и скорость ↑
Уравнение С.Аррениуса 
k – константа скорости реакции при Т
k0 – предэкспоненциальный множитель, не зависит от Т
k0 = k, если Еа = 0
Физич. смысл k0 - частотно-ориентационный фактор, учитывающий влияние числа столкновений (z) и ориентации молекул (Poр.) на скорость k0 = z Poр
Для осуществления реакции необходима благоприятная ориентация молекул в момент столкновения.
|
|
|
 |
Неблагоприятная ориентация благоприятная ориентация
Реакция принципиально возможна при достижении исходными частицами Е>Ea и их надлежащей ориентации (Т=const).
Из уравнения Аррениуса 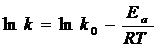 или
или 
Из преобразования уравнений Аррениуса для двух Т можно определить Еа (аналитический способ):
 (Еа./R)(1/T1–1/T2) или lgγ = (Еа./2,3R)(10/T1T2)
(Еа./R)(1/T1–1/T2) или lgγ = (Еа./2,3R)(10/T1T2)
и при ∆Т=10 lgγ = (Еа./2,3R)(1/T1–1/T2)
Другой способ - графический: строят график зависимости в координатах (lgk, 1/T).
 lgk
lgk
lgk0 tg a= 
a
1/T
Задача 4.
Рассчитайте изменение константы скорости реакции, имеющей энергию активации 191 кДж/моль, при увеличении температуры от 330 до 400К.
|
|
|
Решение. Уравнение Аррениуса


 Логарифм отношения констант скоростей реакции при температурах Т2 и Т1
Логарифм отношения констант скоростей реакции при температурах Т2 и Т1
где R = 8,31 Дж/(моль×К) – универсальняая газовая постоянная.


Следовательно
Задача 5.
Определите константу скорости реакции 2НI(г) ® Н2(г) + I2(г) при температуре 2000 С , если предэкспоненциальный множитель A0 = 9,2·1013, а энергия активации ЕА = 186,4 кДж/моль. Каков физический смысл константы скорости реакции? От каких параметров и как зависит константа скорости реакции? Укажите ее размерность для Вашей реакции (порядок реакции n =2)
Решение.
Уравнение С.Аррениуса 
k – константа скорости реакции при данной Т, размерность
А0 – предэкспоненциальный множитель, не зависит от Т
А0 = k, если Еа = 0
Физич. смысл А0 - частотно-ориентационный фактор, учитывающий влияние числа столкновений (z) и ориентации молекул (Poр.) на скорость А0 = z Poр
Для осуществления реакции необходима благоприятная ориентация молекул в момент столкновения.
Уравнение, связывающее скорость реакции с концентрацией исходных веществ, называют кинетическим. Для n=2 основное кинетическое уравнение 
|
|
|
k - константа скорости:
а) не зависит от концентрации
б) зависит от температуры, природы реагирующих веществ, катализатора, площади поверхности раздела фаз.
Физический смысл константы скорости: k – удельная скорость:  , если С= 1моль/л
, если С= 1моль/л
n = 2 общий порядок реакции
В простых реакциях: n = 1, 2 редко 3 и общий порядок равен молекулярости.
Размерность k зависит от порядка реакции. Для n =2 [k ]= л/(моль×с).
При Т=273 +200=473 К k = 9,2·1013 . exp(-186400/8,31. 473) = 9,2·1013 e-46= 9,2·10-7 л/(моль×с).
Дата добавления: 2018-02-15; просмотров: 580; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
