Теоретическое введение и основные формулы
Nbsp; А.П. Артемьянов
Сборник задач
Физико-химические свойства растворов
Владивосток
2003
Министерство образования Российской федерации
Дальневосточный государственный университет
А.П. Артемьянов
Сборник задач
Физико-химические свойства растворов
Владивосток
Издательство Дальневосточного университета
2003
ББК 24.5
А 86
Артемьянов А.П.
А 86 Сборник задач. Физико-химические свойства растворов.
 Владивосток: Изд-во Дальневост.университета, 2003.
Владивосток: Изд-во Дальневост.университета, 2003.  60с.
60с.
Контрольные работы содержат задачи для самостоятельного решения по термодинамическим, равновесным и коллигативным свойствам растворов. Все расчетные задачи снабжены ответами. Составлены в соответствии с программой курса физической химии для студентов, обучающихся по специальности 011000 - Химия. Предназначены для студентов III курса химического факультета, могут использоваться как материал для контрольных работ, семинарских занятий и коллоквиумов.
А 1805000000 ББК 24.5
180(03)  2003
2003
Ó Артемьянов А.П., 2003
Ó Издательство Дальневосточного
|
|
|
университета, 2003
Краткое предисловие, или что необходимо знать,
Приступая к решению задач.
Задания в данном пособии распределены по возрастанию уровня сложности. Первое задание каждого варианта основано на расчетах по закону Рауля, во втором используются диаграммы состояния жидких бинарных растворов; третье, четвертое и пятое задания связаны с расчетами по уравнениям криоскопии, эбулиоскопии и осмотического давления.
Первые десять вариантов включают сравнительно простые задачи и не требуют чего-либо экстраординарного от студента. Большинство задач в этих вариантах решаются подстановкой числовых значений в нужную формулу. Следует обращать внимание на соответствие размерностей используемых в формуле величин давления, концентрации, температуры, энтальпии. Необходимо также помнить способы перехода от одних видов концентрации к другим: от массовой доли к мольной доле, от мольной доли к молярности и т.п.
Последующие варианты составлены из более сложных (и более интересных) заданий, решение которых требует определенных размышлений и позволяет проявить известную находчивость и остроумие.
В некоторых заданиях для решения нужно использовать справочные данные (иногда на это специально не указывается), такие как давление паров чистых растворителей (воды) при данной температуре, температуры кристаллизации и кипения, энтальпии плавления. Эти данные необходимы для расчета давления паров над раствором, криоскопических и эбулиоскопических констант растворителей. Необходимую информацию можно найти в справочной таблице на странице 49, а также в справочниках:
|
|
|
[1]. “Краткий химический справочник“ // В.А. Рабинович, З.Я. Хавин. Л.: Химия. 1978. 392 с.
[2].“Краткий справочник физико-химических величин” // Под ред. А.А. Равделя и А.М. Пономаревой. Л.: Химия. 1983. 232 с.
Правильность решения задач можно проверить по ответам в конце пособия, при этом следует иметь в виду, что во вторых заданиях вариантов считывание значений с диаграмм на рисунках возможно с определенными погрешностями, и поэтому не исключены небольшие расхождения с ответом.
Теоретическое введение и основные формулы
Давление насыщенного пара компонента идеального жидкого раствора рассчитывается по закону Рауля:
p1 = p10 x1 (1)
где р10 ─ давление насыщенного пара над чистым жидким компонентом (p10 является справочной величиной). Формула (1) справедлива только в том случае, если данный компонент является летучим неэлектролитом. Закон Рауля в данном виде может быть использован для расчета давления пара каждого из летучих компонентов раствора. Общее давление пара над раствором равно сумме парциальных давлений:
|
|
|
Робщ = р1 + p2 + …+ рi (2)
где р1 , р2 , … pi - парциальные давления пара летучих компонентов раствора.
Если же растворенное вещество является нелетучим неэлектролитом, то закон Рауля в случае бинарного раствора удобнее представить в виде:
 или
или
 =
=  (3)
(3)
где p1 - давление насыщенного пара летучего растворителя (например, воды) над раствором,
 - давление насыщенного пара над чистым жидким растворителем,
- давление насыщенного пара над чистым жидким растворителем,
х2 - мольная доля растворенного нелетучего вещества.
Задача 1.Покажите, что для раствора бензола в толуоле с массовой долей бензола 7,8% при 300С выполняется первый закон Гиббса-Коновалова. Давление насыщенного пара чистого бензола при 300С равно 120,2 мм рт.ст., чистого толуола − 36,7 мм рт.ст.
Решение. Согласно первому закону Гиббса-Коновалова пар над раствором обогащен более летучим компонентом, т.е. веществом, добавление которого повышает общее давление пара. В данном случае таким веществом является бензол, имеющий более высокое давление насыщенного пара. Рассчитаем состав пара над раствором. Поскольку бензол и толуол являются ближайшими органическими гомологами, раствор можно считать идеальным и использовать закон Рауля для летучих неэлектролитов. Согласно формуле (1), давление пара каждого из компонентов раствора равно
|
|
|
р1 = р  х1 ;
х1 ;
р2 = р  х2
х2
(1- бензол, 2 - толуол) .
Рассчитаем мольные доли компонентов в растворе:
масса бензола в 100 г раствора равна 7,8 г, тогда количество моль бензола составляет n1 = 7,8 / 78 = 0,10 моль, количество моль толуола n2 = 92,2 ¤ 92 = 1,01 моль. Мольные доли в растворе равны
x1 =  =
=  = 0,091 ;
= 0,091 ;
x2 = 1 - 0,091 = 0,909
Находим давление паров бензола и толуола
р1 = 120,2×0,091 = 10,94 мм рт.ст.; p2 = 36,7×0,909 = 33,36 мм рт.ст.
Общее давление пара над раствором:
Pобщ = 10,94 + 33,36 = 44,30 мм рт.ст.
Мольная доля бензола в парах равна
y1 =  = 10,94 / 44,30 = 0,25
= 10,94 / 44,30 = 0,25
Мольная доля бензола в парах больше мольной доли бензола в растворе (0,091), следовательно, первый закон Гиббса-Коновалова выполняется.
Задача 2. Рассчитайте давление пара при температуре 150С над водным раствором глюкозы с массовой долей 18%.
Решение. Глюкоза – нелетучий неэлектролит, поэтому давление пара над раствором будет создаваться парами летучего растворителя, т.е. воды. Следовательно, можно воспользоваться формулой (3), из которой выразим давление паров воды
 =
=  ( 1 - x2 )
( 1 - x2 )
Давление насыщенного пара чистой воды р  при 150C находим в справочнике [2] , оно составляет 12,79 мм рт.ст. При расчете мольной доли глюкозы х2 учтем, что в 100г раствора содержится 18г глюкозы и 82г воды ( 0,10 и 4,56 моль, соответственно), тогда
при 150C находим в справочнике [2] , оно составляет 12,79 мм рт.ст. При расчете мольной доли глюкозы х2 учтем, что в 100г раствора содержится 18г глюкозы и 82г воды ( 0,10 и 4,56 моль, соответственно), тогда
x2 = 0,10 / (0,10 + 4,56) = 0,018
Получаем  мм рт.ст.
мм рт.ст.
Для количественного описания жидких бинарных растворов используются диаграммы состояния в координатах температура - состав раствора (состав раствора может быть выражен в массовых или мольных долях) (рис.I). Точки на нижней кривой ncm соответствуют составу жидкой фазы в гетерогенном равновесии жидкость - пар при данной температуре. Точки на верхней кривой nam соответствуют составу пара в этом же равновесии при той же температуре.
Расчет количества равновесных фаз основан на правиле рычага. Если состав раствора выражен в мольных долях, то по правилу рычага отношение количества моль равновесных фаз при данной температуре равно
 ,
,
где  - количества моль пара и жидкости, соответственно,
- количества моль пара и жидкости, соответственно,
ab и bc - длины соответствующих отрезков.
Правило рычага можно записать также и в таком виде:
 , или
, или
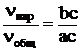
где  - общее количество моль компонентов системы.
- общее количество моль компонентов системы.
Если состав раствора на диаграмме выражен в массовых долях (или в масс.%), то в выражении для правила рычага вместо количества моль записывают соответствующие массы фаз:

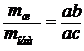 ;
; 
Задача 3. Имеется 1 кг раствора вещества А (молярная масса МА=32г/моль) в веществе В (молярная масса МВ=58,7 г/моль). Массовая доля вещества А в растворе равна 56%. Определить массу и состав фаз, образующихся в данной системе при температуре 600С. Диаграмма состояния системы приведена на рис I.
Решение. Состав раствора на диаграмме выражен в мольных долях, поэтому по правилу рычага можно рассчитать количества моль пара и жидкости в равновесии. Вначале находим количество моль каждого компонента в растворе:
Масса А равна
 г, отсюда
г, отсюда  моль
моль
Тогда для В
 г,
г,  моль.
моль.
Общее количество моль в системе равно:
 моль
моль
Мольная доля А в растворе равна
 (состав раствора соответствует точке b).
(состав раствора соответствует точке b).

По правилу рычага находим количество моль пара

(здесь длины отрезков для удобства выражены через величины мольных долей).
Отсюда
 2 моль.
2 моль.
Состав пара соответствует точке а. Следовательно, в паре мольная доля А равна 0,43 и мольная доля В - 0,56 . Массы А и В в паре равны
 128 г
128 г
 311 г
311 г
Масса пара равна 128 + 311 = 439 г.
Количество моль жидкости в равновесии равно
 моль
моль
Состав жидкости соответствует точке с: 0,86 мольных % А и 0,14 мольных % В, Отсюда массы А и В в жидкости равны
 г
г
 129 г
129 г
Масса жидкости равна 432 + 129 = 561 г.
(Проверка: общая масса жидкости и пара равна 561 + 439= 1000 г, т.е. равна массе исходной смеси - 1 кг)
Задача 4. а).Рассчитайте массу и состав фаз, образующихся при нагревании до 700С 200 г раствора вещества А в веществе В, в котором масса вещества А равна 80 г. Диаграмма состояния приведена на рис.II. б).Какую массу одного из компонентов системы необходимо добавить к исходному раствору, чтобы полученная смесь перегонялась без изменения состава? в). Каков состав первого пузырька пара, образующегося при нагревании исходного и полученного растворов?
Решение.
а). Для того, чтобы воспользоваться приведенной диаграммой состояния, рассчитываем массовую долю вещества А в растворе, поскольку на диаграмме состояния состав выражен в массовых процентах.


Фигуративной точкой, соответствующей состоянию исходного раствора при 700С является точка b . Вычисляем количество фаз по правилу рычага, которое в данном случае, когда состав раствора выражен в массовых процентах, можно записать как отношение массы фаз в виде:

Длины отрезков bc и ac выразим через разности соответствующих массовых долей, тогда при  г получим
г получим
 ,
,
отсюда масса пара  56,1 г.
56,1 г.
Находим по диаграмме состав пара, он соответствует точке a : содержание вещества А в паре 20%, следовательно, содержание вещества В в паре 80%.
Рассчитываем массу жидкой фазы:
 200
200  г
г
Состав жидкой фазы соответствует точке c на диаграмме: 48% вещества А и 52% вещества В.
б). Жидкий раствор перегоняется без изменения состава, когда состав жидкой фазы и пара одинаков. Такие растворы называются азеотропами. Согласно второму закону Гиббса-Коновалова состав пара и раствора совпадает в точках экстремумов на диаграммах состояния, следовательно, это фигуративные точки азеотропов. Состав азеотропа в данном случае соответствует точке A на диаграмме (60% вещества А). Поскольку в исходном растворе содержание вещества А меньше( массовая доля А равна 40%), поэтому к 200 г исходного раствора необходимо добавить вещество А для получения азеотропного раствора с массовой долей А, равной 60%. Рассчитаем добавляемую массу А из соотношения:
 ,
,
где  добавляемая масса А,
добавляемая масса А,
(200 + х) - полученная масса азеотропа.
Получаем  100, т.е. 100г вещества А необходимо добавить к исходному раствору для получения азеотропа.
100, т.е. 100г вещества А необходимо добавить к исходному раствору для получения азеотропа.
в).Начало закипания исходного раствора соответствует точке k на диаграмме. Температура начала закипания равна 580С, а состав пара находим по координатам точки p, лежащей на кривой пара. Это и будет состав первого пузырька пара ( массовая доля А в паре равна 13%).
Такие свойства разбавленных растворов неэлектролитов как понижение температуры кристаллизации DTкр, повышение температуры кипения DTкип и осмотическое давление p описываются соотношениями:
DTкр = Km2 (4)
DTкип = Em2 (5)
p = cRT (6)
где К - криоскопическая константа растворителя,
Е - эбулиоскопическая константа растворителя,
m2 - моляльная концентрация растворенного неэлектролита, которая рассчитывается по формуле:
 , (7)
, (7)
где n2 - количество моль растворенного вещества,
g1 - масса растворителя (г).
c - молярная концентрация растворенного неэлектролита.
Если с выражена в моль/л, то при R = 8,31 Дж/моль·К осмотическое давление в формуле (6) имеет размерность кПа. Поэтому, когда в задаче требуется определить концентрацию растворенного вещества по величине осмотического давления раствора, то давление необходимо перевести в кПа (получим концентрацию в моль/л) или в Па (концентрация будет в моль/м3)
Задача 5.Давление пара над водным раствором мочевины при 200С равно 17,19 мм рт.ст. Вычислить температуру кипения и осмотическое давление этого раствора.
Решение. Находим мольную долю мочевины в растворе по формуле (3) для нелетучих неэлектролитов. Давление пара чистой воды при 200С по справочнику [2] составляет 17,54 мм рт. ст., тогда

Примем количество моль воды в растворе n1 равным 1 моль и рассчитаем количество моль мочевины n2:
x2 =  , отсюда
, отсюда
 моль
моль
Если количество моль воды 1 моль, то масса воды равна g1 = 18 г и объем воды при плотности 1 г/см3 составляет 18 см3 или 0,018 л. Отсюда находим моляльность и молярность раствора мочевины :
 моль/кг,
моль/кг,
с2 = 0,0204 / 0,018 = 1,13 моль/л
Тогда
DTкип = Em2 = 0,514×1,13 = 0,310C,
отсюда температура кипения раствора
Ткип = 1000C + 0,31 = 100,310C
(константу Е для воды находим в справочной таблице на стр.40 этого задачника)
p = cRT = 1,13×8,31×293 = 2751,4 кПа.
Если по условию задачи криоскопическая или эбулиоскопическая константы растворителя неизвестны и требуется их рассчитать, то можно воспользоваться соотношениями:
Е =  , (8)
, (8)
K =  (9),
(9),
где  - молярная масса растворителя (г/моль),
- молярная масса растворителя (г/моль),
 и
и  - температуры кипения и плавления растворителя (К),
- температуры кипения и плавления растворителя (К),
 и
и  - молярные теплоты испарения и плавления растворителя (Дж/моль), (приведены в справочниках).
- молярные теплоты испарения и плавления растворителя (Дж/моль), (приведены в справочниках).
Когда в растворах протекают процессы диссоциации или ассоциации молекул растворенных веществ, приведенные выше формулы становятся непригодными, поскольку реальное количество частиц в растворе отличается от первоначального. Для описания свойств таких систем вводится изотонический коэффициент i , учитывающий влияние процессов диссоциации или ассоциации на отклонение от свойств растворов, где подобные процессы не наблюдаются. По физическому смыслу изотонический коэффициент равен отношению реального числа частиц растворенного вещества в растворе к первоначальному числу частиц.
Свойства растворов в данном случае описываются уравнениями:
DTкр = iKm2 (10)
DTкип = iEm2 (11)
p = icRT (12)
Изотонический коэффициент в растворах электролитов связан со степенью диссоциации 
 , или
, или  (13)
(13)
где n - количество ионов, образующихся при диссоциации одной молекулы электролита.
Когда растворенное вещество диссоциирует, то i > 1 , и, напротив, при ассоциации молекул i < 1.
Оценить, в каком состоянии − диссоциированном или ассоциированном, находятся молекулы вещества в растворе, можно, если рассчитать молекулярную массу растворенного вещества с помощью формул (4), (5), (6), т.е. без использования изотонического коэффициента i. В этом случае расчет молярной массы дает заниженное значение при диссоциации молекул, и, наоборот, при ассоциации молекул в растворе рассчитанная молярная масса получается завышенной.
В полярных растворителях растворенные вещества с полярными молекулами являются электролитами, а вещества с неполярными молекулами чаще проявляют свойства неэлектролитов. В малополярных растворителях растворенные вещества с полярными молекулами обычно находятся в частично ассоциированном состоянии.
Задача 6.Водный раствор раствор трифторуксусной кислоты с массовой долей кислоты 10% кристаллизуется при –2,540С. Покажите, что данное вещество в водном растворе не является слабым электролитом.
Решение. Рассчитаем степень диссоциации  кислоты по формуле (13).
кислоты по формуле (13).
Для этого находим изотонический коэффициент, используя формулу (10):
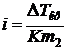
Моляльную концентрацию трифторуксусной кислоты  находим, предполагая массу раствора 100 г. Тогда масса кислоты 10 г, количество моль кислоты 10 ¤ 114 = 0,087 моль, масса воды 90 г. Mоляльность кислоты равна
находим, предполагая массу раствора 100 г. Тогда масса кислоты 10 г, количество моль кислоты 10 ¤ 114 = 0,087 моль, масса воды 90 г. Mоляльность кислоты равна
 моль / кг;
моль / кг;
 ; где
; где

Находим  по формуле (13), причем n = 2 , т.к. при диссоциации кислоты образуется два иона :
по формуле (13), причем n = 2 , т.к. при диссоциации кислоты образуется два иона :
СF3СOOH ® CF3COO - + H+
Получаем
 или 40%.
или 40%.
Следовательно, трифторуксусная кислота в водном растворе приближается по свойствам к сильным электролитам.
Задача 7.Раствор, содержащий 4,40 г пировиноградной кислоты CH3-CO-COOH в 100 г бромбензола кристаллизуется при -32,980С. В каком состоянии - диссоциированном или ассоциированном, находятся молекулы пировиноградной кислоты в растворе.
Решение.Находим молярную массу пировиноградной кислоты M2 в растворе по понижению температуры кристаллизации раствора.
Температура кристаллизации чистого бромбензола по справочнику [1] равна  = -30,820С или 242,33К. Рассчитаем криоскопическую константу бромбензола, поскольку ее нет в справочной таблице на стр.49.
= -30,820С или 242,33К. Рассчитаем криоскопическую константу бромбензола, поскольку ее нет в справочной таблице на стр.49.
Cогласно формуле (9)


(здесь молярная теплота плавления бромбензола  Дж/моль по справочнику [1] , молярная масса бромбензола
Дж/моль по справочнику [1] , молярная масса бромбензола  157,03 г/моль).
157,03 г/моль).
Понижение температуры кристаллизации раствора равно
 =
=  ;
;
 = -30,82-(-32,98) = 2,160С
= -30,82-(-32,98) = 2,160С
Рассчитаем моляльную концентрацию кислоты по формуле (4):
 ,
,
 2,16 ¤ 7,22 = 0,30 моль/кг.
2,16 ¤ 7,22 = 0,30 моль/кг.
Отсюда из формулы (7) находим молярную массу пировиноградной кислоты в растворе:
 =
=  г/моль
г/моль
(здесь  - масса растворителя, т.е. бромбензола;
- масса растворителя, т.е. бромбензола;  - масса пировиноградной кислоты). Полученное значение больше истинной молярной массы пировиноградной кислоты (88 г/моль), следовательно, ее молекулы в растворе образуют ассоциаты.
- масса пировиноградной кислоты). Полученное значение больше истинной молярной массы пировиноградной кислоты (88 г/моль), следовательно, ее молекулы в растворе образуют ассоциаты.
Вариант 1
Задание 1. Какая масса кофеина (C8H10O2N4) растворена в 200 мл воды, если давление пара раствора на 0,1% ниже давления пара чистой воды?
Задание 2. При какой температуре начнет замерзать раствор, содержащий 250 г воды и 0,5 г аспирина (ацетилсалициловой кислоты – CH3COOC6H4COOH)?
Задание 3. При 200С осмотическое давление раствора, в 100 мл которого содержится 6,33 г красящего вещества крови - гематина, равно 243,4 кПа. Определить молекулярную массу гематина.
Задание 4. При 1000С давление пара раствора, содержащего 0,05 моль сульфата натрия в 450 г воды равно 100,8 кПа. Определить кажущуюся степень диссоциации сульфата натрия.
Вариант 2
Задание 1. Давление пара в комнате над чистой водой 24 мм рт.ст. Каким будет давление пара над поверхностью воды в стакане, если в воду (160 мл) добавить 20 г сахара (С12Н22О11).
Задание 2. В радиатор автомобиля залили 10 л воды и прибавили 2 л этиленгликоля (r=1,109 г/мл). При какой самой низкой температуре можно оставлять автомобиль на открытом воздухе зимой?
Задание 3. Раствор дуриловой кислоты в ацетоне, 1 мл которого содержит 0,0148 г этой кислоты, изотоничен с 0,09 М водным раствором сахара (при 200С). Вычислите молекулярную массу дуриловой кислоты.
Задание 4. Раствор, содержащий 0,71 г гидрофосфата натрия (Na2HPO4) в 200 г воды, кристаллизуется при -0,110С. Определить кажущуюся степень диссоциации гидрофосфата натрия.
Вариант 3
Задание 1. Рассчитать общее давление пара при 800С над 678 г смеси бромбензола и иодбензола, если в смеси содержится 188,4 г бромбензола. Определите мольную долю бромбензола в парах. При 800С давление пара чистого бромбензола равно 60 мм рт. ст., чистого иодбензола - 22 мм рт. ст.
Задание 2. 1,06%-ный раствор кумаровой кислоты в этаноле кипит при температуре 78,470С. Вычислите молярную массу кумаровой кислоты.
Задание 3. Осмотическое давление раствора миндальной кислоты в уксусной кислоте при температуре 200С равно 2,403 атм. Найдите давление пара этого раствора, если давление чистой уксусной кислоты при этой температуре равно 12 мм рт.ст. (плотность раствора примите равной плотности чистой уксусной кислоты 1,372 г/мл).
Задание 4. В медицинской практике используют раствор хлорида натрия изотоничный крови человека. Это так называемый физиологический раствор (0,9 % хлорида натрия). Рассчитайте осмотическое давление крови (плотность раствора хлорида натрия приблизительно равна 1 г/мл; степень диссоциации хлорида натрия 100%).
Вариант 4
Задание 1. Чему равно внешнее давление, если водный раствор, в котором мольная доля мальтозы равна 0,043, начинает кипеть при 1010С. Для чистой воды при 1010С давление пара составляет 105 кПа. (При решении задачи учесть, что условием закипания раствора является равенство давления пара над раствором внешнему давлению).
Задание 2. Давление пара водного раствора маннита при 280С равно 28,01 мм рт.ст. Давление пара воды при той же температуре 28,07 мм рт.ст. Каковы температуры замерзания и кипения этого раствора?
Задание 3. Осмотическое давление раствора, содержащего 1,00 г фермента химотрипсина в 100 мл воды равно 994 Па при 270С. Вычислите молярную массу химотрипсина.
Задание 4. Вычислите температуру замерзания раствора, содержащего 7,308 г хлорида железа (III) в 250 г воды, если при 200С осмотическое давление этого раствора 1,408×106 Па (плотность раствора ~1 г/см3). Какова эффективная степень диссоциации хлорида железа (III) в этом растворе?
Вариант 5
Задание 1.При 200С давление паров воды равно 17,535 мм рт. ст. Вычислить давление паров над раствором, содержащим 9 г глюкозы в 180 г воды при той же температуре.
Задание 2. Раствор, содержащий 0,345 г ацетанилида С6Н5ONHC2 H 3 в 25 г фенола, кристаллизуется при температуре 40,240С. Определить криоскопическую постоянную и теплоту плавления фенола, если температура плавления его равна 41,00С.
Задание 3. Осмотическое давление концентрированного раствора сахарозы в воде при 370С равно 50 атм. Чему равно давление пара этого раствора, если давление пара чистой воды при этой температуре равно 46,648 мм рт. ст.?
Задание 4.Какова должна быть концентрация (моль/л) раствора глюкозы, чтобы этот раствор был при 180С изотоничен с раствором, содержащим 0,1 моль/л хлорида кальция, если степень диссоциации соли при указанной температуре составляет 75,2%?
Вариант 6
Задание 1. При температуре 298 К давление паров воды равно 23,756 мм рт. ст. Рассчитайте давление паров над водным раствором, содержащим 12 г мочевины (NH2)2CO (нелетучий неэлектролит) в 180 г воды.
Задание 2. Раствор, содержащий 0,4896 г камфоры в 21,38 г ацетона, кипит при температуре 56,550С. Температура кипения чистого ацетона равна 56,300С, молекулярная масса камфоры равна 152 г/моль. Определите эбулиоскопическую постоянную и теплоту испарения ацетона.
Задание 3.Рассчитайте осмотическое давление раствора, содержащего 0,624 г мочевины в 400 г воды при 250C.
Задание 4.Водный раствор, содержащий в 100 г воды 1,010 г KNO3 , закипает при 100, 0950С. Определить степень диссоциации КNO3 .
Вариант 7
Задание 1.Давление паров диэтилового эфира при 250С равно 537 мм рт. ст. Рассчитайте давление пара раствора, содержащего 2 г бензальдегида в 100 г эфира при этой температуре.
Задание 2. Температура затвердевания чистого бензола равна 5,500С, температура кристаллизации раствора, содержащего 0,2487 г камфоры в 30,55 г бензола равна 5,250С. Определите молекулярную массу камфоры.
Задание 3.Осмотическое давление концентрированного водного раствора сахара при 250С равно 100 атм. Определите массу сахара в 1 л этого раствора.
Задание 4.Дихлоруксусная кислота обратимо диссоциирует в водных растворах. Водные растворы, содержащие 0,1 и 0,01 моль/л дихлоруксусной кислоты, имеют соответственно температуры замерзания –0,2780С и –0,0330С. Чему равна степень диссоциации дихлоруксусной кислоты в каждом из этих растворов?
Вариант 8
Задание 1. Раствор гликокола, содержащий 1,5 г гликокола в 100 г воды, имеет давление пара такое же, как и 6,35% раствор сахара (C12H22O11). Определить молекулярную массу гликокола, приняв, что это нелетучий неэлектролит.
Задание 2. Нафталин плавится при 80,100С. При растворении 0,1110 г антраниловой кислоты (М=137,12 г/моль) в 20 г нафталина температура плавления смеси стала равной 79,820С. Вычислить криоскопическую константу нафталина.
Задание 3.При 00С давление пара воды равно 4,579 мм рт. ст.. а давление пара разбавленного раствора мочевины равно 4,509 мм рт. ст. Вычислите осмотическое давление этого раствора при 370С.
Задание 4. Раствор, содержащий 1,141 г трифторуксусной кислоты в 0,1 кг бензола, кристаллизуется на 0,2530С ниже, чем чистый бензол. Раствор, содержащий столько же трифторуксусной кислоты в 0,1кг воды, кристаллизуется на 0,2700С ниже, чем чистая вода. В каком состоянии, диссоциированном или ассоциированном находится кислота в этих растворах. Определите степень диссоциации трифторуксусной кислоты и количество молекул трифторуксусной кислоты в ассоциате.
Вариант 9
Задание 1. Давление пара над чистой ртутью при данной температуре 709 мм рт.ст. Сколько золота нужно растворить в 50 г ртути, чтобы давление пара ртути понизилось от 709 до 700 мм рт.ст.?
Задание 2. Этиленгликоль в качестве антифриза используют в смеси с водой для заполнения радиаторов автомобилей. Какой объем этиленгликоля (r=1,109 г/см3) посоветовали бы Вы залить в радиатор, содержащий 5 кг воды, если по метеопрогнозу ночью ожидается понижение температуры до -100С?
Задание 3. Сколько граммов глюкозы нужно добавить к 500 г воды, чтобы полученный раствор был изотоничен плазме крови? Плазма крови замерзает при -0,560С. Плотности растворов в задаче принять ~1 г/мл.
Задание 4. При какой температуре будет кипеть и замерзать морская вода? Состав морской воды: хлорид натрия 20 г/л, сульфат магния 3 г/л, хлорид магния 2 г/л. Плотность морской воды 1,05 г/мл. Степень диссоциации солей принять 100%, для хлорида магния – 95%.
Вариант 10
Задание 1. При 1400С давление паров хлорбензола (C6H5Cl) равно 939 мм рт.ст., а давление пара бромбензола (C6H5Br) - 97 мм рт.ст. Приняв, что эти вещества образуют идеальный раствор, определить состав раствора, кипящего при 1400С (внешнее давление 1 атм) и состав равновесного с ним пара. При решении задачи необходимо учесть, что раствор кипит, когда общее давление пара над раствором и внешнее давление одинаковы
Задание 2. Температура замерзания разбавленного водного раствора уротропина -10С. Давление пара чистой воды при этой температуре 4,216 мм рт.ст. Определить давление пара раствора уротропина.
Задание 3. Почему при купании в пресной воде, если долго находиться под водой с открытыми глазами, в глазах ощущается дискомфорт? Рассчитайте осмотическое давление воды на глаз при 200С, если условный состав тканевой жидкости ~0,9 % водный раствор хлорида натрия. Принять плотность раствора 1 г/мл, степень диссоциации 100%.
Задание 4. Будут ли различаться по температуре кипения растворы глицерина и сульфата калия одинаковой моляльной концентрации (допустим, 0.005 моль/кг). Ответ подтвердите расчетами.
Вариант 11
Задание 1. Под небольшим стеклянным колпаком находятся два стакана. В первоначальный момент времени в одном из них находится раствор глюкозы в 18 мл воды, а в другом – раствор нелетучего неэлектролита в 18 мл воды. Массы глюкозы и неэлектролита одинаковы. Через некоторое время, когда установилось равновесие, раствор с неизвестным веществом стал легче на 5,586 г. Определить молекулярную массу неэлектролита.
Задание 2.Раствор, содержащий 3,60 г алкана в 200 г бензола, кристаллизуется при температуре 1,580С. Каким изотопом водорода образован исследуемый алкан?
Задание 3. Сколько хлорида натрия необходимо добавить к 1 л воды, чтобы осмотическое давление могло поднять столбик воды на высоту 500 м ?
Задание 4. Чтобы предотвратить образование льда на дорогах, на них разбрасывают соль, и лед быстрее тает, вследствие понижения температуры кристаллизации. Какую из солей экономически более выгодно разбрасывать на дорогах: хлорид натрия, хлорид кальция, тетрахлороаурат (III) натрия (Na[AuCl4])? Стоимость солей в данном регионе составляет 0,6; 0,46; 2500 долларов за 100 г вещества, соответственно.
Вариант 12
Задание 1.Давление паров раствора, содержащего 20 г бензальдегида в 100 г диэтилового эфира, при температуре 200С равно 403 мм рт. ст. Давление паров чистого диэтилового эфира при этой температуре равно 442 мм рт. ст. В каком состоянии – диссоциированном или ассоциированном находится бензальдегид в данном растворе?
Задание 2. Фенол в растворе циклогексанона находится в частично димеризованном состоянии. Раствор, содержащий 100 г циклогексанона и 2,58 г фенола, кристаллизуется при температуре -2,370С. Рассчитайте состав раствора в мольных долях и определите константу равновесия (также в мольных долях) процесса димеризации.
Задание 3. Осмотическое давление водного раствора сыворотки бычьего альбумина 0,02 г/мл составляет 6,1 мм рт.ст. при 200С. Оцените молярную массу этого белка.
Задание 4. Внутренние растворы обитателей моря изотоничны с морской водой. У акул концентрация солей в крови ниже, чем в морской воде. Однако изотоничность крови акул с морской водой сохраняется, поскольку недостаток солей компенсируется значительной концентрацией мочевины, образующейся в результате распада белковых веществ. Рассчитать массу мочевины в 1 л крови акулы, исходя из следующих данных: масса хлорида натрия в 1 л крови 11 г; состав морской воды: хлорид натрия 20 г/л, хлорид магния 3,2 г/л, сульфат магния 2,0 г/л. Плотность всех растворов принять 1 г/мл, степень диссоциации солей 100%.
Вариант 13
Задание 1. Давление пара диэтилового эфира при 150С равно 360,7 мм рт. ст., а давление пара раствора, содержащего 10 г бензальдегида в 100 г эфира, равно 335,5 мм рт. ст. Вычислить молекулярную массу бензальдегида.
Задание 2. Для идентификации фтороуглерода, имеющего предположительный состав CF3(CF2)3CF3 или CF3(CF2)4CF3 произвели следующий опыт: 6,76 г вещества растворили в 200 г расплавленной камфоры и измерили температуру кристаллизации полученного раствора. Она оказалась равной 174,5 0С. Криоскопическая постоянная камфоры равна 40 К / моль∙кг. Определите состав исследуемого фтороуглерода.
Задание 3. Сколько граммов глицерина следует растворить в 1 л воды, чтобы осмотическое давление этого раствора при 170С было равно 4 атм ?
Задание 4.Раствор, содержащий 0,66 г уксусной кислоты на 100 г воды, замерзает при -0,210С. Покажите, что уксусная кислота является слабым электролитом.
Вариант 14
Задание 1. В 39,0 г диметилсульфоксида (СН3)2SO (сильно ионизирующий растворитель) растворили 3,231 г хлорида лития, образованного изотопом Cl35. Давление пара над раствором после этого понизилось на столько же, как и при растворении в том же количестве диметилсульфоксида 3,385 г хлорида лития, образованного другим изотопом хлора. Каким изотопом хлора образована соль в последнем случае?
Задание 2. Раствор, содержащий 0,755 г алифатического кетона в 100 г ледяной уксусной кислоты кристаллизуется при температуре 16,240С. Определите строение кетона. Необходимые данные приведены в справочной таблице.
Задание 3. Вода с растворенными питательными веществами проникает в растения под действием осмотического давления, развиваемого корневой системой. У канадского сахарного клена весной при температуре 70С осмотическое давление достигает 3,6 атм. Если принять, что основное растворенное вещество - сахар, то при какой температуре замерзнет кленовый сок? (Плотность раствора 1,03 г/мл). Сколько сахара можно получить из 1 л сока?
Задание 4. Кристаллы розеосоли имеют состав CoCl3 ×5NH3, а кристаллы пурпуреосоли - CoCl3×5NH3×H2O. Эти вещества относятся к комплексным солям. Установить строение внутренней и внешней сферы комплексов, если известно, что добавление 1 г розеосоли к 500 мл воды понижает температуру замерзания на 0,0450С, тогда как пурпуреосоль в тех же условиях понижает температуру замерзания на 0,0560С. Принять, что диссоциация комплексов на ионы внутренней и внешней сферы протекает полностью.
Вариант 15
Задание 1. При 900С давление пара толуола равно 400 мм рт.ст., давление пара о-ксилола равно 150 мм рт. ст. Учитывая, что жидкость закипает, когда общее давление паров над ней равно внешнему давлению, рассчитайте состав жидкой смеси указанных компонентов, которая будет кипеть при температуре 900С и внешнем давлении 0,5 атм.
Задание 2.Температура кипения чистого сероуглерода равна 46,2000С. В 50 г сероуглерода растворяют 0,9373 г бензойной кислоты. Полученный раствор имеет температуру кипения равную 46,3870С. Определите молекулярную массу бензойной кислоты в сероуглероде и объясните полученный результат. (Сделать предположение о состоянии молекул бензойной кислоты в малополярном растворителе).
Задание 3.При 00С давление паров воды равно 4,579 мм рт. ст. При этой же температуре давление пара разбавленного раствора карбамида (NH2)2CO, являющимся нелетучим неэлектролитом, равно 4,509 мм рт. ст. Вычислите осмотическое давление этого раствора при 370С.
Задание 4.Давление пара 0,2 М раствора сульфата магния равно 23,660 мм рт. ст. при 250С. Давление паров чистой воды при этой температуре равно 23,756 мм рт. ст. Рассчитайте навеску растворенной соли, температуру замерзания, температуру кипения и осмотическое давление раствора.
Вариант 16
Задание 1. При 300С давление паров чистого бензола равно 120,2 мм рт.ст., а толуола - 36,7 мм рт.ст. Каков состав имеет парообразная фаза (в молярных %), если жидкость содержит эквимолярные количества этих компонентов?
Задание 2. При растворении 5,12 г серы в 100 г бензола температура кипения раствора увеличилась на 0,5250С. Каков состав молекулы серы в растворе? Недостающие данные для расчета эбулиоскопической константы найдите в справочнике.
Задание 3. Плазма крови утконоса замерзает при -0,510С. Каково ее осмотическое давление при 340С, измеренное с помощью мембраны, проницаемой только для воды? Плотность плазмы принять 1 г/мл.
Задание 4. Водный раствор глюкозы (1,2 моль/л) при 200С изотоничен раствору хлорида кальция (0,5 моль/л). Рассчитайте эффективную степень диссоциации хлорида кальция.
Вариант 17
Задание 1. Этанол и метанол образуют практически идеальный раствор. При 200С давление пара этанола 44,5 мм рт.ст., а давление пара метанола 88,7 мм рт.ст. Рассчитать: а) парциальное давление и общее давление пара раствора, если смешивают по 100 г каждого компонента; б)мольную долю метанола в паре.
Задание 2. Анализом установлено, что эмпирическая формула вещества (СН2О)n. Раствор этого соединения, содержащий 1 г вещества в 100 г воды, замерзает при температуре -0,1240С. Определите точную формулу вещества.
Задание 3. Осмотическое давление водного раствора гемоглобина, содержащего 3,2 г гемоглобина в 100 мл раствора при 170С, равно 32,8 мм рт.ст. При какой температуре замерзнет этот раствор? (Плотность раствора принять 1 г /мл.) Какова молярная масса гемоглобина?
Задание 4. Солевой состав морской воды выражается следующим образом (моль/л): хлорид натрия - 0,46; хлорид магния - 0,034; сульфат магния - 0,019; сульфат кальция - 0,009. Рассчитайте осмотическое давление морской воды при 200С. Все соли диссоциированы на 100%.
Вариант 18
Задание 1. Дибромэтилен и дибромпропилен образуют идеальный раствор. Давление пара чистых дибромэтилена 172 мм рт.ст., дибромпропилена - 127 мм рт.ст. Определить: а) состав пара в равновесии с раствором, где мольная доля дибромэтилена 0,75; б) состав жидкости, которая будет в равновесии с паром, содержащим 0,5 мольных долей дибромэтилена.
Задание 2. Температура кипения сероуглерода (CS2) 46,130С. В какой молекулярной форме находится белый фосфор, растворенный в сероуглероде, если раствор, содержащий 2,12 г фосфора в 100 г сероуглерода, кипит при 46,530С?
Задание 3. Осмотическое давление водного раствора сывороточного альбумина, содержащего 49,11 г вещества на 1 л раствора, составляет 0,02 атм при 250С. Определить молекулярную массу альбумина.
Задание 4. Водный раствор нитрата тория Th(NO3)4, содержащий 4,32 г вещества на 1 л воды, замерзает при -0,07030С. Рассчитайте кажущуюся степень диссоциации соли.
Вариант 19
Задание 1. При 500С давление пара бензола равно 35,86 кПа, а давление пара бромбензола - 2,27 кПа. Сколько бензола (масс. %) в парах над раствором, в котором мольная доля бензола 0,5?
Задание 2. Водный раствор алифатического спирта, содержащий 6,55 г вещества на 500 мл воды, замерзает при -0,530С. О каком спирте идет речь? Какова будет массовая доля спирта в водном растворе, если температура замерзания этого раствора равна -26,960С?
Задание 3. При 250С давление воды равно 23,75 мм рт.ст., а давление пара разбавленного раствора молочного сахара (С12Н22О11) - 23,68 мм рт.ст. Определите осмотическое давление этого раствора при 350С.
Задание 4. Какова концентрация (в масс. %) физиологического раствора хлорида натрия, применяемого для внутривенных инъекций, если этот раствор изотоничен крови при температуре человеческого тела? Осмотическое давление крови 7,744×105 Па. Степень диссоциации хлорида натрия 0,96.
Вариант 20
Задание 1. Давление пара этанола при 600С равно 350 мм рт.ст. При добавлении к 100 г этанола 5 г триметина (противосудорожное средство) давление пара упало до 344 мм рт.ст. Рассчитайте молекулярную массу триметина.
Задание 2. На рис. 9 приведена диаграмма: температура кипения - состав бинарного раствора. Рассчитайте, какое минимальное количество вещества А нужно добавить к раствору, полученному смешением 160 г вещества В и 40 г вещества А, чтобы при t=1100С в системе не содержалось жидкой фазы. Каковы будут массы равновесных фаз при t=1100С, если не добавлять вещество А?
Задание 3. При растворении 1,4511 г дихлоруксусной кислоты в 56,87 г четыреххлористом углероде (ССl4), раствор закипает при 77,270С. Точка кипения чистого четыреххлористого углерода 76,750C. Каков кажущийся молекулярный вес кислоты? Чем объяснить расхождение с истинным молекулярным весом?
Задание 4. Температура кристаллизации водного раствора сахара равна -0,2160С. Вычислите осмотическое давление раствора при температуре -0,20С. (Плотность раствора 1,01 г/см3).
Задание 5. Раствор, содержащий 1,5 г хлорида калия в 100 г воды, замерзает при -0,6840С. Определите кажущуюся степень диссоциации хлорида калия в растворе, а также давление паров воды над этим раствором при 250С (давление насыщенного пара воды при 250С найдите в справочнике).
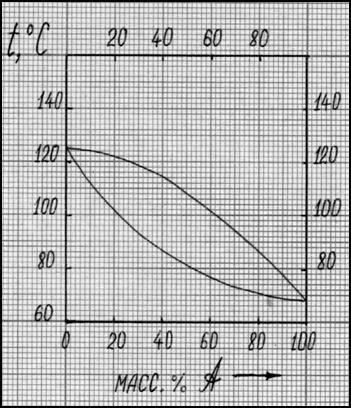
Рис. 9. Диаграмма состояния системы
А - В
Вариант 21
Задание 1. Давление пара водного раствора мальтозы (нелетучее вещество) на 2% ниже давления пара чистой воды. Определите моляльность раствора.
Задание 2. На рис. 7 приведена диаграмма состояния системы диэтиловый эфир - четыреххлористый углерод (С2Н5ОС2Н5 - ССl4). а) Каков состав первой и последней порции конденсата, образующегося при охлаждении пара, содержащего 40% ССl4? б) Определите массы и составы пара и жидкости, если 1 кг раствора, содержаний 30 мольн. % ССl4, нагреть до 600С; в) определите, какой компонент можно выделить путем фракционной перегонки этого раствора ; г)Объясните, можно ли считать данную систему идеальной.
Задание 3. Температура кипения диэтилового эфира 34,600С. В 50 г эфира растворили 0,9373 г яблочной кислоты НООС-СН(ОН)-СН2-СООН. Полученный раствор кипит при 34,740С. Определить молекулярную массу яблочной кислоты. Почему результат кажется странным только на первый взгляд?
Задание 4. Растворы, вводимые внутривенно, должны быть изотоничны крови. Сыворотка крови замерзает при -0,560С. Предполагая, что понижение температуры кристаллизации сыворотки по сравнению с водой обусловлено, в основном, содержанием хлорида натрия, рассчитать массы веществ, необходимых, чтобы приготовить 1 л раствора для инъекций: а) глюкозы; б) хлорида натрия; в) хлорида кальция. (Степени диссоциации равны: NaCl -100%, CaCl2 - 90%).
Задание 5. Как объяснить, что при добавлении 0,01 моль хлорида алюминия к 1 кг бензола понижение температуры замерзания в два раза меньше, чем при добавлении 0,01 моль ацетона? Как изменится ситуация, если бензол заменить водой? Рассчитайте понижение температуры кристаллизации во всех этих системах (состояние молекул ацетона в бензоле и воде одинаково).

Рис.7. Диаграмма состояния системы
CCl4 - C2Н5ОС2Н5
Вариант 22
Задание 1. Определить плотность пара (г/л) раствора, образованного смешением 31,2 г бензола с 55,2 г толуола при 300С. Давление пара бензола при 300С равно 120,2 мм рт. ст., давление пара толуола 36,7 мм рт. ст.
Задание 2. На рис. 10 приведена диаграмма состояния системы этиловый спирт - четыреххлористый углерод. а) Рассчитайте какое минимальное количество этилового спирта необходимо добавить к раствору, полученному смешением 308 г четыреххлористого углерода и 23 г этилового спирта, чтобы полученный раствор перегонялся без изменения состава? б) Что будет представлять собой раствор, полученный смешением 77 г четыреххлористого углерода и 92 г этилового спирта, при 72,50С . Рассчитайте массу и состав фаз.
Задание 3. Техническая уксусная кислота кристаллизуется при 16,40С. Температура кристаллизации чистой уксусной кислоты 16,70С. Определить содержание примесей в кислоте (в мольн.%).
Задание 4. Раствор, содержащий 16 г гемоглобина в 500 мл воды и 0,062%-ный водный раствор сахара изотоничны при 170С. При какой температуре будет замерзать раствор гемоглобина? Какова молярная масса гемоглобина?
Задание 5. Каково осмотическое давление раствора, содержащего 13,2 г сульфата аммония в 1 л воды, при 270С, если этот раствор кипит при 373,15 К? Рассчитайте кажущуюся степень диссоциации соли.
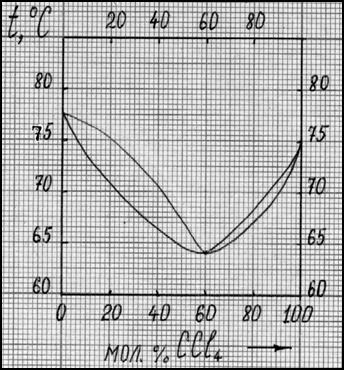
Рис. 10. Диаграмма состояния системы
С2H5OH - CCl4
Вариант 23
Задание 1. При 500С давление пара бензола равно 35,86 кПа, давление пара дихлорэтана 31,46 кПа. Каково должно быть внешнее давление, чтобы раствор, содержащий равные весовые количества обоих компонентов, кипел при 500С. Каков состав пара при этом?
Задание 2. На рис. 10 приведена диаграмма состояния системы С2Н5ОН-ССl4. а) При какой температуре полностью исчезнет жидкая фаза в процессе нагревания системы, содержащей равные массы этилового спирта и четыреххлористого углерода? б) Смесь спирта и ССl4 начинает кипеть при 700С. Каков состав этой смеси, если при добавлении к ней нескольких мл спирта температура начала кипения понизилась? в) Сколько спирта перейдет в пар, если смесь, содержащую 4 моль ССl4 и 6 моль спирта, нагреть до 680С?
Задание 3. Чистый кадмий затвердевает при 321,00С, а 10%-ный раствор висмута в кадмии при 312,80С. Определить теплоту плавления кадмия.
Задание 4. Водный раствор желатина (5 г/л) при t=100С имеет осмотическое давление 3,27 мм рт.ст., а при t=500С осмотическое давление равно 13,20 мм рт. ст. В чем здесь может быть дело? Ответ сопроводите расчетом.
Задание 5. Имеется два раствора, где в равных количествах воды растворено в одном из растворов 0,5 моль сахарозы, а в другом - 0,2 моль СаСl2. Температуры кристаллизации растворов одинаковы. Определить кажущуюся степень диссоциации хлорида кальция.

Рис. 10. Диаграмма состояния системы
С2H5OH - CCl4
Вариант 24
Задание 1. Точка кипения четыреххлористого углерода при атмосферном давлении равна 760С. Энтальпия испарения ССl4 равна 196,5 Дж/г. Определить: а) давление пара чистого ССl4 при 720С; б) состав пара над раствором, содержащим 0,93 мольных долей ССl4 (остальное СS2), если температура кипения раствора составляет 720С при атмосферном давлении. Недостающие данные возьмите из справочника.
Задание 2. На рис. 11 приведена диаграмма состояния системы азотная кислота - вода (HNO3-H2O). а) Каков в пределе будет дистиллята а после длительной перегонки смеси, содержащей 80 мольн.% HNO3? б) Какое количество одного из компонентов необходимо добавить к 10 кг раствора, содержащего 30 мольн.% воды, чтобы для полученная смесь перегонялась без изменения состава в) Какова масса и состав пара, если 10 кг раствора, содержащего 30 мольн.% Н2О, нагрели до 1150С?
Задание 3. Несколько граммов вещества, растворяясь в 100 г бензола, понижают точку замерзания раствора на 1,2890С. То же количество вещества в 100 г воды понижают точку замерзания на 1,3950С. Вещество в бензоле не диссоциирует, а воде полностью диссоциировано. На сколько ионов распадается его молекула в воде?
Задание 4. При добавлении небольшого количества неэлектролита к воде получается раствор с осмотическим давлением 0,67 атм при 200С. Добавление той же массы этого неэлектролита к хлороформу, масса которого равна массе воды в первом опыте, дает раствор, кипящей на 0,1050С выше чистого хлороформа. Рассчитайте теплоту испарения хлороформа и сравните со справочными данными.
Задание 5. Определите температуру кристаллизации, кипения и давление паров воды над 0,75% раствором хлоруксусной кислоты при 250С. Степень диссоциации кислоты 13%, недостающие данные найдите в справочнике.

Рис. 11. Диаграмма состояния системы
H2O - HNO3
Вариант 25
Задание 1. Мольная доля фруктозы (С6Н12О6) в водном растворе равна 0,07. Определить коэффициент активности воды в этом растворе при 298 К, если давление насыщенного пара над раствором равно 26,17×102 Па. Недостающие данные взять из справочника.
Задание 2. На рисунке 12 приведена диаграмма состояния хлорид натрия - вода (NаСl - H2O). Укажите: а) температуру, при которой начнет замерзать 10% раствор хлорида натрия и температуру, при которой он полностью замерзнет; б) число и состав фаз в начале и конце кристаллизации этого раствора; в) можно ли получить пресную воду замораживанием 10 кг раствора с концентрацией хлорида натрия: 1) 5%; 2) 25%; 3) 27%; г) сколько пресной воды максимально можно получить из выбранного раствора; д) каков состав кристаллов, выпадающих при кристаллизации указанных растворов. На приведенной диаграмме формулы у стрелок соответствуют составу выпадающих кристаллов.
Задание 3. При растворении 0,202 г семикарбазида в 115 г воды температура кипения повышается на 0,0120С. При растворении 0,051 г этого же вещества в 40 г этанола температура кипения повышается на 0,0210С. Рассчитайте эбулиоскопическую константу этанола, если эбулиоскопическая константа воды известна (0,514).
Задание 4. Раствор нитроцеллюлозы в нитробензоле при 100С имеет осмотическое давление 0,023 мм рт.ст. (концентрация 0,1 г/л) и 0,46 мм рт. ст. (концентрация 2 г/л). В то же время растворы нитроцеллюлозы в ацетоне при 100С и тех же концентрациях имеют осмотические давления 0,023 и 0,64 мм рт. ст., соответственно. Определите молярную массу нитроцеллюлозы и сделайте предположение о процессах ассоциации в одном из растворов.
Задание 5. Когда клетки скелетных мускулов лягушки помещают в растворы хлорида натрия различной концентрации, в микроскоп можно наблюдать, что в 0,7 % растворе хлорида натрия клетки остаются неизменными, в более концентрированных они сморщиваются, в менее концентрированных - набухают. Рассчитать давление на стенки клетки в чистой воде при комнатной температуре 200С.

Рис. 12. Диаграмма состояния системы H2O - NaCl
Справочная таблица.
Дата добавления: 2018-02-15; просмотров: 3815; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
