Вторичный активный транспорт ионов.
Ф КГМУ 4//-05/04
ИП №6 ОТ 14 июня 2007 г.
Карагандинский медицинский университет
Кафедра информатики и биостатистики
Методические рекомендации для практических занятий
Тема: Биофизика мембран.
Дисциплина: OODO12 МВ 1112 медицинская биофизика
Специальность: 5В130100-«Общая медицина»
Курс: I
Составитель: Мхитарян К.Э., Пашев И.В., Коршуков И.В.
Время (продолжительность) 2 ч.
Караганда 2019
Обсуждены и утверждены на заседании кафедры
Протокол № __ от «___»__________20__ года
зав. кафедрой __________ Койчубеков Б.К.
Тема: «Биофизика мембран».
Цель занятия: знать основные методы исследования структуры и функций биологических мембран, уметь различать физико-химические механизмы транспорта веществ через клеточные мембраны.
Задачи обучения.
· основные термины и определения, используемые в биофизике мембран.
· история развития моделей мембран.
· современные представления о структуре и функциях мембран
· основные методы применяемых при изучении структуры мембран (рентгеноструктурный анализ, электронное микроскопирование, применение флуоресцентных зондов, ЯМР, ЭПР).
· связь между предлагаемыми моделями мембран и экспериментальными данными.
· основные события, протекающих в биомембранах, включая трансмембранный транспорт.
· Основные физико-химические и структурные характеристики мембраны
|
|
|
· Биофизические закономерности переноса веществ через мембранные структуры
· Механизмы формирования диффузионных потоков
Основные вопросы темы:
1. История развития моделей строения мембраны. Экспериментальные доказательства наличия липидного бислоя.
2. История развития моделей строения мембраны. Модель мембраны Даниелли и Давсона.
3. Современные представления о строении мембраны. Жидкокристалическая модель Сингера-Никольсона.
4. Функции мембраны.
5. Компоненты мембраны. Липидный и белковый состав мембраны.
6. Липид-липидные, липид-белковые взаимодействия в мембране. Подвижность компонентов мембраны (вращательная диффузия, латеральная диффузия, флип-флоп переход).
7. Фазовые переходы в липидном бислое. Изменение конформации липидных молекул. Формирование кинков.
8. Липосомы. Виды липосом. Получение. Использование.
9. Плоские бислойные липидные мембраны (БЛМ). Получение. Использование.
10. Использование флуоресцентных меток. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
11. Рентгеноструктурный анализ строения мембран. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
|
|
|
12. Электронная микроскопия. Метод "замораживание-скол-травление". Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
13. Спектроскопия электронного парамагнитного резонанса (ЭПР), спектроскопия ядерного магнитного резонанса (ЯМР). Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
14. Искусственные мембраны (липосомы, протеолипосомы, плоские бислойные липидные мембраны), моделирование мембран. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
15. Трансмембранный транспорт. Виды транспорта веществ через биологические мембраны.
16. Пассивный транспорт. Определение. Закон Фика.
17. Пассивный транспорт. Простая диффузия. Определение. Классификация.
18. Пассивный транспорт. Облегченная диффузия. Определение. Классификация.
19. Облегченная диффузия. Механизм работы молекул-переносчиков.
20. Активный транспорт. Электрогенные ионные насосы.
21. Вторичный активный транспорт. Основные виды.
Методы обучения и преподавания: работа в малых группах.
Литература:
1. Биологические мембраны http://www.chem.msu.su/rus/books/ovchinnikov/p547-636.pdf
|
|
|
2. Биофизика мембран http://www.pereplet.ru/obrazovanie/stsoros/109.html
3. Активный транспорт http://alexandr4784.narod.ru/antbio/antbio_07.pdf
4. Активный транспорт опыт Уссинга http://studopedia.ru/2_96194_aktivniy-transport-opit-ussinga.html
5. Физические основы функционирования биологических мембран. http://intranet.tdmu.edu.ua/data/kafedra/internal/distance/lectures_stud/%D0%A0%D1%83%D1%81%D1%81%D0%BA%D0%B8%D0%B9/1%20%D0%BA%D1%83%D1%80%D1%81/%D0%91%D0%B8%D0%BE%D1%84%D0%B8%D0%B7%D0%B8%D0%BA%D0%B0%20%D0%B8%20%D0%BC%D0%B5%D0%B4%D0%B8%D1%86%D0%B8%D0%BD%D1%81%D0%BA%D0%B0%D1%8F%20%D0%B0%D0%BF%D0%BF%D0%B0%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0/04_%D0%A4%D0%B8%D0%B7%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5%20%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D1%8B%20%D1%84%D1%83%D0%BD%D0%BA%D1%86%D0%B8%D0%BE%D0%BD%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D1%8F%20%D0%B1%D0%B8%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85%20%D0%BC%D0%B5%D0%BC%D0%B1%D1%80%D0%B0%D0%BD..htm
6. Методы исследования биологических мембран http://pskgu.ru/ebooks/revinbio/revinbio_2_21.pdf
7. Методы исследования биомембран http://arsob.getbb.ru/viewtopic.php?f=80&t=679
8. Краткий обзор групп методов исследования мембран http://chem21.info/article/741649/
Контроль: (контрольные вопросы по теме занятия)
1. Компоненты мембраны и её строение в соответствии с жидкокристалической моделью Сингера-Никольсона.
2. Функции мембраны.
3. Липид-липидные, липид-белковые взаимодействия в мембране. Подвижность компонентов мембраны (вращательная диффузия, латеральная диффузия, флип-флоп переход).
4. Фазовые переходы в липидном бислое. Изменение конформации липидных молекул. Формирование кинков.
|
|
|
5. Липосомы. Виды липосом. Получение. Использование.
6. Плоские БЛМ. Получение. Использование.
7. Основные составные части молекулы липидов входящих в состав мембран.
8. Биологические мембраны. Виды биологических мембран и их функции.
9. Основные классы мембранных липидов. Физические свойства мембранных липидов.
10. Какие методы дают возможность изучать динамику мембран без их разрушения. Кратко охарактеризуйте данные методы.
11. Использование флуоресцентных меток. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
12. Дифракция рентгеновских лучей. Рентгеноструктурный анализ строения мембран. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
13. Электронная микроскопия. Метод "замораживание-скол-травление". Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
14. ЭПР, ЯМР спектроскопия. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
15. Искусственные мембраны (липосомы, протеолипосомы, плоские БЛМ), моделирование мембран. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
16. Трансмембранный транспорт. Виды транспорта веществ через биологические мембраны.
17. Пассивный транспорт. Определение. Закон Фика.
18. Пассивный транспорт. Простая диффузия. Определение. Классификация.
19. Пассивный транспорт. Облегченная диффузия. Определение. Классификация.
20. Облегченная диффузия. Механизм работы молекул-переносчиков.
21. Активный транспорт. Электрогенные ионные насосы.
22. Вторичный активный транспорт. Основные виды.
Тестовые вопросы
1. Какая модель на современном этапе наиболее полно представляет строение мембраны?
A. модель Лили
B. модель Робертсона
C. модель Данели-Давсона
D. модель Сингер-Николсона
E. модель Резерфорда
2. Как называется перенос вещества через мембрану против градиента концентрации с помощью белков переносчиков?
A. простая диффузия
B. облегченная диффузия
C. осмос
D. фильтрация
E. активный транспорт
3. Укажите функцию мембраны, за счет которой обеспечивается селективный, регулируемый, пассивный и активный обмен веществом с окружающей средой
A. Матричная
B. Энергетическая
C. Барьерная
D. Механическая
E. Рецепторную
4. Укажите функцию мембраны, которая обеспечивает прочность и автономность клетки, внутриклеточных структур
A. Матричная
B. Генерации и проведения биопотенциалов
C. Барьерная
D. Механическая
E. Рецепторную
5. Укажите функцию мембраны, которая обеспечивает возбудимость клетки
A. Матричная
B. Генерации и проведения биопотенциалов
C. Барьерная
D. Механическая
E. Рецепторную
БИОЛОГИЧЕСКИЕ МЕМБРАНЫ. СТРУКТУРА, СВОЙСТВА
Биофизика мембран - важнейший раздел биофизики клетки, имеющий большое значение для биологии. Многие жизненные процессы протекают на биологических мембранах. Нарушение мембранных процессов - причина многих патологий. Лечение также во многих случаях связано с воздействием на функционирование биологических мембран.
Основные функции биологических мембран
Элементарная живая система, способная к самостоятельному существованию, развитию и воспроизведению - это живая клетка - основа строения всех животных и растений. Важнейшими условиями существования клетки (и клеточных органелл) являются, с одной стороны, автономность по отношению к окружающей среде (вещество клетки не должно смешиваться с веществом окружения, должна соблюдаться автономность химических реакций в клетке и ее отдельных частях); с другой стороны, связь с окружающей средой (непрерывный, регулируемый обмен веществом и энергией между клеткой и окружающей средой). Живая клетка - открытая система.
Единство автономности от окружающей среды и одновременно тесной связи с окружающей средой - необходимое условие функционирования живых организмов на всех уровнях их организации. Поэтому важнейшее условие существования клетки, и, следовательно, жизни - нормальное функционирование биологических мембран.
Три основные функции биологических мембран:
· барьерная - обеспечивает селективный, регулируемый, пассивный и активный обмен веществом с окружающей средой (селективный - значит, избирательный: одни вещества переносятся через биологическую мембрану, другие - нет; регулируемый - проницаемость мембраны для определенных веществ меняется в зависимости от генома и функционального состояния клетки); Т.е. создание биомембраной препятствий для свободного переноса веществ через нее. Для одних агентов БМ является непреодолимым препятствием, другие легко проходят сквозь нее, причем, как правило, только в определенном направлении, как того требуют векторные свойства мембраны. Скорости мембранного транспорта разных веществ далеко не одинаковы. Следовательно, с барьерной функцией БМ непосредственно связана ее избирательная (селективная) проницаемость. Мембраны не только отделяют клетки друг от друга, но также разделяют цитоплазму на ряд замкнутых отсеков (компартментов), каждый из которых выполняет свою специфическую задачу. В такой трактовке клеточные органоиды рассматриваются в качестве компартментов. Принцип компартментализации (разбиения цитоплазмы на компартменты) признан сейчас одним из важнейших в организации биологических систем. Благодаря компартментализации в клетке пространственно разобщены и изолированы друг от друга биохимические процессы, совместное течение которых невозможно. Например, синтез жирных кислот происходит в цитоплазме, а окисление - в митохондриях; синтез белка - на рибосомах, а деградация - в лизосомах. Между содержимым органоидов и цитозоля имеются существенные различия в химическом составе, чем обусловлены высокие концентрационные градиенты на внутриклеточных мембранах. На плазмолемме также поддерживаются значительные физико-химические градиенты. Они служат главной движущей силой трансмембранного переноса веществ.
· матричная – обеспечивает определенное взаимное расположение и ориентацию мембранных белков, обеспечивает их оптимальное взаимодействие (например, оптимальное взаимодействие мембранных ферментов); Преимущества компартментализации связаны не только с барьерной, но и с матричной функцией клеточных мембран. БМ служит матрицей для белков-рецепторов, ферментов и других физиологически активных веществ, обеспечивая пространственную организацию рецепторных взаимодействий, метаболических реакций, переноса энергии и других мембранных процессов. Так, биомембраны объединяют встроенные в них ферменты в единый конвейер, где каждый из них действует строго согласованно с остальными. Среди мембранных ферментов выделяют так называемые векторные, которые пронизывают БМ и принимают субстраты на ее одной стороне, чтобы выделить продукты реакции на противоположной. Реакции, катализируемые такими ферментами, имеют векторный характер. Мембранным ферментам присуще явление аллопии, заключающееся в том, что при отделении от БМ они полностью или частично утрачивают свою активность.
· механическая - обеспечивает прочность и автономность клетки, внутриклеточных структур. Т.е. заключается в поддержании морфологической целостности и относительной автономности как клетки в целом, так и внутриклеточных органоидов. Она основана прежде всего на механических свойствах мембранных структур.
Кроме того, биологические мембраны выполняют и другие функции:
· энергетическую - синтез АТФ на внутренних мембранах митохондрий и фотосинтез в мембранах хлоропластов;
· генерацию и проведение биопотенциалов;
· рецепторную (механическая, акустическая, обонятельная, зрительная, химическая, терморецепция - мембранные процессы) и многие другие функции.
Общая площадь всех биологических мембран в организме человека достигает десятков тысяч квадратных метров. Относительно большая совокупная площадь связана с огромной ролью мембран в жизненных процессах.
Структура биологических мембран

|
| Рисунок 1. Схематическое представление монослоя, образующегося в ванне Лэнгмюра. Полярные головки погружены в воду, а неполярные цепи обращены в воздух |
Первая модель строения биологических мембран была предложена в 1902 г. Было замечено, что через мембраны лучше всего проникают вещества, хорошо растворимые в липидах, и на основании этого было сделано предположение, что биологические мембраны состоят из тонкого слоя фосфолипидов. На самом деле, на поверхности раздела полярной и неполярной среды (например, воды и воздуха) молекулы фосфолипидов образуют мономолекулярный (одномолекулярный) слой (рис.1). Их полярные "головы" погружены в полярную среду, а неполярные "хвосты" ориентированы в сторону неполярной среды (рис.2). Поэтому и можно было предположить, что биологические мембраны построены из монослоя липидов.

|
| Рис. 2. Схема фосфолипида: 1 - полярная (гидрофильная) часть; 2 - неполярная (гидрофобная) часть |
В 1925 г. Гортер и Грендел показали, что площадь монослоя липидов, экстрагированных из мембран эритроцитов, в два раза больше суммарной площади эритроцитов. Гортер и Грендел экстрагировали липиды из гемолизированных эритроцитов ацетоном, затем выпаривали раствор на поверхности воды и измеряли площадь образовавшейся мономолекулярной пленки липидов. На основании результатов этих исследований была высказана идея, что липиды в мембране располагаются в виде бимолекулярного слоя (рис.3).

|
| Рис. 3. Бимолекулярный фосфолипидный слой |
Эту гипотезу подтвердили исследования электрических параметров биологических мембран (Коул и Кертис, 1935 г.): высокое электрическое сопротивление ≈ 107 Ом*м2 и большая емкость ~ 0,5*10-2 Ф/м2.
Биологическую мембрану можно рассматривать как электрический конденсатор, в котором пластинами являются электролиты наружного и внутреннего растворов (внеклеточного и цитоплазмы) с погруженными в них головами липидных молекул. Проводники разделены диэлектрическим слоем, образованным неполярной частью липидных молекул - двойным слоем их хвостов. Для плоского конденсатора можно найти расстояние между пластинами, соответствующее толщине липидной части мембраны и ≈3,5 нм. Это как раз соответствует по порядку величины толщине неполярной части бимолекулярного слоя липидов, сложенных определенным образом.
Однако мембрана - это не только липидный бислой. Имелись экспериментальные данные, которые свидетельствовали о том, что биологическая мембрана состоит и из белковых молекул. Например, при измерении поверхностного натяжения клеточных мембран было обнаружено, что измеренные значения коэффициента поверхностного натяжения значительно ближе к коэффициенту поверхностного натяжения на границе раздела белок-вода (около 10-4 Н/м), нежели на границе раздела липид-вода (около 10-2 Н/м). Эти противоречия экспериментальным результатам были устранены Даниели и Девсоном, предложившими в 1935 г. так называемую бутербродную модель строения биологических мембран, которая с некоторыми несущественными изменениями продержалась в мембранологии в течение почти 40 лет. Согласно этой модели мембрана - трехслойная. Она образована двумя расположенными по краям слоями белковых молекул с липидным бислоем посередине; образуется нечто вроде бутерброда: липиды, наподобие масла, между двумя "ломтями" белка (рис.4).
Однако по мере накопления экспериментальных данных пришлось в конце концов отказаться и от бутербродной модели строения биологических мембран.
Огромную роль в развитии представлений о строении биологических мембран сыграло все большее проникновение в биологию физических методов исследования.
Большую информацию о структуре мембран, о взаимном расположении атомов мембранных молекул дает рентгеноструктурный анализ, основанный на дифракции коротковолновых рентгеновских лучей на атомарных структурах. Рентгеноструктурный анализ позволяет обнаруживать упорядоченность в расположении атомов и определять параметры упорядоченных структур (например, расстояния между кристаллографическими плоскостями). Исследования дифракции рентгеновских лучей на мембране подтвердили относительно упорядоченное расположение липидных молекул в мембране - двойной молекулярный слой с более или менее параллельно расположенными жирнокислотными хвостами, дали возможность точно определить расстояние между полярной головой липидной молекулы и метильной группой в конце углеводородной цепи.
Метод дифракции рентгеновского излучения

|
| Дифракция рентгеновских лучей |

|
| Схема отражения рентгеновских лучей, объясняющая принцип рентгеноструктрного анализа. |
Одним из наиболее точных методов исследования структуры молекул, составляющих мембрану клетки, является метод рентгеноструктурного анализа, основанный на дифракции рентгеновских лучей. Как правило, это явление наблюдается в тех случаях, когда на пути лучей встречаются препятствия, сравнимые по размеру с длиной волны луча (для анализа объектов нанометрового диапазона необходимо рентгеновское излучение диапазон длин его волн от 10-5 до 80 нм). Если на исследуемый объект направляют параллельный пучок рентгеновских лучей, а за объектом помещают фотопленку, то на ней фиксируется дифракционная картина. На рентгенограмме наблюдается множество пятен (дифракционных максимумов), образующихся в результате интерференции лучей. Анализ рентгенограммы дает сведения о структуре объекта на молекулярном (и даже атомном) уровне.
Ценность метода заключается в том, что появляется возможность, во-первых, изучить пространственное расположение молекул, точно измерить расстояние между ними, оценить их внутримолекулярную структуру, во-вторых, определить структуру молекулярных компонентов мембраны в нефиксированных клеточных препаратах.
Дифракционная решетка -оптическое устройство, представляющее собой совокупность большого числа параллельных, обычно равноотстоящих друг от друга щелей. Дифракционную решетку получают нанесением непрозрачных царапин (штрихов) на стеклянную пластину. Непроцарапанные места - щели - будут пропускать свет; штрихи, соответствующие промежутку между щелями, рассеивают и не пропускают света. В случае рентгеноструктурного анализа роль штриха выполняют атомы, щелей - промежутки между атомами.

|
| Рисунок. Рентгенограмма (дебаеграмма) кристалла |
Чтобы понять принцип использования рентгеновского излучения для анализа структуры вещества, рассмотрим кристаллическую структуру, на два соседних атома которой падают параллельные лучи, которые отражаются от соседних атомов кристаллической решетки, а затем интерферируют, собираясь в одну точку на некотором экране. Вводя значение межатомного расстояния d, угла скольжения θ, получим, что разность хода лучей
A=AB+BC=2d sin θ
Условием того, что в некоторой точке экрана две волны будут усиливать друг друга, является равенство этой разности хода целому числу длин волн
2 d sin θ=nλ (n=0,1,2)
Наблюдая картину дифракции на экране, можно установить, под каким углом θ наблюдается, например, максимум первого порядка (n=1) Зная длину волны, можно найти важнейший параметр структуры исследуемого вещества - межатомное расстояние d

С помощью рентгеноструктурного анализа были подтверждены бислойное расположение фосфолипидов и присутствие в мембранах белков, вычислены важные структурные параметры мембраны.
П. Дебаем и П. Шеррером был предложен метод рентгеноструктурного анализа, основанный на дифракции монохроматических рентгеновских лучей в поликристаллических телах (обычно спрессованные порошки).
Среди множества кристаллитов всегда найдутся такие, для которых одинаковы λ, q и k , причем эти величины соответствуют формуле Вульфа - Брэггов. Отраженный луч 2 (максимум) составит угол 2q с падающим рентгеновским лучом 1.

|
| Рис. 4. Развитие представлений о молекулярной организации биологических |
Так как условия одинаково для многих кристаллов, по-разному ориентированных, то дифрагированные рентгеновские лучи образуют в пространстве конус, вершина которого лежит в исследуемом объекте, а угол раствора равен 4q . Другой совокупности величин l, q и k , удовлетворяющих условиям, будет соответствовать другой конус. На фотопленке рентгеновские лучи образуют рентгенограмму (дебаеграмму) в виде окружностей или дуг.
Дифракцию рентгеновских лучей наблюдают также при рассеянии их аморфными твердыми телами, жидкостями и газами. В этом случае на рентгенограмме получаются широкие и размытые кольца. В настоящее время широко применяют рентгеноструктурный анализ биологических молекул и систем: на рис. показаны рентгенограммы белков.
Наибольшие успехи в раскрытии особенностей строения биологических мембран были достигнуты в электронно-микроскопических исследованиях. Как известно, световой микроскоп не позволяет рассмотреть детали объекта, меньшие примерно половины длины световой волны (около 200 нм). В световом микроскопе можно разглядеть отдельные клетки, однако он совершенно непригоден для изучения биологических мембран, толщина которых в 20 раз меньше предела разрешения светового микроскопа. Разрешающая способность микроскопа ограничена явлением дифракции. Поэтому, чем меньше длина волны по сравнению н с деталями исследуемого объекта, тем меньше искажения. Предел разрешения пропорционален длине волны.
В электронном микроскопе вместо светового пучка на исследуемый объект направляется пучок электронов, разогнанных до больших скоростей.

| 
|
| Рис. 5. Трехслойное изображение биомембраны на электронограмме | Рис. 6. Электронограмма поверхностей скола биомембраны (метод «замораживания-скалывания») Выступам (1-5) на левой поверхности соответствуют вмятины (1-5) на правой, и наоборот |

|
| Рисунок 7. Исследование мембран методом замораживания-скалывания. А. Плоскость скола замороженной клетки частично проходит через центральную часть различных мембран. Б. Разъединение двух половинок скола. В. Образец подвергают травлению для выявления деталей поверхности слоя. Г. На образец напыляют слой платины, а затем слой углерода; таким образом, получается реплика с поверхности образца. Д. Эту реплику отделяют от препарата и исследуют под электронным микроскопом. |
ИИзвестно, что электронам с высокими скоростями тоже присущи волновые свойства, в том числе явление дифракции. Однако при достаточно больших скоростях, согласно формуле де Бройля, длина волны мала и соответственно мал предел разрешения. Так, если электроны ускоряются электрическим полем с напряжением 105 В, их скорость достигает 106 м/с, длина волны уменьшается и предел разрешения составляет порядка 0,1 нм, что позволяет рассмотреть отдельные детали строения биологических мембран.
В электронном микроскопе достигается увеличение в сотни тысяч раз, что дало возможность исследовать строение клетки, клеточных органелл и биологических мембран.
Недостатком электронной микроскопии является деформация живого объекта в процессе исследования. Перед началом электронномикроскопических исследований клетка проходит через многие стадии предварительной обработки: обезвоживание, закрепление, ультратонкий срез, обработка препаратов веществами, хорошо рассеивающими электроны (например, золотом, серебром, осмием, марганцем и т.п.). При этом изучаемый объект значительно изменяется. Несмотря на это, успехи в изучении клетки при помощи электронного микроскопа несомненны.
При помощи электронной микроскопии удалось получить изображение биологических мембран, на снимках видно трехслойное строение мембраны (рис.5).

|
| Рис. 8. Жидкостно-мозаичная модель плазматической мембраны. |
Новая информация о строении мембраны была получена с помощью метода "замораживание-скол-травление" (см рис.7). По этому методу клетку охлаждают до очень низкой температуры в жидком азоте. Охлаждение проводится с очень большой скоростью (около 1000 градусов в секунду). При этом вода, содержащаяся в препарате, переходит в твердое аморфное состояние. Затем клетки раскалываются специальным ножом и помещаются в вакуум. Замерзшая вода быстро возгоняется, освобождая поверхность скола (этот процесс и называют травлением). После травления получают реплику (отпечаток со сколотой поверхности) и фотографируют в электронном микроскопе. Замороженные мембраны могут при раскалывании расщепляться в разных направлениях, в том числе и вдоль границы двух липидных монослоев, и поэтому можно видеть их внутреннее строение (рис.6).
Было обнаружено, что имеются белковые молекулы, погруженные в липидный бислой и даже прошивающие его насквозь. Это привело к существенному изменению представлений о строении мембраны.

|
| Рис. 9. Холестерин и фосфолипид в биомембране |
Современное представление о структуре мембраны. Совокупность результатов, полученных физическими и химическими методами исследования, дала возможность предложить новую жидкостно-мозаичную модель (рис.8) строения биологических мембран (Сингер и Никольсон, 1972 г.). Согласно Сингеру и Никольсону, структурную основу биологической мембраны образует двойной слой фосфолипидов, инкрустированный белками (рис.8). Различают поверхностные (или периферические) и интегральные белки.
Липиды находятся при физиологических условиях в жидком агрегатном состоянии. Это позволяет сравнить мембрану с фосфолипидным морем, по которому плавают белковые "айсберги". Одним из подтверждений жидкостно-мозаичной модели является и тот факт, что, как установил химический анализ, в разных мембранах соотношение между содержанием белков и фосфолипидов сильно варьирует: в миелиновой мембране белков в 2,5 раза меньше, чем липидов, а в эритроцитах, напротив, белков в 2,5 раза больше, чем липидов. При этом, согласно современной модели, соотношение количества белков и липидов во всех мембранах должно быть примерно одинаково. Тот факт, что не вся поверхность биологической мембраны покрыта белками, показал и метод ядерного магнитного резонанса. Так, например, более чем половина поверхности мембраны кишечной палочки образована полярными головами липидов.
Кроме фосфолипидов и белков, в биологических мембранах содержатся и другие химические соединения (рис.9,10). В мембранах животных клеток много холестерина (в сравнимом количестве с фосфолипидами и белками). Есть в мембранах и другие вещества, например гликолипиды, гликопротеиды.
Жидкостно-мозаичная модель строения мембраны в настоящее время общепринята. Однако, как всякая модель, она дает довольно упрощенную картину строения мембраны. В частности, обнаружено, что белковые "айсберги" не всегда свободно плавают в липидном море, а могут быть "заякорены" на внутренние (цитоплазматические) структуры клетки. К таким структурам относятся микрофиламенты и микротрубочки (рис. 11). Микротрубочки - полые цилиндры диаметром около 300 нм из особого белка (тубулина) играют, по-видимому, важную роль в функционировании клетки.

|
| Рис. 10. Структурные формулы мембранных липидов: а - фосфатидилэтаноламин; б - фосфатидилсерин; в - фосфатидилхолин (лецитин); г - кардиолипин; д - холестерин |
Выяснилось также, что не все липиды в мембране расположены по принципу бислоя. Физические методы исследования показали, что липидная фаза мембран содержит также участки, где липидные молекулы не образуют двойной слой.
Изучением сложного химического состава мембран, мембранных белков и других веществ занимается биохимия. Основная область приложения биофизики - структурная основа мембраны, а именно двойной слой фосфолипидных молекул.
Молекула фосфолипида лецитина содержит полярную голову (производную фосфорной кислоты) и длинный неполярный хвост (остатки жирных кислот). В голове фосфолипидной молекулы лецитин имеются две заряженные группы, расположенные на некотором расстоянии друг от друга. Два разноименных заряды, равные по абсолютной величине, образуют электрический диполь.

|
| Рис. 11. Синтетическая модель клеточной мембраны: 1 - бимолекулярный слой фосфолипидов; 2 - интегральные белки; 3 - микрофиламенты; 4 - микротрубочки; 5 - части спектриновой сети; 6 - коммутационные белки; 7 - гликопротеиды внеклеточного матрикса; 8 - зоны аннулярных липидов |
В мембранах содержатся разные фосфолипиды. Например, в мембране эритроцитов их около 20 видов. Варьирует химическая формула полярной головы молекулы. У некоторых фосфолипидов головы кроме двух зарядов противоположного знака, создающих дипольный момент, но оставляющих молекулу в целом нейтральной, несут один некомпенсированный отрицательный заряд, вследствие чего молекула оказывается заряженной отрицательно. Углеводородные хвосты фосфолипидной молекулы содержат приблизительно 20 атомов углерода, в хвосте может быть 1-4 двойных ненасыщенных связей.

|
| Рис. 12. Схематичное изображение "однохвостовой" фосфолипидной молекулы (а) и схема образования поры в мембране из "однохвостовых" молекул |
Полярные головы молекул фосфолипидов - гидрофильны, а их неполярные хвосты - гидрофобны. В смеси фосфолипидов с водой термодинамически выгодно, чтобы полярные головы были погружены в состоящую из полярных молекул воду, а их неполярные хвосты были бы расположены подальше от воды. Такое расположение амфифильных (имеющих и гидрофильную, и гидрофобную части) молекул соответствует наименьшему значению энергии Гиббса по сравнению с другими возможными расположениями молекул.
Очень существенным является то обстоятельство, что молекулы фосфолипидов имеют два хвоста. Такая молекула в пространстве имеет форму, близкую к цилиндру. Из молекул фосфолипидов в водной среде происходит самосборка бислойной мембраны. Присутствие молекул с одним хвостом (лизолецитин), имеющих в пространстве форму, близкую к конусу, разрушает клеточные мембраны (рис. 12). Фосфолипидные молекулы, лишенные одного из хвостов, образуют поры в бислойной мембране, нарушается барьерная функция мембран.
Динамика мембран. Подвижность фосфолипидных молекул в мембранах
Режим функционирования мембраны сильно зависит от: микровязкости липидного бислоя и подвижности фосфолипидных молекул в мембране, фазового состояния мембранных липидов. Отклонения биофизических характеристик липидного бислоя от нормы связано с разного рода патологиями. Важную роль в физиологии клетки играют фазовые переходы в биологических мембранах.

|
| Рис. 13. Изменение спектров ЭПР при уменьшении микровязкости Т (увеличении подвижности молекул) - схематичное изображение |
Липидная фаза биологических мембран при физиологических условиях (температуре, давлении, химическом составе окружающей среды) находится в жидком агрегатном состоянии. Это доказано методами флюоресцентного анализа (с использованием флуоресцентных зондов и меток), электронного парамагнитного резонанса (ЭПР), с использованием спиновых зондов и меток, и ядерного магнитного резонанса (ЯМР).
Наиболее полные сведения об агрегатном состоянии липидных бислоев дают методы радиоспектроскопии ЭПР и ЯМР.
Электронный парамагнитный резонанс - это явление резкого возрастания поглощения энергии электромагнитной волны системой парамагнитных частиц (электронов с некомпенсированными спинами), помещенных во внешнее магнитное поле, при резонансной частоте волны. Спектром ЭПР называется зависимость мощности поглощения Р электромагнитной волны от величины магнитной индукции В.
Чем сильнее взаимодействие между атомами и молекулами образца, тем спектры ЭПР шире. Чем слабее взаимодействие между частицами (больше подвижность молекул), тем уже спектры ЭПР (рис. 13). По ширине спектров ЭПР можно судить о подвижности молекул вещества.
Так как молекулы фосфолипидов диамагнитны, для ЭПР-исследований биомембран используются спин-зонды и спин-метки - молекулы или молекулярные группы с неспаренными электронами.
Парамагнитные спин-зонды вводятся в липидную мембрану, спектры поглощения спин-зондами электромагнитной волны дают информацию о свойствах липидного окружения, в частности о подвижности липидных молекул в мембране.
Несмотря на ценную информацию, которую удалось получить при исследовании биологических объектов методом ЭПР с использованием спиновых зондов, этот метод обладает существенным недостатком - внесение в биологический объект чужеродных молекул-зондов может изменять структуру объекта. От этого недостатка свободен метод ЯМР.
Ядерный магнитный резонанс - это явление резкого возрастания поглощения энергии электромагнитной волны системой атомных ядер, обладающих магнитным моментом, помещенных во внешнее магнитное поле, при резонансной частоте волны.
Магнитным моментом обладают, например, такие ядра, как 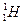

 . Не обладают магнитным моментом такие ядра, как
. Не обладают магнитным моментом такие ядра, как 

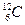 . В биологическом объекте содержится много ядер
. В биологическом объекте содержится много ядер 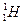 - протонов, что дает возможность применять для их исследования ЯМР. В ЯМР используются более сильные магнитные поля, а частоты переменного электромагнитного поля меньше (5×107 Гц), чем в ЭПР.
- протонов, что дает возможность применять для их исследования ЯМР. В ЯМР используются более сильные магнитные поля, а частоты переменного электромагнитного поля меньше (5×107 Гц), чем в ЭПР.
Как и в случае ЭПР, спектры ЯМР тем шире, чем больше вязкость и меньше молекулярная подвижность исследуемого объекта.
Флуоресцентные, ЭПР- и ЯМР-исследования показали, что подвижность фосфолипидных молекул в мембране сравнительно велика, а вязкость мала. В нормальных физиологических условиях липидная часть мембраны находится в жидком агрегатном состоянии. Вязкость липидной мембраны сравнима с вязкостью подсолнечного масла (30-100 мПа×с, для сравнения: вязкость воды при 20о С составляет 1 мПа×с).
Изменение микровязкости липидного окружения мембранных белков-ферментов резко сказывается на их функционировании. Некоторые экспериментальные данные свидетельствуют о том, что канцерогенез связан со снижением вязкости липидной фазы мембраны, а при старении вязкость, напротив, увеличивается. Разрабатываются диагностические методы, основанные на измерении микровязкости мембран с помощью спин-зондов.
Высокая подвижность липидных молекул обусловливает латеральную (боковую) диффузию. Латеральная диффузия - это хаотическое тепловое перемещение молекул липидов и белков в плоскости мембраны. При латеральной диффузии рядом расположенные молекулы липидов скачком меняются местами и вследствие таких последовательных перескоков из одного места в другое молекула перемещается вдоль поверхности мембраны.
Перемещение молекул по поверхности мембраны клетки за время t определено экспериментально методом флуоресцентных меток - флюоресцирующих молекулярных групп. Флуоресцентные метки делают флюоресцирующими молекулы, движение которых по поверхности клетки можно изучать, например, исследуя под микроскопом скорость расплывания по поверхности клетки флюоресцирующего пятна, созданного такими молекулами. Остроумный прием, используемый с целью определения скорости перемещения флюоресцирующих молекул - фотообесцвечивание. В клетку вводят молекулы, меченные флуоресцентными метками, а затем небольшой участок клеточной поверхности (несколько квадратных микрометров) облучают лазерным лучом. Под действием лазерного излучения молекулы теряют способность флюоресцировать. Измеряя скорость восстановления флюоресценции в обесцвеченной области по скорости уменьшения радиуса обесцвеченного пятна, получают оценку скорости латеральной диффузии.
Оказалось, что среднее квадратичное перемещение за секунду фосфолипидной молекулы по поверхности мембраны эритроцита составило около 5 мкм, что сравнимо с размерами клеток. Таким образом, за секунду молекула может обежать всю поверхность небольшой клетки. Обнаруженное среднее квадратичное перемещение белковых молекул составило около 0,2 мкм за секунду.
Для молекул фосфолипидов частота перескоков v = 3×107 с-1. Каждая молекула, таким образом, в среднем претерпевает десятки миллионов перестановок в плоскости мембраны за секунду, то есть характерное время одного перескока: 10-7 - 10-8 с.
Флип -флоп - это диффузия молекул мембранных фосфолипидов поперек мембраны. Скорость перескоков молекул с одной поверхности мембраны на другую (флип-флоп) определена методом спиновых меток в опытах на модельных липидных мембранах - липосомах.
Часть фосфолипидных молекул, из которых формировались липосомы, метились присоединенными к ним спиновыми метками. Липосомы подвергались воздействию аскорбиновой кислоты, вследствие чего неспаренные электроны на молекулах пропадали: парамагнитные молекулы становились диамагнитными, что можно было обнаружить по уменьшению площади под кривой спектра ЭПР.
Сначала "нейтрализовались" неспаренные электроны молекул, расположенных на внешних поверхностях липосом, что приводило к уменьшению числа неспаренных электронов в два раза. ЭПР затем определялся спин-метками на внутренних, не доступных действию аскорбиновой кислоты поверхностях липосом. Однако площадь под спектрами ЭПР продолжала понижаться, что свидетельствовало об уменьшении числа неспаренных электронов. Это объяснялось перескоками меченных спин-метками молекул с внутренней поверхности бислойной мембраны липосомы на внешнюю - флип-флопом. По скорости уменьшения интенсивности сигнала ЭПР установлено, что половина меченых молекул претерпевает флип-флоп примерно за 6,5 часов, поскольку примерно через это время площадь под кривой спектра ЭПР (а следовательно, число неспаренных электронов) уменьшалась в два раза.
Таким образом, перескоки молекул с одной поверхности бислоя на другую (флип-флоп) совершаются значительно медленнее, чем перескоки при латеральной диффузии. Среднее время, через которое фосфолипидная молекула совершает флип-флоп (Т~1 час), в десятки миллиардов раз больше среднего времени, характерного для перескока молекулы из одного места в соседнее в плоскости мембраны.
Сочетание быстрой диффузии молекул вдоль мембраны и очень медленной диффузии поперек мембраны имеет большое значение для функционирования мембран, а именно для матричной функции мембраны. Благодаря затрудненному переходу поперек мембраны поддерживается упорядоченность в молекулярной структуре мембраны, ее анизотропия, асимметрия (относительно плоскости мембраны) расположения липидных и белковых молекул, определенная ориентация белков-ферментов поперек мембраны. Это имеет большое значение, например, для направленного переноса веществ через мембрану.
Физическое состояние и фазовые переходы липидов в мембранах
Вещество при разных температуре, давлении, концентрациях химических компонентов может находиться в различных физических состояниях, например газообразном, жидком, твердом, плазменном. Кристаллическому твердому состоянию вещества могут соответствовать разные фазовые состояния (кристаллические модификации). В качестве примера разных кристаллических модификаций одного и того же вещества - углерода - можно назвать графит и алмаз.
Известно, что характерными, отличительными чертами твердого тела являются собственный объем, форма, механическая прочность; жидкости - собственный объем, отсутствие упругости по отношению к изменению формы и механической прочности, текучесть.
Твердое тело может быть как кристаллическим (имеется дальний порядок в расположении частиц на расстояниях, много превышающих межмолекулярные расстояния - кристаллическая решетка), так и аморфным, например стекло (нет дальнего порядка в расположении атомов и молекул).
Различие между твердым аморфным телом и жидкостью состоит не в наличии или отсутствии дальнего порядка, а в характере движения частиц. И молекулы жидкости, и молекулы твердого тела совершают колебательные (иногда вращательные) движения около положения равновесия. Через некоторое среднее время - "время оседлой жизни" - происходит перескок молекулы в другое положение равновесия. Различие заключается в том, что время оседлой жизни в жидкости много меньше, чем в твердом теле.
Липидные бислойные мембраны при физиологических условиях - жидкие, время оседлой жизни фосфолипидных молекул в мембране мало: 10-7 - 10-8 с.
Вместе с тем, молекулы в мембране размещены не беспорядочно, в их расположении наблюдается дальний порядок. Фосфолипидные молекулы находятся в двойном слое, а их гидрофобные хвосты приблизительно параллельны друг другу. Есть порядок и в ориентации полярных гидрофильных голов.
Физическое состояние, при котором есть дальний порядок во взаимной ориентации и расположении молекул, но агрегатное состояние жидкое, называется жидкокристаллическим состоянием.

|
| Рис. 14. Расположение молекул в аморфном (а) и жидкокристаллическом состояниях (б, в, г) |

|
| Рис. 15. Изменение структуры мембраны при переходе из жидкокристаллического в гель-состояние и обратно при изменении температуры |
Жидкие кристаллы могут образовываться не во всех веществах, а в веществах из "длинных молекул" (поперечные размеры которых меньше продольных). Могут быть различные жидкокристаллические структуры (рис. 14, б, в, г): нематическая (нитевидная), когда длинные молекулы ориентированы параллельно друг другу; смектическая (мылообразная) - молекулы параллельны друг другу и располагаются слоями; холестерическая - молекулы располагаются параллельно друг другу в одной плоскости, но в разных плоскостях ориентации молекул разные (повернуты на некоторый угол в одной плоскости относительно другой).
Бислойная липидная фаза биологических мембран соответствует смектическому жидкокристаллическому состоянию.
Жидкокристаллические структуры очень чувствительны к изменению температуры, давления, химического состава, электрическому полю. Это определяет динамичность липидных бислойных мембран - изменение их структуры при различных, даже небольших изменениях внешних условий или химического состава. При изменении условий вещество может перейти в другое фазовое состояние (например, из газообразного в жидкое, из жидкого в твердое, из одной кристаллической модификации в другую).
Как показано физическими методами исследования: дилатометрией (измерение коэффициента объемного расширения) и калориметрией (измерение теплоемкости), методом рентгеноструктурного анализа и др., липидная часть биологических мембран при определенных температурах испытывает фазовый переход первого рода. Согласно данным рентгеноструктурного анализа, радиоспектроскопии, флюоресцентного анализа, инфракрасной спектроскопии и других физических исследований, в фосфолипидной мембране при понижении температуры происходит переход из жидкокристаллического в гель-состояние, которое условно иногда называют твердокристаллическим (рис. 15).
В гель-состоянии молекулы расположены еще более упорядочено, чем в жидкокристаллическом. Все гидрофобные углеводородные хвосты фосфолипидных молекул в гель-фазе полностью вытянуты строго параллельно друг другу (имеют полностью транс-конформацию). В жидком кристалле за счет теплового движения возможны транс-гош-переходы, хвосты молекул изгибаются, их параллельность друг другу в отдельных местах нарушается, особенно сильно в середине мембраны.
Толщина мембраны в гель-фазе поэтому больше, чем в жидком кристалле (рис. 15). Однако при переходе из твердого в жидкокристаллическое состояние объем несколько увеличивается, потому что значительно увеличивается площадь мембраны, приходящаяся на одну молекулу (от 0,48 нм2 до 0,58 нм2). Так как в твердокристаллическом состоянии больше порядок, чем в жидком кристалле, ему соответствует меньшая энтропия.
Для нормального функционирования мембрана должна быть в жидкокристаллическом состоянии. Поэтому в живых системах при продолжительном понижении температуры окружающей среды наблюдается адаптационное изменение химического состава мембран, обеспечивающее понижение температуры фазового перехода.
Температура фазового перехода понижается при увеличении числа ненасыщенных связей в жирно-кислотных хвостах. В хвосте молекулы может быть до четырех ненасыщенных связей.
В зависимости от химического состава липидных мембран температура фазового перехода гель - жидкий кристалл может меняться от -20°С (для мембран из ненасыщенных липидов) до +60°С (для насыщенных липидов). Увеличение числа ненасыщенных липидов в мембране при понижении температуры обитания наблюдается у микроорганизмов, растительных и животных клеток.

|
| Рис. 16. Расположение СН-связей этана в транс- (а), цис- (б) и промежуточной (в) конформациях (проекция на плоскость, перпендикулярную С-С-связям) |

|
| Рис. 17. Углеводородные цепи в транс-конфигурации (а), гош-транс-гош-конфигурации (б), цис-транс-гош-конфигурации (в) |

|
| Рис. 18. Кник-блоки в углеводородных цепях мембран: а - в одном полуслое; б - в двух монослоях липидного бислоя |
Молекулярную основу различий между фазами мембранами составляют конформации жирно-кислотных цепей. Отдельная жирно-кислотная цепь может принимать множество конформаций благодаря вращению вокруг одинарных С-С - связей. В липидном бислое за счет плотной упаковки молекул в норме реализуются преимущественно две плоские конформаций углеводородной цепи - транс- и цис-конформации (рис. 16 а, б), но существуют и промежуточные (рис. 16 в; 17 в).
В твердом состоянии все молекулы фосфолипида обладают транс-конформацией углеводородных цепей жирных кислот, что определяет их ограниченную подвижность в БЛМ. В этом случае осуществляются лишь небольшие согласованные колебания или вращательные движения (прецессия) возле точки крепления жирной кислоты и полярной группы ФЛ. В жидком состоянии БЛМ возможны тепловые движения жирно-кислотных цепей, сопровождающиеся транс-гош-переходами. Важно отметить, что расположенные рядом гош-конформации могут образовывать полости в бислое (так называемые кинки), в которые и попадают молекулы, «захваченные» из раствора. Изменения конформации цепей вызывают движение такого кинка вместе с находящимися в нем молекулами вдоль цепи (поперек мембраны) или между цепями (в плоскости мембраны) (рис. 18).
Гипотеза петли (кинка) предполагает, что плавление цепей ЖК при фазовом переходе обусловлено вращательной изомеризацией. Наименьшей энергией обладает транс-, а наибольшей - цис-конфигурация ЖК. Формирование кинка сопровождается уменьшениием эффективной длины цепи на 0,13 нм. При этом часть цепи отодвигается на 0,15 нм, образуя свободный объем, в результате общий объем липида увеличивается на 0,025 - 0,050 нм3. Согласно современным представлениям структура кинка способна к диффузии (т.е. к перемещению).
Образование одного кинка облегчает возникновение кинков в соседних цепях, стимулируя их чередование в липидах ПМ. Появление в ходе такого процесса так называемых кинк-блоков (нескольких кинков) приводит, как правило, к разупорядочениости структуры мембраны. Вероятно, трансмембранный перенос малых молекул через мембрану осуществляется внутри свободного объема кинк-блока.
Температура фазового перехода зависит от размера боковых цепей ЖК (чем длиннее цепь и меньше двойных связей, тем выше температура). Действительно, длинные цепи ЖК уменьшают текучесть мембран, а появление двойных связей приводит к ее повышению. Фазовый переход наблюдается, как правило, в интервале температур от 0,2 до 1,0 С0, при этом одна фаза (например, кристаллическая) возникает в матриксе другой фазы (например, жидкой) с образованием большого числа доменов новой фазы.
Межмолекулярные контакты в мембране осуществляются за счет липид-липидных, липид-белковых и белок-белковых взаимодействий.
Липид-липидные взаимодействия зависят от:
1) энергии электростатических сил;
2) стерического фактора локализации в мембране фосфолипидных «головок» и «хвостов»;
3) энергии гидратации и образования водородных связей;
4) образования фосфолипидных доменов.
Липид-белковые взаимодействия определяются:
1) сорбцией и электростатическим взаимодействием белка и липида на поверхности монослоя;
2) внутримембранным встраиванием и взаимодействием белка и липида (аннулярный слой) в БЛМ.
Белок-белковые взаимодействия обусловлены поверхностной и внутримембранной ориентацией молекул белка (образование кластеров).
Модельные липидные мембраны
Липосомы, или фосфолипидные везикулы (пузырьки), получают обычно при набухании сухих фосфолипидов в воде или при впрыскивании раствора липидов в воду. При этом происходит самосборка бимолекулярной липидной мембраны. Минимуму энергии Гиббса отвечает замкнутая сферическая одноламеллярная форма мембраны. При этом все неполярные гидрофобные хвосты находятся внутри мембраны и ни один из них не соприкасается с полярными молекулами воды (рис. 19). Однако чаще получаются несферические многоламеллярные липосомы, состоящие из нескольких бимолекулярных слоев, - многослойные липосомы.

|
| Рис. 19. Липосомы: а - однослойная; 6 - многослойная |
Отдельные бимолекулярные слои многослойной липосомы отделены водной средой. Толщина липидных слоев составляет, в зависимости от природы липидов, 6,5-7,5 нм, а расстояние между ними - 1,5-2 нм. Диаметр многослойных липосом колеблется в пределах от 60 нм до 400 нм и более.
Однослойные липосомы можно получить различными методами, например из суспензии многослойных липосом, если обработать их ультразвуком. Диаметр однослойных липосом, полученных этим методом, составляет 25-30 нм. Разработаны и другие методы получения однослойных липосом, в том числе диаметром до 400 нм и более.
Липосомы представляют собой в некотором роде прообраз клетки. Они служат моделью для исследований различных свойств клеточных мембран.
Липосомы нашли непосредственное применение в медицине. Например, можно заключить внутрь липосом лекарственный препарат и использовать как фосфолипидную микрокапсулу для доставки лекарства в определенные органы и ткани. Липосомы не токсичны (при правильном подборе липидов), полностью усваиваются организмом, способны преодолевать некоторые биологические барьеры. Так, инсулин, заключенный в липосому, защищен от действия пищеварительных ферментов. Проводятся работы по разработке методов липосомальной терапии опухолей, ферментативной недостаточности, атеросклероза. Изучается возможность прицельной доставки лекарственного препарата, заключенного в липосомах, к больному органу или даже к больному участку (в частности, к пораженному участку сердца). Для этого к липосоме присоединяется белковая молекула -антитело к соответствующему мембранному антигену органа-мишени. Липосомы с током крови разносятся по всему организму и задерживаются, оказавшись около органа-мишени.
Плоские бислойные липидные мембраны (БЛМ) другой тип модельных мембран. Такие мембраны получают на маленьких отверстиях диаметром около 1 мм в пластинке из пластика (например, фторопласта), погруженной в водную среду. На отверстие наносят каплю раствора липида (в спирте, хлороформе, гептане или других растворителях). Растворитель диффундирует из раствора в воду, и на отверстии остается пленка липида. Эта пленка спонтанно утончается до тех пор, пока не образуется бимолекулярный слой толщиной около 6 нм. Лишний липид собирается в виде ободка-торуса у краев отверстия (рис. 20).
Плоские липидные мембраны, наряду с липосомами, широко используются в качестве моделей для изучения электрических свойств мембраны, их проницаемости и других научных исследований. С помощью модельных мембран изучают ряд функций биологических мембран, а том числе, барьерную (например, селективность проницаемости - хорошую проницаемость для воды и плохую для ионов). Можно моделировать биологический транспорт, вводя в модельную мембрану молекулы-переносчики.

|
| Рис.20. Искусственная плоская липидная мембрана («черная мембрана»): а-в процессе формирования; б - сформировавшаяся |
В мембрану липосомы научились встраивать белки. Инкрустированные протеиновыми молекулами пузырьки называются протеолипосомами. Они внедряются в медицину. При введении в организм человека протеолипосомы поглощаются клеточными мембранами. Так в составе протеолипосом клеточные мембраны получают вещества, не способные проникнуть в них сами по себе. Сливаясь с БМ, липосомы изменяют их состав. В плазмолемму одной клетки можно включить 300 млн липидных молекул и изменить таким образом основные свойства клеточных мембран (вязкость, проницаемость, ферментную и иммунную способности и т. д.). Важным достоинством подобного вмешательства является то, что протеолипосомы встраиваются не во все клетки организма, а именно в те, которые нуждаются в лечебном воздействии. Целенаправленная терапия на клеточном уровне обеспечивается разными способами, в частности введением в липосомы специфических белковых компонентов клеток-мишеней. Без таких мер липосомы концентрируются преимущественно в печени и селезенке. Протеолипосомы как лекарственное средство нетоксичны, полностью усваиваются организмом и способны преодолевать многие «барьеры».
В искусственных мембранах липиды пребывают в жидкокристаллическом состоянии, подобном тому, какое им свойственно в БМ. Внутри каждого из двух слоев липидные молекулы беспрестанно меняются местами за счет латеральной диффузии. Этот процесс идет со скоростью 5-10 мкм×с-1. Много общего у искусственных и биологических мембран в физических и физико-химических свойствах. Проницаемость тех и других мембран для многих молекул определяется большей или меньшей легкостью разрыва водородных связей, образованных ими ранее. Иными словами, чем ниже энергия дегидратации веществ, тем легче они преодолевают липидный бислой. Поэтому через биологические и искусственные липидные мембраны хорошо проникают жирорастворимые вещества.
Искусственные липидные мембраны, включающие пептиды. Протеолипосомы.
Несмотря на существование аналогии многих свойств этих мембран, между ними больше различий, чем сходства. Так, искусственные липидные мембраны обладают низкой ионной проницаемостью и, следовательно, высоким сопротивлением постоянному и переменному (низкочастотному) электрическому току. Оно на 4-5 порядков превышает электрическое сопротивление клеточных мембран. У БМ гораздо выше проницаемость для воды.
Пытаясь устранить различия между биологическими и искусственными липидными мембранами, исследователи ввели в липидный бислой ряд веществ, моделирующих присутствие в БМ их второго молекулярного компонента - белка.
Добавление к липидным мембранам белков, выделенных из бычьих эритроцитов, понизило их электрическое сопротивление в 200-500 раз. Весьма интересные результаты получились при включении в фосфолипидный бислой молекул некоторых антибиотиков. С ними искусственные мембраны приобрели не только хорошую электропроводность, но и избирательную проницаемость, напоминающую в ряде случаев селективность клеточных мембран. Липидные бислои, включающие антибиотики, моделируют транспорт веществ как через мембранные каналы, так и посредством подвижных переносчиков. Эти работы приносят большую пользу практической медицине. Их результаты позволяют находить новые направления в синтезе антибиотиков с определенными свойствами. В плазмолемму бактерии встраиваются только те антибиотики, которые взаимодействуют с мембранными компонентами. Зная особенности клеточных мембран тех или иных микроорганизмов, а также тканей человека, осуществляют целенаправленный синтез антибиотиков, губительных для одних и интактных для других микробов, но, что важнее всего, безвредных для человека. Одну из групп ионофоров (веществ, усиливающих проницаемость мембран для ионов) образуют макроциклические антибиотики (валиномицин, энниатины и др.). Они понижают сопротивление липидных мембран электрическому току, но не за счет генерализованного усиления мембранной проницаемости для всех ионов, а посредством резко выраженной селективности в отношении калия.
ТРАНСПОРТ ВЕЩЕСТВ ЧЕРЕЗ БИОЛОГИЧЕСКИЕ МЕМБРАНЫ
Живые системы на всех уровнях организации - открытые системы. Поэтому транспорт веществ через биологические мембраны - необходимое условие жизни. С переносом веществ через мембраны связаны процессы метаболизма клетки, биоэнергетические процессы, образование биопотенциалов, генерация нервного импульса и др. Нарушение транспорта веществ через биомембраны приводит к различным патологиям. Лечение часто связано с проникновением лекарств через клеточные мембраны. Эффективность лекарственного препарата в значительной степени зависит от проницаемости для него мембраны.
Большое значение для описания транспорта веществ имеет понятие электрохимического потенциала. Химическим потенциалом данного вещества называется величина, численно равная энергии Гиббса, приходящаяся на один моль этого вещества. Электрохимический потенциал (μ) величина, численно равная энергии Гиббса на один моль данного вещества, помещенного в электрическом поле.
Для разбавленных растворов

где F = 96500 Кл/моль - число Фарадея, Z - заряд иона электролита (в элементарных единицах заряда), φ - потенциал электрического поля, Т - температура (в град. Кельвина).
Транспорт веществ через биологические мембраны можно разделить на два основных типа: пассивный и активный.
Пассивный перенос веществ через мембрану
Пассивный транспорт - это перенос вещества из мест с большим значением электрохимического потенциала к местам с его меньшим значением.
Пассивный транспорт идет с уменьшением энергии Гиббса, и поэтому этот процесс может идти самопроизвольно без затраты энергии.
Плотность потока вещества j при пассивном транспорте подчиняется уравнению Теорелла:

где U - подвижность частиц, С – концентрация,  - градиент электрохимического потенциала.
- градиент электрохимического потенциала.
Знак минус показывает, что перенос происходит в сторону убывания μ. Плотность потока вещества - это величина, численно равная количеству вещества, перенесенного за единицу времени через единицу площади поверхности, перпендикулярной направлению переноса:

Подставив в уравнение Теорелла выражение для электрохимического потенциала, получим для разбавленных растворов при μ0 = const уравнение Нернста-Планка:


|
| Рис. 21. Классификация видов пассивного транспорта |
Итак, могут быть две причины переноса вещества при пассивном транспорте: градиент концентрации  и градиент электрического потенциала
и градиент электрического потенциала  . Знаки минусов перед градиентами показывают, что градиент концентрации вызывает перенос вещества от мест с большей концентрацией к местам с его меньшей концентрацией; а градиент электрического потенциала вызывает перенос положительных зарядов от мест с большим к местам с меньшим потенциалом.
. Знаки минусов перед градиентами показывают, что градиент концентрации вызывает перенос вещества от мест с большей концентрацией к местам с его меньшей концентрацией; а градиент электрического потенциала вызывает перенос положительных зарядов от мест с большим к местам с меньшим потенциалом.
В отдельных случаях вследствие сопряжения этих двух причин может происходить пассивный перенос вещества от мест с меньшей концентрацией к местам с большей концентрацией, если второй член уравнения по модулю больше первого, и может происходить перенос вещества от мест с меньшим потенциалом к местам с большим потенциалом, если первый член уравнения по модулю больше второго. В случае неэлектролитов (Z=0) или отсутствия электрического поля (  =0) уравнение Теорелла переходит в уравнение:
=0) уравнение Теорелла переходит в уравнение:

Согласно соотношению Эйнштейна коэффициент диффузии D=URT. В результате получаем уравнение, описывающее простую диффузию - закон Фика:

На рис.21 представлена классификация основных видов пассивного транспорта через мембрану, а на рис. - основные разновидности простой диффузии через мембрану.
Диффузия - самопроизвольное перемещение вещества из мест с большей концентрацией в места с меньшей концентрацией вещества вследствие хаотического теплового движения молекул.
Диффузия вещества через липидный бислой (рис. 22а) вызывается градиентом концентрации в мембране. Плотность потока вещества по закону Фика

где  - концентрация вещества в мембране около одной ее поверхности и
- концентрация вещества в мембране около одной ее поверхности и  - около другой, l - толщина мембраны.
- около другой, l - толщина мембраны.
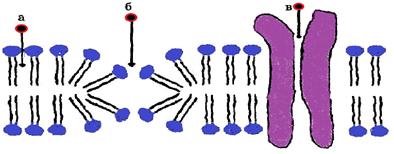
|
| Рис. 22. Основные разновидности простой диффузии через мембрану: через липидный бислой (а), через пору в липидном бислое (б), через белковую пору (в) |
Градиент концентрации приблизительно равен

Так как измерить концентрации  и
и  трудно, на практике пользуются формулой, связывающей плотность потока вещества через мембрану с концентрациями этого вещества не внутри мембраны, а снаружи в растворах около поверхностей мембраны, С1 и С2 (рис. 23):
трудно, на практике пользуются формулой, связывающей плотность потока вещества через мембрану с концентрациями этого вещества не внутри мембраны, а снаружи в растворах около поверхностей мембраны, С1 и С2 (рис. 23):


|
| Рис. 23. Схема простой диффузии через липидный бислой мембраны |
где Р - коэффициент проницаемости мембраны. Так как плотность потока вещества j имеет размерность моль/м2*с, концентрация С - моль/м3, размерность коэффициента проницаемости Р - м/с.
Коэффициент проницаемости мембраны зависит от свойств мембраны и переносимых веществ. Если считать концентрации вещества у поверхности в мембране прямо пропорциональными концентрациям у поверхности вне мебраны, то:
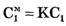

Величина К носит название коэффициента распределения, который показывает соотношение концентрации вещества вне мембраны и внутри ее. Подставив примембранные концентрации, получим:

Из уравнений видно, что коэффициент проницаемости:

Коэффициент проницаемости тем больше, чем больше коэффициент диффузии (чем меньше вязкость мембраны), чем тоньше мембрана (чем меньше l) и чем лучше вещество растворяется в мембране (чем больше К).
Хорошо растворимы в фосфолипидной фазе мембраны неполярные вещества, например органические жирные кислоты, эфиры. Этим вещества хорошо проникают через липидную фазу мембраны.
 
|
| Рис. 24 Строение молекулы ионофора (молекулы валиномицина): а - химическая формула; б - общий вид (кружочками обозначены химические группы, двойными черточками - водородные связи) |
Плохо проходят через липидный бислой полярные, водорастворимые вещества: соли, основания, сахара, аминокислоты, спирты. На первый взгляд, представляется необъяснимым сравнительно большое значение коэффициента проницаемости липидной мембраны для воды. В последнее время проникновение через липидные бислойные мембраны мелких полярных молекул связывают с образованием между жирнокислотными хвостами фосфолипидных молекул при их тепловом движении небольших свободных полостей - кинков (от англ. kink - петля), образованных гош-транс-гош-конфигурацией липидных молекул. Вследствие теплового движения хвостов кинки могут перемещаться поперек мембраны и переносить попавшие в них мелкие молекулы, в первую очередь молекулы воды.
Через липидные и белковые поры (рис. 22в) сквозь мембрану проникают молекулы нерастворимых в липидах веществ и водорастворимые гидратированные ионы (окруженные молекулами воды). Для жиронерастворимых веществ и ионов мембрана выступает как молекулярное сито: чем больше размер молекулы, тем меньше проницаемость мембраны для этого вещества.
Избирательность переноса обеспечивается набором в мембране пор определенного радиуса, соответствующих размеру проникающей частицы. Это распределение зависит от мембранного потенциала. Так, избирательные для ионов калия поры в мембране эритроцитов имеют сравнительно низкий коэффициент проницаемости, равный 4пм/с при мембранном потенциале 80 мВ, который уменьшается в четыре раза с понижением потенциала до 40 мВ. Проницаемость мембраны аксона кальмара для ионов калия при уровне потенциала возбуждения определяется калиевыми каналами, радиус которых численно оценивается как сумма кристаллического радиуса иона калия и толщины одной гидратной оболочки. Следует подчеркнуть, что селективность ионных каналов неабсолютна, каналы доступны и для других ионов, но с меньшими значениями Р.
Максимальная величина Р соответствует ионам калия. Ионы с большими кристаллическими радиусами (рубидий, цезий) имеют меньшие Р, по-видимому, потому, что их размеры с одной гидратной оболочкой превышают размер канала.
В биологических мембранах был обнаружен еще один вид диффузии - облегченная диффузия. Облегченная диффузия происходит при участии молекул переносчиков. Например, валиномицин - переносчик ионов калия. Молекула валиномицина имеет форму манжетки, устланной внутри полярными группами, а снаружи - неполярными (рис. 24).

|
| Рис. 25. Схема переноса валиномицином ионов калия через мембрану |
В силу особенности своего химического строения валиномицин, во-первых способен образовывать комплекс с ионами калия, попадающими внутрь молекулы-манжетки, и, во-вторых, валиномицин растворим в липидной фазе мембраны, так как снаружи его молекула неполярна. Молекулы валиномицина, оказавшиеся у поверхности мембраны, могут захватывать из окружающего раствора ионы калия (рис. 25). Диффундируя в мембране, молекулы переносят калий через мембрану, и некоторые из них отдают ионы в раствор по другую сторону мембраны. Таким образом и происходит перенос иона калия через мембрану валиномицином.
Разумеется, перенос калия валиномицином может происходить через мембрану и в одну и в другую сторону. Поэтому, если концентрации калия по обе стороны мембраны одинаковы, поток калия в одну сторону будет такой же, что и в другую, и в результате переноса калия через мембрану не будет. Но если с одной стороны концентрация калия больше, чем с другой, то здесь ионы будут чаще захватываться молекулами переносчика, чем с другой стороны, и поток калия в сторону уменьшения [К+] будет больше, чем в противоположную.
Облегченная диффузия, таким образом, происходит от мест с большей концентрацией переносимого вещества к местам с меньшей концентрацией. По-видимому, облегченной диффузией объясняется также перенос через биологические мембраны аминокислот, сахаров и других биологически важных веществ.
Отличия облегченной диффузии от простой:
1) перенос вещества с участием переносчика происходит значительно быстрее;
2) облегченная диффузия обладает свойством насыщения: при увеличении концентрации с одной стороны мембраны плотность потока вещества возрастает лишь до некоторого предела, когда все молекулы переносчика уже заняты;
3) при облегченной диффузии наблюдается конкуренция переносимых веществ в тех случаях, когда переносчиком переносятся разные вещества; при этом одни вещества переносятся лучше, чем другие, и добавление одних веществ затрудняет транспорт других; так, из сахаров глюкоза переносится лучше, чем фруктоза, фруктоза лучше, чем ксилоза, а ксилоза лучше, чем арабиноза, и т.д.;
4) есть вещества, блокирующие облегченную диффузию - они образуют прочный комплекс с молекулами переносчика, например, флоридзин подавляет транспорт сахаров через биологическую мембрану.
Если транспорт какого-либо вещества через биологическую мембрану обладает этими особенностями, можно сделать предположение, что имеет место облегченная диффузия.
Разновидностью облегченной диффузии является транспорт с помощью неподвижных молекул-переносчиков, фиксированных определенным образом поперек мембраны. При этом молекула переносимого вещества передается от одной молекулы переносчика к другой, как по эстафете.
Фильтрацией называется движение раствора через поры в мембране под действием градиента давления. Скорость переноса при фильтрации прямо пропорциональная разности давлений им обратно пропорциональна гидравлическому сопротивлению. Явление фильтрации играет важную роль в процессах переноса воды через стенки кровеносных сосудов.
Осмос - преимущественное движение молекул воды через полупроницаемые мембраны (непроницаемые для растворенного вещества и проницаемые для воды) из мест с меньшей концентрацией растворенного вещества в места с большей концентрацией. Осмос - по сути дела, простая диффузия воды из мест с ее большей концентрацией в места с меньшей концентрацией воды. Осмос играет большую роль во многих биологических явлениях. Явление осмоса обусловливает гемолиз эритроцитов в гипотонических растворах.
Активный транспорт веществ.
Активный транспорт - это перенос вещества из мест с меньшим значением электрохимического потенциала в места с его большим значением.
Активный транспорт в мембране сопровождается ростом энергии Гиббса, он не может идти самопроизвольно, а только в сопряжении с процессом гидролиза аденозинтрифосфорной кислоты (АТФ), то есть за счет затраты энергии, запасенной в макроэргических связях АТФ.
Активный транспорт веществ через биологические мембраны имеет огромное значение. За счет активного транспорта в организме создаются градиенты концентраций, градиенты электрических потенциалов, градиенты давления и т.д., поддерживающие жизненные процессы, то есть с точки зрения термодинамики активный перенос удерживает организм в неравновесном состоянии, поддерживает жизнь.
Существование активного транспорта веществ через биологические мембраны впервые было доказано в опытах Уссинга (1949 г.) на примере переноса ионов натрия через кожу лягушки.
Электрогенные ионные насосы
Согласно современным представлениям, в биологических мембранах имеются ионные насосы, работающие за счет свободной энергии гидролиза АТФ, - специальные системы интегральных белков (транспортные АТФазы).
В настоящее время известны три типа электрогенных ионных насосов, осуществляющих активный перенос ионов через мембрану (рис. 26).
Перенос ионов транспортными АТФазами происходит вследствие сопряжения процессов переноса с химическими реакциями, за счет энергии метаболизма клеток.
При работе K+-Na+-АТФазы за счет энергии, освобождающейся при гидролизе каждой молекулы АТФ, в клетку переносится два иона калия и одновременно из клетки выкачиваются три иона натрия. Таким образом, создается повышенная по сравнению с межклеточной средой концентрация в клетке ионов калия и пониженная натрия, что имеет огромное физиологическое значение.
В Са++-АТФазе за счет энергии гидролиза АТФ переносятся два иона кальция, а в Н+-помпе - два протона.
 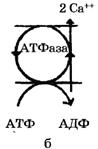 
|
| Рис. 26. Виды ионных насосов: а - K+-Na+-ATФаза в цитоплазматических мембранах (K+-Na+-нacoc); б - Са2+-АТФаза (Са2+-насос); в - Н+-АТФаза в энергосопрягающих мембранах митохондрий, хлоропластов (Н+-насос, или протонная помпа) |
Молекулярный механизм работы ионных АТФаз до конца не изучен. Тем не менее прослеживаются основные этапы этого сложного ферментативного процесса. В случае К+-Ка+-АТФазы насчитывается семь этапов переноса ионов, сопряженных с гидролизом АТФ: 1) образование комплекса фермента с АТФ на внутренней поверхности мембраны (эта реакция активируется ионами магния); 2) связывание комплексом трех ионов натрия; 3) фосфорилирование фермента с образованием аденозиндифосфата; 4) переворот (флип-флоп) фермента внутри мембраны; 5) реакция ионного обмена натрия на калий, происходящая на внешней поверхности мембраны; 6) обратный переворот ферментного комплекса с переносом ионов калия внутрь клетки и 7) возвращение фермента в исходное состояние с освобождением ионов калия и неорганического фосфата (Р). Таким образом, за полный цикл происходят выброс из клетки трех ионов натрия, обогащение цитоплазмы двумя ионами калия и гидролиз одной молекулы АТФ.
Вторичный активный транспорт ионов.
Помимо ионных насосов, рассмотренных выше, известны сходные системы, в которых накопление веществ сопряжено не с гидролизом АТФ, а с работой окислительно-восстановительных ферментов или фотосинтезом. Транспорт веществ в этом случае является вторичным, опосредованным мембранным потенциалом и/или градиентом концентрации ионов при наличии в мембране специфических переносчиков. Такой механизм переноса получил название вторичного активного транспорта. Наиболее детально этот механизм рассмотрен Питером Митчелом (1966 г.) в хемиосмотической теории окислительного фосфорилирования. В плазматических и субклеточных мембранах живых клеток возможно одновременное функционирование первичного и вторичного активного транспорта. Примером может служить внутренняя мембрана митохондрий. Ингибирование АТФазы в ней не лишает частицу способности накапливать вещества за счет вторичного активного транспорта. Такой способ накопления особенно важен для тех метаболитов, насосы для которых отсутствуют (сахара, аминокислоты).
В настоящее время достаточно глубоко исследованы три схемы вторичного активного транспорта. Для простоты рассмотрен транспорт одновалентных ионов с участием молекул-переносчиков. При этом подразумевается, что переносчик в нагруженном или ненагруженном состоянии одинаково хорошо пересекает мембрану. Источником энергии служит мембранный потенциал и/или градиент концентрации одного из ионов. Схемы показаны на рис. 26. Однонаправленный перенос иона в комплексе со специфическим переносчиком получил название унипорта. При этом через мембрану переносится заряд либо комплексом, если молекула переносчика электронейтральна, либо пустым переносчиком, если перенос обеспечивается заряженным переносчиком. Результатом переноса будет накопление ионов за счет снижения мембранного потенциала. Такой эффект наблюдается при накоплении ионов калия в присутствии валиномицина в энергизированных митохондриях.
Встречный перенос ионов с участием одноместной молекулы-переносчика получил название антипорта. Предполагается при этом, что молекула-переносчик образует прочный комплекс с каждым из переносимых ионов. Перенос осуществляется в два этапа: сначала один ион пересекает мембрану слева направо, затем второй ион - в обратном направлении. Мембранный потенциал при этом не меняется. Разность концентраций одного из переносимых ионов является движущей силой этого процесса. Если исходно разность концентрации второго иона отсутствовала, то результатом переноса станет накопление второго иона за счет уменьшения разности концентраций первого. Классическим примером антипорта служит перенос через клеточную мембрану ионов калия и водорода с участием молекулы антибиотика нигерицина.
Совместный однонаправленный перенос ионов с участием двухместного переносчика называется симпортом. Предполагается, что в мембране могут находиться две электронейтральные частицы: переносчик в комплексе с катионом и анионом и пустой переносчик. Поскольку мембранный потенциал в такой схеме переноса не изменяется, то причиной переноса может быть разность концентраций одного из ионов. Считается, что по схеме симпорта осуществляется накопление клетками аминокислот. Калий-натриевый насос (см. рис. 27) создает начальный градиент концентрации ионов натрия, которые затем по схеме симпорта способствуют накоплению аминокислот. Из схемы симпорта следует, что этот процесс должен сопровождаться значительным смещением осмотического равновесия, поскольку в одном цикле через мембрану переносятся две частицы в одном направлении.
  
|
| Рис. 27. Основные схемы вторичного активного транспорта ионов |
В процессе жизнедеятельности границы клетки пересекают разнообразные вещества, потоки которых эффективно регулируются. С этой задачей справляется клеточная мембрана с встроенными в нее транспортными системами, включающими ионные насосы, систему молекул-переносчиков и высокоселективные ионные каналы.
Такое обилие систем переноса на первый взгляд кажется излишним, ведь работа только ионных насосов позволяет обеспечить характерные особенности биологического транспорта: высокую избирательность, перенос веществ против сил диффузии и электрического поля. Парадокс заключается, однако, в том, что количество потоков, подлежащих регулированию, бесконечно велико, в то время как насосов всего три (см. рис. 26). В этом случае особое значение приобретают механизмы ионного сопряжения, получившие название вторичного активного транспорта, в которых важную роль играют диффузные процессы. Таким образом, сочетание активного транспорта веществ с явлениями диффузионного переноса в клеточной мембране - та основа, которая обеспечивает жизнедеятельность клетки.
Дата добавления: 2019-11-25; просмотров: 343; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
