А - эндокринная клетка желудочно-кишечного тракта. Б - регуляция секреции гастрина в антральном отделе желудка
Глава 10. Пищеварительная система
Краткий обзор функционирования пищеварительной системы
Пищевые продукты, которые мы потребляем, не могут быть усвоены в таком виде. Для начала пища должна быть обработана механически, переведена в водный раствор и расщеплена химически. Неиспользованные остатки необходимо выводить из организма. Поскольку наш желудочно-кишечный тракт состоит из тех же составляющих, что и пища, то его внутренняя поверхность должна быть защищена от воздействия пищеварительных ферментов. Так как мы принимаем пищу чаще, чем она переваривается и продукты расщепления абсорбируются, а кроме того выведение шлаков осуществляется один раз в день, в желудочно-кишечном тракте должна быть предусмотрена возможность для хранения пищи в течение определенного времени. Координация всех этих процессов осуществляется в первую очередь: (1) автономной или гастроэнтеральной (внутренней) нервной системой (нервные сплетения желудочно-кишечного тракта); (2) приходящими извне нервами вегетативной нервной системы и висцеральными афферентами, а также (3) многочисленными гормонами желудочно-кишечного тракта.
Наконец, тонкий эпителий пищеварительной трубки представляет собой гигантские ворота, через которые в организм могут проникать возбудители болезней. Существует целый ряд специфических и неспецифических механизмов защиты этой границы между внешней средой и внутренним миром организма.
|
|
|
В желудочно-кишечном тракте жидкая внутренняя среда организма и внешняя среда отделены друг от друга лишь очень тонким (20-40 мкм), но огромным по площади слоем эпителия (около 10 м2), через который могут всасываться необходимые для организма вещества.
Желудочно-кишечный тракт состоит из следующих отделов: рот, глотка, пищевод, желудок, тонкий кишечник, толстый кишечник, прямая кишка и анус. К ним присоединены многочисленные экзокринные железы: слюнные железы
ротовой полости, железы Эбнера, желудочные железы, поджелудочная железа, желчная система печени и крипты тонкого и толстого кишечника.
Моторная активность включает жевание во рту, глотание (глотка и пищевод), размельчение и перемешивание пищи с желудочным соком в дистальном отделе желудка, перемешивание (рот, желудок, тонкий кишечник) с пищеварительными соками, перемещение во всех частях желудочнокишечного тракта и временное хранение (проксимальный отдел желудка, слепая кишка, восходящая часть ободочной кишки, прямая кишка). Время прохождения пищи по каждому из участков желудочно-кишечного тракта представлено на рис. 10-1. Секреция происходит по всей длине пищеварительного тракта. С одной стороны, секреты служат смазывающими и защитными пленками, а с другой стороны, содержат ферменты и другие вещества, обеспечивающие переваривание. Секреция подразумевает транспорт солей и воды из интерстициума в просвет желудочно-кишечного тракта, а также синтез белков в секреторных клетках эпителия и их транспорт через апикальную (люминальную) плазматическую мембрану в просвет пищеварительной трубки. Хотя секреция и может происходить спонтанно, большая часть железистой ткани находится под контролем нервной системы и гормонов.
|
|
|
Переваривание (ферментативный гидролиз белков, жиров и углеводов), происходящее во рту, желудке и тонком кишечнике является одной из основных функций пищеварительного тракта. В его основе лежит работа ферментов.
Реабсорбция (или в русском варианте всасывание) подразумевает транспорт солей, воды и органических веществ (например, глюкозы и аминокислот из просвета желудочно-кишечного тракта в кровь). В отличие от секреции, размеры реабсорбции определяются, скорее, предложением реабсорбируемых веществ. Реабсорбция ограничена определенными участками пищеварительного тракта: тонкий кишечник (питательные вещества, ионы и вода) и толстый кишечник (ионы и вода).
|
|
|
Рис. 10-1. Желудочно-кишечный тракт: общая схема строения и время прохождения пищи.
Пища обрабатывается механически, перемешивается с пищеварительными соками и расщепляется химически. Продукты расщепления, а также вода, электролиты, витамины и микроэлементы реабсорбируются. Железы выделяют слизь, ферменты, ионы H+ и HCO3-. Печень поставляет желчь, необходимую для переваривания жиров, а также содержит продукты, подлежащие выведению из организма. Во всех отделах желудочно-кишечного тракта происходит продвижение содержимого в проксимально-дистальном направлении, при этом промежуточные места хранения делают возможным дискретный прием пищи и опорожнение кишечного тракта. Время опорожнения имеет индивидуальные особенности и зависит прежде всего от состава пищи
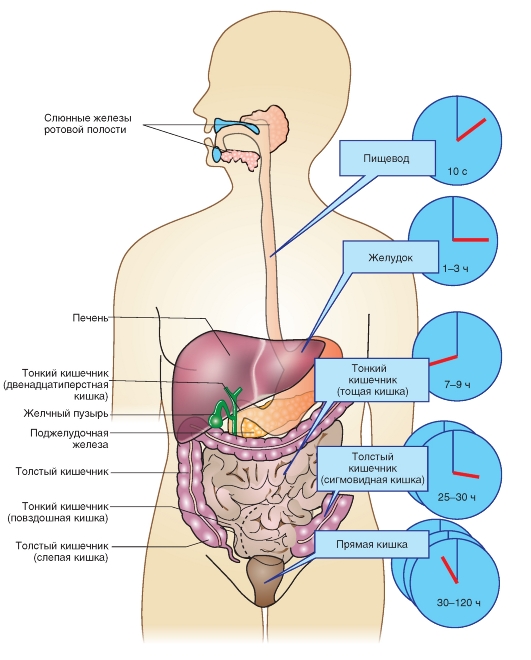
Функции и состав слюны
Слюна образуется в трех больших парных слюнных железах: околоушных (Glandula parotis), подчелюстных (Glandula submandibularis) и подъязычных (Glandula sublingualis). Кроме того, желез, продуцирующих слизь, много в слизистых оболочках щек, нёба и глотки. Серозную жидкость выделяют также железы Эбнера, расположенные в основании языка.
В первую очередь слюна необходима для ощущения вкусовых стимулов, для сосания (у новорожденных), для гигиены полости рта и для смачивания твердых кусков пищи (при подготовке их к проглатыванию). Пищеварительные ферменты слюны необходимы, кроме того, для удаления остатков пищи из полости рта.
|
|
|
Функции слюны человека следующие: (1) растворитель для питательных веществ, которые лишь в растворенном виде могут быть восприняты вкусовыми рецепторами. Кроме того, слюна содержит муцины - смазывающие вещества, - которые облегчают пережевывание и проглатывание твердых частиц пищи. (2) Увлажняет ротовую полость и препятствует распространению возбудителей инфекций, за счет содержания лизоцима, пероксидазы и иммуноглобулина A (IgA), т.е. веществ, обладающих неспецифическими или, в случает с IgA, специфическими антибактериальными и противовирусными свойствами. (3) Содержит пищеварительные ферменты. (4) Содержит различные факторы роста, такие как NGF (nerve growth factor) и EGF (epidermal growth factor). (5) Младенцам слюна необходима для плотного присасывания губ к соску.
Она имеет слегка щелочную реакцию. Осмоляльность слюны зависит от скорости протекания слюны по протокам слюнных желез (рис. 10-2 А).
Слюна образуется в два этапа (рис. 10-2 Б). Сначала дольки слюнных желез производят изотоничную первичную слюну, которая вторично модифицируется во время прохождения по выводящим протокам железы. Na+ и Cl- реабсорбируются, а K+ и бикарбонат секретируются. Обычно реабсорбируется больше ионов, чем выделяется, поэтому слюна становится гипотоничной.
Первичная слюна возникает в результате секреции. В большинстве слюнных желез белок-переносчик, обеспечивающий перенос в клетку Na+-K+-2Cl- (котранспорт), встроен в базолатеральную мемб-
рану клеток ацинуса. С помощью данного белкапереносчика обеспечивается вторично-активное накопление в клетке ионов Cl-, которые затем пассивно выходят в просвет протоков железы.
На втором этапе в выводящих протоках из слюны реабсорбируются Na+ и Cl-. Поскольку эпителий протока сравнительно непроницаем для воды, слюна в нем становится гипотоничной. Одновременно (небольшие количества) K+ и HCO3-выделяются эпителием протока в его просвет. По сравнению с плазмой крови слюна бедна ионами Na+ и Cl-, но богата ионами K+ и HCO3-. При большой скорости течения слюны транспортные механизмы выводящих протоков не справляются с нагрузкой, поэтому концентрация K+ падает, а NaCl - возрастает (рис. 10-2). Концентрация HCO3- практически не зависит от скорости течения слюны по протокам желез.
Ферменты слюны - (1) α-амилаза (называемая также птиалин). Этот фермент выделяется почти исключительно околоушной слюнной железой. (2) Неспецифические липазы, которые выделяются железами Эбнера, расположенными в основании языка, особенно важны для младенца, поскольку они могут переваривать жир молока уже в желудке благодаря ферменту слюны, проглоченному одновременно с молоком.
Выделение слюны регулируется исключительно ЦНС. Стимуляция ее обеспечивается рефлекторно под влияниемзапаха и вкуса пищи. Все большие слюнные железы человека иннервируются как симпатической, так ипарасимпатической нервной системой. В зависимости от количеств медиаторов, ацетилхолина (M1-холинорецепторы) и норадреналина (β2-адренорецепторы), состав слюны меняется вблизи клеток ацинуса. У человека симпатические волокна вызывают секрецию более тягучей слюны, бедной водой, чем при стимуляции парасимпатической системы. Физиологический смысл такой двойной иннервации, а также различия в составе слюны пока не известны. Ацетилхолин кроме того вызывает (через M3-холинорецепторы) сокращение миоэпителиальных клеток вокруг ацинуса (рис. 10-2 В), в результате чего содержимое ацинуса выдавливается в проток железы. Также ацетилхолин способствует образованию калликреинов, которые высвобождают брадикинин из кининогена плазмы крови. Брадикинин обладает сосудорасширяющим действием. Расширение сосудов усиливает выделение слюны.
Рис. 10-2. Слюна и ее образование.
А - осмоляльность и состав слюны зависят от скорости тока слюны. Б - два этапа образования слюны. В - миоэпителиальные клетки в слюнной железе. Можно предположить, что миоэпителиальные клетки предохраняют дольки от расширения и разрыва, которые могут быть вызнаны высоким давлением в них в результате секреции. В системе протока они могут выполнять функцию, направленную на сокращение или на расширение просвета протока

Желудок
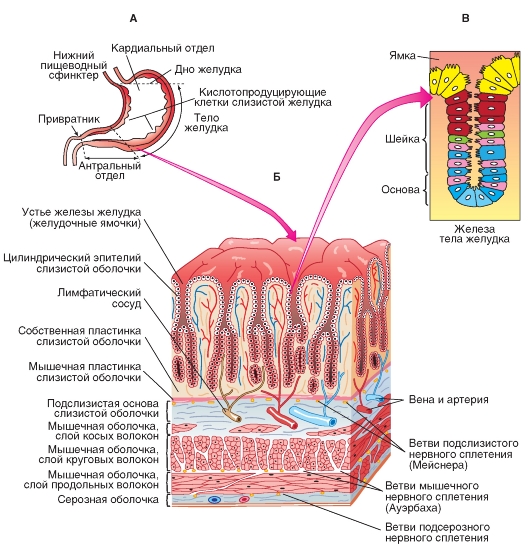
Стенка желудка, показанная на его срезе (рис. 10-3 Б) образована четырьмя оболочками: слизистой, подслизистой, мышечной, серозной. Слизистая оболочка образует продольные складки и состоит из трех слоев: эпителиального слоя, собственной пластинки, мышечной пластинки. Рассмотрим все оболочки и слои.
Эпителиальный слой слизистой оболочки представлен однослойным цилиндрическим железистым эпителием. Он образован железистыми эпителиоцитами - мукоцитами, секретирующими слизь. Слизь формирует непрерывный слой толщиной до 0,5 мкм, являясь важным фактором защиты слизистой желудка.
Собственная пластинка слизистой оболочки образована рыхлой волокнистой соединительной тканью. В ней находятся мелкие кровеносные и лимфатические сосуды, нервные стволы, лимфоидные узлы. Основными структурами собственной пластинки являются железы.
Мышечная пластинка слизистой оболочки состоит из трех слоев гладкой мышечной ткани: внутреннего и наружного циркулярных; среднего продольного.
Подслизистая оболочка образована рыхлой волокнистой неоформленной соединительной тканью, содержит артериальное и венозное сплетения, ганглии подслизистого нервного сплетения Мейснера. В некоторых случаях здесь могут располагаться крупные лимфоидные фолликулы.
Мышечная оболочка образована тремя слоями гладкой мышечной ткани: внутренний косой, средний циркулярный, наружный продольный. В пилорическом отделе желудка циркулярный слой достигает максимального развития, формируя пилорический сфинктер.
Серозная оболочка образована двумя слоями: слоем рыхлой волокнистой неоформленной соединительной ткани и лежащим на нем мезотелием.
Все железы желудка, которые являются основными структурами собственной пластинки - простые трубчатые железы.Они открываются в желудочные ямки и состоят из трех частей: дна, тела и шейки (рис. 10-3 В). В зависимости от локализации железы делятся на кардиальные, главные (или фундальные) и пилоричекие. Строение и клеточный состав этих желез неодинаковы. В количественном отношении преобладают главные железы. Они являются наиболее слаборазветвленными из всех желез желудка. На рис. 10-3 В представлена простая трубчатая железа тела желудка. Клеточный состав этих желез включает (1) поверхностные эпителиальные клетки, (2) слизистые клетки шейки железы (или добавочные), (3) регенеративные клетки,
(4) париетальные клетки (или обкладочные клетки),
(5) главные клетки и (6) эндокринные клетки. Таким образом, основная поверхность желудка покрыта однослойным высокопризматическим эпителием, который прерывается многочисленными ямками - местами выхода протоков желез желудка (рис. 10-3 Б).
Артерии, проходят через серозную и мышечную оболочки, отдавая им мелкие ветви, распадающиеся до капилляров. Основные стволы образуют сплетения. Самое мощное сплетение - подслизистое. От него отходят мелкие артерии в собственную пластинку, где образуют слизистое сплетение. От последнего отходят капилляры, оплетающие железы и питающие покровный эпителий. Капилляры сливаются в крупные звездчатые вены. Вены образуют сплетение слизистой оболочки, а затем подслизистое венозное сплетение
(рис. 10-3 Б).
Лимфатическая система желудка берет начало от слепо начинающихся прямо под эпителием и вокруг желез лимфокапилляров слизистой оболочки. Капилляры сливаются в подслизистое лимфатическое сплетение. Отходящие от него лимфатические сосуды проходят мышечную оболочку, принимая в себя сосуды из лежащих между мышечными слоями сплетений.
Рис. 10-3. Анатомические и функциональные отделы желудка.
А - функционально желудок разделяют на проксимальный отдел (тоническое сокращение: функция хранения пищи) и дистальный отдел (функция перемешивания и переработки). Перистальтические волны дистального отдела желудка начинаются в области желудка, содержащей клетки гладкой мускулатуры, мембранный потенциал которых колеблется с наибольшей частотой. Клетки этой области являются водителями ритма желудка. Схема анатомического строения желудка, к которому подходит пищевод, представлена на рис. 10-3 А. Желудок включает в себя несколько отделов - кардиальный отдел желудка, дно желудка, тело желудка с пейсмейкерной зоной, антральный отдел желудка, привратник. Далее начинается двенадцатиперстная кишка. Желудок можно также разделить на проксимальный отдел желудка и дистальный отдел желудка. Б - разрез стенки желудка. В - трубчатая железа тела желудка
Клетки трубчатой железы желудка
На рис. 10-4 Б показана трубчатая железа тела желудка, а на вставке (рис. 10-4 А) вынесены ее слои, обозначенные на панели. Рис. 10-4 Б демонстрирует клетки, входящие в состав простой трубчатой железы тела желудка. Среди этих клеток мы уделяем внимание основным, играющим выраженную роль в физиологии желудка. Это, прежде всего, париетальные клетки, или обкладочные клетки (рис. 10-4 В). Основная роль этих клеток - выделение соляной кислоты.
Активированные обкладочные клетки выделяют большие количества изотоничной жидкости, которая содержит соляную кислоту в концентрации до 150 ммоль; активация сопровождается выраженными морфологическими изменениями обкладочных клеток (рис. 10-4 В). Слабо активированная клетка обладает сетью узких, разветвленных канальцев (диаметр просвета - около 1 мкм), которые открываются в просвет железы. Кроме того, в слое цитоплазмы, граничащем с просветом канальца, наблюдается большое количество тубуловезикул. В мембрану тубуловезикул встроены K+/H+-ATФаза и ионныеK+- и Cl-- каналы. При сильной активации клетки тубуловезикулы встраиваются в мембрану канальцев. Таким образом значительно увеличивается поверхность мембраны канальцев и в нее встраиваются необходимые для секреции HCl транспортные белки (K+/H+-ATФаза) и ионные каналы для K+ и Cl- (рис. 10-4 Г). При снижении уровня активации клетки тубуловезикулярная мембрана отщепляется от мембраны канальца и сохраняется в везикулах.
Механизм HCl-секреции сам по себе необычен (рис. 10-4 Г), поскольку он осуществляется H+-(и K+)-транспортирующей ATФазой в люминальной (канальцевой) мембране, а не так как это часто встречается во всем организме - с помощью Na+/K+-ATФазы базолатеральной мембраны. Na+/K+-ATФаза обкладочных клеток обеспечивает постоянство внутренней среды клетки: в частности, способствует клеточному накоплению K+.
Соляная кислота нейтрализуется, так называемыми, антацидами. Кроме того секреция HCl может затормаживаться за счет блокады ранитидином H2-рецепторов (Histamine2-receptors) обкладочных клеток или торможения активности H+/K+-ATФазыомепразолом.
Главные клетки выделяют эндопептидазы. Пепсин - протеолитический фермент - выделяется главными клетками желез желудка человека в неактивной форме (пепсиноген). Активация пепсиногена осуществляется аутокаталитически: вначале от молекулы пепсиногена в присутствии соляной кислоты (pH<3) отщепляется пептидная цепочка длиной около 45 аминокислот и образуется активный пепсин, который способствует активации других молекул. Активация пепсиногена поддерживает стимуляцию обкладочных клеток, выделяющих HCl. Встречающийся в желудочном соке маленького ребенкагастриксин (= пепсин C) соответствует лабферменту (химозин, реннин) теленка. Он расщепляет определенную молекулярную связь между фенилаланином и метионинон (Phe-Met-связь) в казеиногене (растворимый белок молока), благодаря чему этот белок превращается в нерастворимый, но лучше перевариваемый казеин («свертывание» молока).
Рис. 10-4. Клеточное строение простой трубчатой железы тела желудка и функции основных клеток, определяющих ее строение.
А - трубчатая железа тела желудка. Обычно 5-7 таких желез вливается в ямку на поверхности слизистой оболочки желудка. Б - клетки, входящие в состав простой трубчатой железы тела желудка. В - обкладочные клетки в покое (1) и при активации (2). Г - секреция HCl обкладочными клетками. В секреции HCl можно обнаружить два компонента: первый компонент (не подвержен стимуляции) связан с активностью Na+/К+-АТФазы, локализованной в базолатеральной мембране; второй компонент (подвержен стимуляции) обеспечивается Н+/К+-АТФазой. 1. Na+/К+-АТФаза поддерживает в клетке высокую концентрацию ионов К+, которые могут выходить из клетки через каналы в полость желудка. Одновременно Na+/К+-АТФаза способствует выведению Na+ из клетки, который накапливается в клетке в результате работы белка-переносчика, обеспечивающего по механизму вторичного активного транспорта обмен Na+/H+ (антипорт). На каждый выведенный ион Н+ в клетке остается один OH-ион, который взаимодействует с CO2 с образованием HCO3-. Катализатором этой реакции является карбоангидраза. HCO3- выходит из клетки через базолатеральную мембрану в обмен на Cl-, который затем секретируется в полость желудка (через Cl--каналы апикальной мембраны). 2. На люминальной мембране H+/ К+-АТФаза обеспечивает обмен ионов К+ на ионы H+, которые выходят в полость желудка, которая обогащается HCl. На каждый выделенный ион H+ и в данном случае с противоположной стороны (через базолатеральную мембрану) клетку покидает один анион HCO3-. Ионы К+ накапливаются в клетке, выходят в полость желудка через К+-каналы апикальной мембры и затем снова попадают в клетку в результате работы Н+/К+-АТФазы (циркуляция К+ через апикальную мембрану)

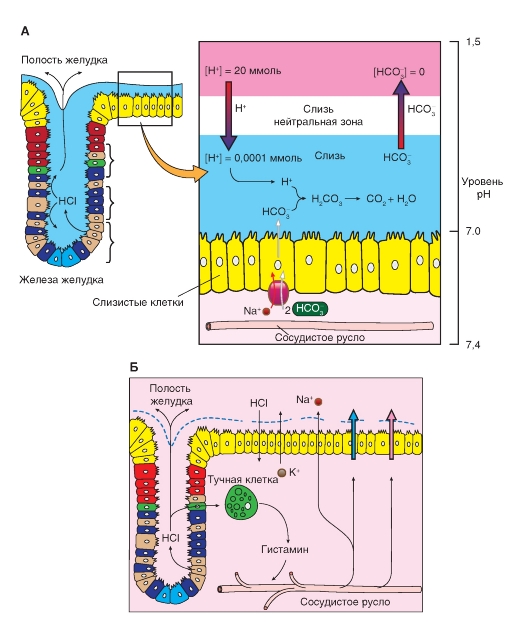
Защита от самопереваривания стенки желудка
Целостности эпителия желудка прежде всего угрожает протеолитическое действие пепсина в присутствии соляной кислоты. От такого самопереваривания желудок защищает толстый слой тягучей слизи, которая выделяется эпителием стенки желудка, добавочными клетками желез дна и тела желудка, а также кардиальными и пилорическими железами (рис. 10-5 А). Хотя пепсин и может расщеплять муцины слизи в присутствии соляной кислоты, большей частью это ограничивается самым верхним слоем слизи, поскольку более глубокие слои содержат бикарбонат, кото-
рый выделяется клетками эпителия и способствует нейтрализации соляной кислоты. Таким образом, через слой слизи существует Н+-градиент: от более кислого в полости желудка до щелочного на поверхности эпителия (рис. 10-5 Б).
Повреждение эпителия желудка необязательно ведет к серьезным последствиям при условии, что дефект будет быстро устранен. В действительности, такие повреждения эпителия встречаются достаточно часто; однако они быстро устраняются за счет того, что соседние клетки распластываются, мигрируют в боковом направлении и закрывают дефект. Вслед за этим встраиваются новые клетки, образующиеся в результате митотического деления.
Рис. 10-5. Самозащита стенки желудка от переваривания благодаря секреции слизи и бикарбоната
Структура стенки тонкой кишки
Тонкий кишечник состоит из трех отделов - двенадцатиперстной, тощей и подвздошной кишок.
Стенка тонких кишок состоит из различных слоев (рис. 10-6). В целом, снаружи под серозной оболочкой проходит внешняя мышечная оболочка, которая состоит из наружного продольного мышечного слоя и внутреннего кольцевого мышечного слоя, и самым внутренним является мышечная пластинка слизистой оболочки, которая отделяетсубмукозный слой от мукозного. Гладкая мускулатура кишечника состоит из маленьких, веретенообразных клеток, формирующих пучки и образующих поперечные связи с соседними пучками. Внутри одного пучка клетки соединены друг с другом как механически, так и электрически. Благодаря таким электрическим контактам потенциалы действия распространяются (через межклеточные щелевые контакты: gap junctions) на весь пучок (а не лишь на отдельные мышечные клетки).
Мышцы внешнего слоя продольной мускулатуры обеспечивают сокращение стенки кишечника. В результате стенка кишечника смещается относительно химуса (пищевой кашицы), что способствует лучшему перемешиванию химуса с пищеварительными соками. Кольцевая мускулатура сужает просвет кишечника, а мышечная пластинка слизистой оболочки(Lamina muscularis mucosae) обеспечивает движение ворсинок. Нервную систему желудочнокишечного тракта (гастроэнтеральную нервную систему) образуют два нервных сплетения: межмышечное нервное сплетение и подслизистое нервное сплетение. ЦНС способна оказывать влияние на работу нервной системы желудочно-кишечного тракта через симпатические и парасимпатические нервы, которые подходят к нервным сплетениям пищевой трубки. В нервных сплетениях начинаются афферентные висцеральные волокна, которые
передают нервные импульсы в ЦНС. (Подобное устройство стенки наблюдается также в пищеводе, желудке, толстом кишечнике и прямой кишке). Для ускорения реабсорбции поверхность слизистой оболочки тонкого кишечника увеличена за счет складок, ворсинок и щеточной каемки.
Внутренняя поверхность тонкой кишки имеет характерный рельеф благодаря наличию ряда образований - циркулярных складок Керкринга, ворсинок и крипт (кишечные железы Либеркюна). Эти структуры увеличивают общую поверхность тонкого кишечника, что способствует выполнению его основных функций пищеварения. Кишечные ворсинки и крипты являются основными структурно-функциональными единицами слизистой оболочки тонкого кишечника.
Слизистая (или мукозная оболочка) состоит из трех слоев - эпителиального, собственной пластинки и мышечной пластинки слизистой оболочки (рис. 10-6 А). Эпителиальный слой представлен однослойным цилиндрическим каемчатым эпителием. В ворсинках и криптах он представлен разными видами клеток. Эпителий ворсинок составлен четырьмя типами клеток - главными клетками, бокаловидными клетками, эндокринными клетками и клетками Панета. Эпителий крипт - пять видов
(рис. 10-6 В, Г).
У каемчатых энтероцитов эпителия ворсинок мембрана формирует микроворсинки, покрытые гликокаликсом, а он адсорбирует ферменты, участвующие в пристеночном пищеварении. За счет микроворсинок поверхность всасывания увеличивается в 40 раз.
Бокаловидные энтероциты эпителия ворсинок - одноклеточные слизистые железы. Они вырабатывают углеводно-протеидные комплексы - муцины, выполняющие защитную функцию и способствующие продвижению компонентов пищи в кишечнике.
Рис. 10-6. Строение стенки тонкого кишечника.
А - строение двенадцатиперстной кишки. Б - строение большого сосочка двенадцатиперстной кишки:
Большой сосочек двенадцатиперстной кишки. 2. Ампула протока. 3. Сфинктеры протоков. 4. Панкреатический проток. 5. Общий желчный проток. В - строение различных отделов тонкой кишки: 6. Железы двенадцатиперстной кишки (Бруннеровы железы). 7. Серозная оболочка. 8. Наружный продольный и внутренний круговой слои мышечной оболочки. 9. Подслизистая основа. 10. Слизистая оболочка.
Собственная пластинка слизистой оболочки с гладкими мышечными клетками. 12. Групповые лимфоидные узелки (лимфоидные бляшки, Пейеровы бляшки). 13. Ворсинки. 14. Складки. Г - строение стенки тонкой кишки: 15. Ворсинки. 16. Круговая складка. Д - ворсинки и крипты слизистой оболочки тонкой кишки: 17. Слизистая оболочка. 18. Собственная пластинка слизистой оболочки с гладкими мышечными клетками. 19. Подслизистая основа. 20. Наружный продольный и внутренний круговой слои мышечной оболочки. 21. Серозная оболочка. 22. Ворсинки. 23. Центральный млечный синус. 24. Одиночный лимфоидный узелок. 25. Кишечная железа (Либеркюнова железа). 26. Лимфатический сосуд. 27. Подслизистое нервное сплетение. 28. Внутренний круговой слой мышечной оболочки. 29. Мышечное нервное сплетение. 30. Наружный продольный слой мышечной оболочки. 31. Артерия (красного цвета) и вена (синего цвета) подслизистого слоя

Функциональная морфология слизистой оболочки тонкого кишечника
Три отдела тонкой кишки имеют следующие различия: у двенадцатиперстной кишки имеются большие сосочки - дуоденальные железы, различна высота ворсинок, которая нарастает от двенадцатиперстной кишки к подвздошной, различна их ширина (более широкие - в двенадцатиперстной кишке), и количество (наибольшее количество в двенадцатиперстной кишке). Эти отличия показаны на рис. 10-7 Б. Далее, в подвздошной кишке находятся групповые лимфоидные фолликулы (пейеровы бляшки). Но они иногда могут обнаруживаться и в двенадцатиперстной кишке.
Ворсинки - пальцевидные выпячивания слизистой оболочки в просвет кишечника. Они содержат кровеносные и лимфатические капилляры. Ворсинки способны активно сокращаться за счет компонентов мышечной пластинки. Это способствует всасыванию химуса (насосная функция ворсинки).
Складки Керкринга (рис. 10-7 Г) образуются за счет выпячивания слизистой и подслизистой оболочек в просвет кишки.
Крипты - это углубления эпителия в собственную пластинку слизистой. Их часто расценивают как железы (железы Либеркюна) (рис. 10-7 В).
Тонкий кишечник является главным местом переваривания и реабсорбции. Большинство встречающихся в просвете кишечника ферментов синтезируется в поджелудочной железе. Сам тонкий кишечник выделяет около 3 л богатой муцинами жидкости.
Для слизистой кишечника характерно наличие кишечных ворсинок (Villi intestinalis), которые увеличивают поверхность слизистой оболочки в 7-14 раз. Эпителий ворсинок переходит в секреторные крипты Либеркюна. Крипты лежат у основания ворсинок и открываются в направлении просвета кишечника. Наконец, каждая эпителиальная клетка на апикальной мембране несет щеточную каемку (микроворсинки), кото-
рая увеличивает поверхность слизистой оболочки кишечника в 15-40 раз.
Митотическое деление происходит в глубине крипт; дочерние клетки мигрируют к вершине ворсинки. Все клетки, за исключением клеток Панета (обеспечивающих антибактериальную защиту), принимают участие в этой миграции. Весь эпителий полностью обновляется в течении 5-6 дней.
Эпителий тонкого кишечника покрыт слоем гелеобразной слизи, которая образуется бокаловидными клетками крипт и ворсинок. Когда открывается сфинктер привратника, выход химуса в двенадцатиперстную кишку запускает повышенную секрецию слизи железами Бруннера. Переход химуса в двенадцатиперстную кишку вызывает выделение в кровь гормоновсекретина и холецистокинина. Секретин запускает в эпителии протока поджелудочной железы секрецию щелочного сока, что необходимо также для защиты слизистой оболочки двенадцатиперстной кишки от агрессивного сока желудка.
Около 95% эпителия ворсинок заняты столбообразными главными клетками. Хотя их главной задачей является реабсорбция, они представляют собой важнейшие источники пищеварительных ферментов, которые локализованы либо в цитоплазме (амино- и дипептидазы) или в мембране щеточной каемки: лактаза, сахараза-изомальтаза, амино- и эндопептидазы. Эти ферменты щеточной каемки являются интегральными белками мембраны, причем часть их полипептидной цепочки вместе с каталитическим центром направлена в просвет кишечника, поэтому ферменты могут подвергать гидролизу вещества в полости пищеварительной трубки. Их секреция в просвет в данном случае оказывается не нужной (пристеночное пищеварение). Цитозольные ферменты эпителиальных клеток принимают участие в процессах переваривания, когда они расщепляют реабсорбированные клеткой белки (внутриклеточное пищеварение), или когда содержащие их клетки эпителия гибнут, отторгаются в просвет и там разрушаются, выделяя ферменты (полостное пищеварение).
Рис. 10-7. Гистология различных отделов тонкой кишки - двенадцатиперстной, тощей и подвздошной кишок.
А - ворсинки и крипты слизистой оболочки тонкой кишки: 1. Слизистая оболочка. 2. Собственная пластинка слизистой оболочки с гладкими мышечными клетками. 3. Подслизистая основа. 4. Наружный продольный и внутренний круговой слои мышечной оболочки. 5. Серозная оболочка. 6. Ворсинки. 7. Центральный млечный синус. 8. Одиночный лимфоидный узелок. 9. Кишечная железа (Либеркюнова железа). 10. Лимфатический сосуд. 11. Подслизистое нервное сплетение. 12. Внутренний круговой слой мышечной оболочки. 13. Мышечное нервное сплетение. 14. Наружный продольный слой мышечной оболочки.
15. Артерия (красного цвета) и вена (синего цвета) подслизистого слоя. Б, В - строение ворсинки:
Бокаловидная клетка (одноклеточная железа). 17. Клетки призматического эпителия. 18. Нервное волокно. 19. Центральный млечный синус. 20. Микрогемациркуляторное русло ворсинки, сеть кровеносных капилляров. 21. Собственная пластинка слизистой оболочки. 22. Лимфатический сосуд. 23. Венула. 24. Артериола

Тонкая кишка
Слизистая (или мукозная оболочка) состоит из трех слоев - эпителиального, собственной пластинки и мышечной пластинки слизистой оболочки (рис. 10-8). Эпителиальный слой представлен однослойным цилиндрическим каемчатым эпителием. Эпителий содержит пять основных популяций клеток: столбчатые эпителиоциты, бокаловидные экзокриноциты, клетки Панета, или экзокриноциты с ацидофильными гранулами, эндокриноциты или К-клетки (клетки Кульчицкого), а также M-клетки (с микроскладками), являющиеся модификацией столбчатых эпителиоцитов.
Эпителием покрыты ворсинки и соседствующие с ними крипты. Он большей частью состоит из реабсорбирующих клеток, которые на люминальной мембране несут щеточную каемку. Между ними разбросаны бокаловидные клетки, образующие слизь, а также клетки Панета и различные эндокринные клетки. Клетки эпителия образуются в результате деления эпителия крипт,
откуда они мигрируют 1-2 дня в направлении кончика ворсинки и там отторгаются.
В ворсинках и криптах он представлен разными видами клеток. Эпителий ворсинок составлен четырьмя типами клеток - главными клетками, бокаловидными клетками, эндокринными клетками и клетками Панета. Эпителий крипт - пять видов.
Основной вид клеток эпителия ворсинок - каемчатые энтероциты. У каемчатых энтероцитов
эпителия ворсинок мембрана формирует микроворсинки, покрытые гликокаликсом, а он адсорбирует ферменты, участвующие в пристеночном пищеварении. За счет микроворсинок поверхность всасывания увеличивается в 40 раз.
М-клетки (клетки с микроскладками) являются разновидностью энтероцитов.
Бокаловидные энтероциты эпителия ворсинок - одноклеточные слизистые железы. Они вырабатывают углеводно-протеидные комплексы - муцины, выполняющие защитную функцию и способствующие продвижению компонентов пищи в кишечнике.
Рис. 10-8. Морфогистологическое строение ворсинки и крипты тонкого кишечника

Толстая кишка
Толстая кишка состоит из слизистой, подслизистой, мышечной и серозной оболочек.
Слизистая оболочка формирует рельеф толстой кишки - складки и крипты. Ворсинки в толстой кишке отсутствуют. Эпителий слизистой оболочки однослойный цилиндрический каемчатый, и содержит те же клетки, что и эпителий крипт тонкой кишки - каемчатые, бокаловидные эндокринные, бескаемчатые, клетки Панета (рис. 10-9).
Подслизистая оболочка образована рыхлой волокнистой соединительной тканью.
Мышечная оболочка имеет два слоя. Внутренний циркулярный слой и наружный продольный слой. Продольный слой не сплошной, а образует
три продольные ленты. Они короче кишки и поэтому кишка собрана в «гармошку».
Серозная оболочка состоит из рыхлой волокнистой соединительной ткани и мезотелия и имеет выпячивания, содержащие жировую ткань.
Основные отличия стенки толстой кишки (рис. 10-9) от тонкой (рис. 10-8) - это: 1) отсутствие в рельефе слизистой оболочки ворсинок. Причем крипты имеют большую, чем в тонкой кишке, глубину; 2) наличие в эпителии большого числа бокаловидных клеток и лимфоцитов; 3) наличие большого числа одиночных лимфоидных узелков и отсутствие пейеровых бляшек в собственной пластинке; 4) продольный слой не сплошной, а формирует три ленты; 5) наличие выпячиваний; 6) наличие жировых привесок в серозной оболочке.
Рис. 10-9. Морфогистологическое строение толстого кишечника

Электрическая активность мышечных клеток желудка и кишечника
Гладкая мускулатура кишечника состоит из маленьких, веретенообразных клеток, формирующих пучки и образующих поперечные связи с соседними пучками. Внутри одного пучка клетки соединены друг с другом как механически, так и электрически. Благодаря таким электрическим контактам потенциалы действия распространяются (через межклеточные щелевые контакты: gap junctions) на весь пучок (а не лишь на отдельные мышечные клетки).
Для мышечных клеток антрального отдела желудка и кишечника обычно характерны ритмические колебания мембранного потенциала (медленные волны) амплитудой 10-20 мВ и частотой 3-15/мин (рис. 10-10). В момент возникновения медленных волн мышечные пучки частично сокращены, поэтому стенка этих отделов желудочно-кишечного тракта находится в тонусе; это происходит при отсутствии потенциалов действия. Когда мембранный потенциал достигает порогового значения и превышает его, происходит генерация потенциалов действия, следующих с небольшим интервалом друг за другом (последовательность спайков). Генерация потенциалов действия обусловлена Са2+-током (Са2+-каналов L-типа). Возрастание концентрации Са2+ в цитозоле запускает фазические сокращения, которые особенно выражены в дистальном отделе желудка. Если величина мембранного потенциала покоя приближается к величине порогового потенциала (однако не достигает его; мембранный потенциал покоя сдвигается в сторону деполяризации), то потенциал медленных колебаний начинает
регулярно превышать пороговое значение потенциала. В этом случае наблюдается периодичность в возникновении последовательностей спайков. Гладкая мускулатура сокращается каждый раз, когда генерируется последовательность спайков. Частота ритмических сокращений соответствует частоте медленных колебаний мембранного потенциала. Если же мембранный потенциал покоя клеток гладкой мускулатуры еще больше приближается к пороговому потенциалу, то возрастает длительность последовательностей спайков. Развивается спазм гладкой мускулатуры. Если же мембранный потенциал покоя сдвигается в сторону более отрицательных значений (в сторону гиперполяризации), то спайковая активность прекращается, а с ней прекращаются и ритмические сокращения. Если же мембрана гиперполяризуется еще больше, то снижается амплитуда медленных волн и мышечный тонус, что в конце концов ведет к параличу гладких мышц (атонии). За счет каких ионных токов возникают колебания мембранного потенциала пока не ясно; очевидно одно, что нервная система не оказывает влияния на колебания мембранного потенциала. Клетки каждого пучка мускулатуры обладают одной, лишь им свойственной частотой медленных волн. Поскольку соседние пучки соединены друг с другом посредством электрических межклеточных контактов, то пучок с более высокой частотой волн (водитель ритма) будет навязывать эту частоту соседнему пучку с более низкой частотой. Тоническое сокращение гладкой мускулатурынапример, проксимального отдела желудка, обусловлено открыванием Са2+-каналов другого типа, которые являются хемозависимыми, а не потенциалзависимыми.
Рис. 10-10. Мембранный потенциал клеток гладкой мускулатуры желудочно-кишечного тракта.
1. До тех пор, пока волнообразно колеблющийся мембранный потенциал клеток гладкой мускулатуры (частота колебаний: 10 мин-1) остается ниже величины порогового потенциала (40 мВ), потенциалы действия (спайки) отсутствуют. 2. При вызванной (например, растяжением или ацетилхолином) деполяризации последовательность спайков генерируется каждый раз, когда пик волны мембранного потенциала превышает величину порогового потенциала. За такими последовательностями спайков следуют ритмические сокращения гладкой мускулатуры. 3. Спайки генерируются непрерывно, если минимальные значения колебаний мембранного потенциала лежат выше порогового значения. Развивается длительное сокращение. 4. Потенциалы действия не генерируются при сильных сдвигах мембранного потенциала в сторону деполяризации. 5. Гиперполяризация мембранного потенциала вызывает затухание медленных колебаний потенциала, и гладкая мускулатура полностью расслабляется: атония

Рефлексы гастроэнтеральной нервной системы
Часть рефлексов желудочно-кишечного тракта является собственными гастроэнтеральными (локальными) рефлексами,при которых сенсорный чувствительный афферентный нейрон активирует клетку нервного сплетения, иннервирующую расположенные рядом с ней клетки гладких мышц. Воздействие на гладкомышечные клетки может быть возбуждающим или тормозным в зависимости от того, какой тип нейрона сплетения оказывается активированным (рис. 10-11 2, 3). Осуществление других рефлексов вовлекает моторные нейроны, расположенные проксимальнее или дистальнее места стимуляции. При перистальтическом рефлексе (например, в результате растяжения стенки пищеварительной трубки) возбуждается сенсорный нейрон
(рис. 10-11 1), который через тормозной интернейрон оказывает тормозное действие на продольную мускулатуру отделов пищеварительной трубки, лежащих проксимальнее, и растормаживающее действие на кольцевую мускулатуру (рис. 10-11 4). Одновременно дистальнее через возбуждающий интернейрон активируется продольная мускулатура (происходит укорачивание пищевой трубки), а кольцевая мускулатура расслабляется (рис. 10-11 5). При перистальтическом рефлексе запускается сложная серия моторных событий, вызванная растяжением мышечной стенки пищеварительной трубки (например, пищевода; рис. 10-11).
Передвижение пищевого комка смещает место активации рефлекса дистальнее, что вновь перемещает пищевой комок, результатом чего является практически непрерывный транспорт в дистальном направлении.
Рис. 10-11. Рефлекторные дуги рефлексов гастроэнтеральной нервной системы.
Возбуждение афферентного нейрона (светло-зеленый) за счет химического или, как показано на картинке (1), механического стимула (растяжение стенки пищевой трубки за счет пищевого комка) активирует в простейшем случае только один возбуждающий (2) или только один тормозный моторный либо секреторный нейрон (3). Рефлексы гастроэнтеральной нервной системы протекают все же обычно по более сложным схемам переключения. При перистальтическом рефлексе, например, нейрон, который возбуждается при растяжении (светло-зеленый), возбуждает в восходящем направлении (4) тормозный интернейрон (фиолетовый), который в свою очередь затормаживает возбуждающий мотонейрон (темнозеленый), иннервирующий продольную мускулатуру, и снимает торможение с тормозного мотонейрона (красный) кольцевой мускулатуры (сокращение). Одновременно в нисходящем направлении (5) активируется возбуждающий интернейрон (синий), который через возбуждающие или, соответственно, тормозящие мотонейроны в лежащей дистальнее части кишечника вызывает сокращение продольной мускулатуры и расслабление кольцевой мускулатуры

Парасимпатическая иннервация желудочно-кишечного тракта
Иннервация желудочно-кишечного тракта осуществляется с помощью вегетативной нервной системы (парасимпатическая(рис. 10-12) и симпатическая иннервация - эфферентные нервы), а также висцеральных афферентов (афферентная иннервация). Парасимпатические преганглионарные волокна, иннервирующие большую часть пищеварительного тракта, приходят в составе блуждающих нервов (N. vagus) из продолговатого мозга и в составе тазовых нервов (Nn. pelvici) из крестцового отдела спинного мозга. Парасимпатическая система посылает волокна к возбуждающим (холинергическим) и тормозным (пептидергическим) клеткам межмышечного нервного сплетения. Преганглионарные симпатические волокна начинаются от клеток, лежащих в боковых рогах грудинно-поясничного отдела спинного мозга. Их аксоны иннервируют кровеносные сосуды кишечника или подходят к клеткам нервных сплетений, оказывая тормозное действие на их возбуждающие нейроны. Висцеральные афференты, начинающиеся в стенке желудочно-кишечного тракта проходят в составе блуждающих нервов (N. vagus), в составе внутренностных нервов (Nn. splanchnici) и тазовых нервов (Nn. pelvici) к продолговатому мозгу, симпатическим ганглиям и к спинному мозгу. При участии симпатической и парасимпатической нервных систем протекает множество рефлексов желудочно-кишечного тракта, включая рефлекс расширения при наполнении и парез кишечника.
Хотя рефлекторные акты, осуществляемые нервными сплетениями желудочно-кишечного, тракта могут протекать независимо от влияния центральной нервной системы (ЦНС), однако они находятся под контролем ЦНС, что обеспечивает определенные преимущества: (1) расположенные далеко друг от друга части пищеварительного тракта могут быстро обмениваться информацией через ЦНС и тем самым координировать собственные функции, (2) функции пищеварительного тракта могут быть подчинены более важным интересам организма, (3) информация из желудочнокишечного тракта может быть интегрирована на разных уровнях головного мозга; что, например в случае болей в животе, может даже вызывать осознанные ощущения.
Иннервация желудочно-кишечного тракта обеспечивается вегетативными нервами: парасимпатическими и симпатическими волокнами и, кроме того, афферентными волокнами, так называемые висцеральные афференты.
Парасимаптические нервы желудочно-кишечного тракта выходят из двух независимых отделов ЦНС (рис. 10-12). Нервы, обслуживающие пищевод, желудок, тонкий кишечник и восходящую ободочную кишку (а также поджелудочную железу, желчный пузырь и печень), берут свое начало от нейронов продолговатого мозга (Medulla oblongata), аксоны которых образуют блуждающий нерв (N. vagus), тогда как иннервация остальных отделов желудочно-кишечного тракта начинается от нейронов крестцового отдела спинного мозга, аксоны которых образуют тазовые нервы (Nn. pelvici).
Рис. 10-12. Парасимпатическая иннервация желудочно-кишечного тракта

Влияние парасимпатической нервной системы на нейроны мышечного сплетения
Во всем пищеварительном тракте парасимпатические волокна активируют клетки-мишени через никотиновые холинергические рецепторы: один вид волокон образует синапсы на холинергических возбуждающих, а другой тип - напептидергических (NCNA) тормозных клетках нервных сплетений (рис. 10-13).
Аксоны преганглионарных волокон парасимпатической нервной системы переключаются в межмышечном нервном сплетении на возбуждающие холинергические или тормозные не-холинергические-не-адренергические (NCNA-ергические) нейроны. Постганглионарные адренергические нейроны симпатической системы действуют в большинстве случаев тормозяще на нейроны сплетения, которые стимулируют моторную и секреторную активность.
Рис. 10-13. Иннервация желудочно-кишечного тракта вегетативной нервной системой

Симпатическая иннервация желудочно-кишечного тракта
Преганглионарные холинергические нейроны симпатической нервной системы лежат в интермедиолатеральных столбахгрудного и поясничного отделов спинного мозга (рис. 10-14). Аксоны нейронов симпатической нервной системы выходят из грудного отдела спинного мозга через передние
корешки и проходят в составе внутренностных нервов (Nn. splanchnici) к верхнему шейному ганглию и к превертебральным ганглиям. Там происходит переключение на постганглионарные норадренергические нейроны, аксоны которых образуют синапсы на холинергических возбуждающих клетках межмышечного сплетения и через α-рецепторы оказывают тормозящеевоздействие на эти клетки (см. рис. 10-13).
Рис. 10-14. Симпатическая иннервация желудочно-кишечного тракта

Афферентная иннервация желудочно-кишечного тракта
В нервах, обеспечивающих иннервацию желудочно-кишечного тракта, в процентном отношении больше афферентных волокон чем эфферентных. Окончания сенсорных нервов являются неспециализированными рецепторами. Одна группа нервных окончаний локализуется в соединительной ткани слизистой оболочки рядом с ее мышечным слоем. Предполагается, что они выполняют функцию хеморецепторов, но пока не ясно, какие из реабсорбируемых в кишечнике веществ активируют эти рецепторы. Возможно, в их активации принимает участие пептидный гормон (паракринное действие). Другая группа нервных окончаний лежит внутри мышечного слоя и обладает свойствами механорецепторов. Они реагируют на механические изменения, которые связаны с сокращением и растяжением стенки пищеварительной трубки. Афферентные нервные волокна идут от желудочно-кишечного тракта либо в составе нервов симпатической или парасимпатической нервной системы. Некоторые афферентные волокна, идущие в составе симпатических
нервов, образуют в превертебральных ганглиях синапсы. Большая же часть афферентов проходит через пре- и паравертебральные ганглии без переключения (рис. 10-15). Нейроны афферентных волокон лежат в чувствительных
спинальных ганглиях задних корешков спинного мозга, и их волокна входят в спинной мозг через задние корешки. Афферентные волокна, которые проходят в составе блуждающего нерва, образуют афферентное звено рефлексов желудочно-кишечного тракта, протекающих при участии блуждающего парасимпатического нерва. Данные рефлексы особенно важных для координации моторной функции пищевода и проксимального отдела желудка. Чувствительные нейроны, аксоны которых идут в составе блуждающего нерва, локализованы в Ganglion nodosum. Они образуют связи с нейронами ядра одиночного пути (Tractus solitarius). Передаваемая ими информация достигает преганглионарных парасимпатических клеток, локализованных в дорзальном ядре блуждающего нерва (Nucleus dorsalis n. vagi). Афферентные волокна, которые в том числе проходят в составе тазовых нервов (Nn. pelvici), принимают участие в рефлексе дефекации.
Рис. 10-15. Короткие и длинные висцеральные афференты.
Длинные афферентные волокна (зеленые), тела клеток которых лежат в задних корешках спинального ганглия, проходят сквозь пре- и паравертебральные ганглии без переключения и попадают в спинной мозг, где они либо переключаются на нейроны восходящих или нисходящих путей, либо в том же сегменте спинного мозга переключаются на преганглионарные вегетативные нейроны, как в латеральном промежуточном сером веществе(Substantia intermediolateralis) грудного отдела спинного мозга. У коротких афферентов рефлекторная дуга замыкается за счет того, что переключение на эфферентные симпатические нейроны осуществляется уже в симпатических ганглиях

Основные механизмы трансэпителиальной секреции
Встроенные в люминальную и базолатеральную мембрану белки-переносчики, а также состав липидов этих мембран, определяют полярность эпителия. Пожалуй, важнейшим фактором, определяющим полярность эпителия, является наличие в базолатеральной мембране клеток секретирующего эпителия Na+/K+-ATФазы (Na+/К+-«насос»), чувствительной к оубаину. Na+/К+-АТФаза превращает химическую энергию АТФ в электрохимические градиенты Na+ и К+, направленные в клетку или из клетки соответственно (первичный активный транспорт). Энергия этих градиентов может быть вторично использована для того, чтобы транспортировать другие молекулы и ионы активно через клеточную мембрану против их электрохимического градиента (вторичный активный транспорт). Для этого необходимы специализированные транспортные белки, так называемые переносчики, которые либо обеспечивают одновременный перенос Na+ в клетку вместе с другими молекулами или ионами (котранспорт), либо осуществляют обмен Na+ на
другие молекулы или ионы (антипорт). Секреция ионов в просвет пищеварительной трубки порождает осмотические градиенты, поэтому вода следует за ионами.
Активная секреция калия
В клетках эпителия К+ активно накапливается с помощью расположенного в базолатеральной мембране Na+-К+-насоса, а Na+ выкачивается из клетки (рис. 10-16). В эпителии, в котором не происходит секреции К+, К+-каналы находятся там же, где расположен насос (вторичное использование К+ на базолатеральной мембране, см. рис. 10-17 и рис. 10-19). Простой механизм секреции К+ может быть обеспечен встраиванием многочисленных К+-каналов в люминальную мембрану (вместо базолатеральной), т.е. в мембрану эпителиальной клетки со стороны просвета пищеварительной трубки. В таком случае накопленный в клетке К+ выходит в просвет пищеварительной трубки (пассивно; рис. 10-16), а анионы следуют за К+, в результате чего возникает осмотический градиент, поэтому вода выделяется в просвет пищеварительной трубки.
Рис. 10-16. Трансэпителиальная секреция KCl.
Na+/К+-АТФаза, локализованная в базолатеральной клеточной мембране, при использовании 1 моль АТФ «выкачивает» из клетки 3 моля ионов Na+ и «закачивает» в клетку 2 моля К+. В то время как Na+ входит в клетку через Na+-каналы, расположенные в базолатеральной мембране, К+-ионы покидают клетку через К+-каналы, локализованные в люминальной мембране. В результате перемещения К+ через эпителий устанавливается положительный в просвете пищеварительной трубки трансэпителиальный потенциал, в результате чего ионы Cl-межклеточно (через плотные контакты между эпителиальными клетками) тоже устремляются в просвет пищеварительной трубки. Как показывают стехиометрические значения на рисунке, на 1 моль АТФ выделяется 2 моля К+

Трансэпителиальная секреция NaHCO3
Большинство секретирующих эпителиальных клеток сначала секретируют анион (например, HCO3-). Движущей силой этого транспорта является электрохимический градиент Na+, направленный из экстраклеточного пространства в клетку, который устанавливается благодаря механизму первичного активного транспорта осуществляемого Na+-К+-насосом. Потенциальная энергия градиента Na+ используется белками-переносчиками, причем Na+ переносится через клеточную мембрану в клетку вместе с другим ионом или молекулой (котранспорт) или обмениваться на другой ион или молекулу (антипорт).
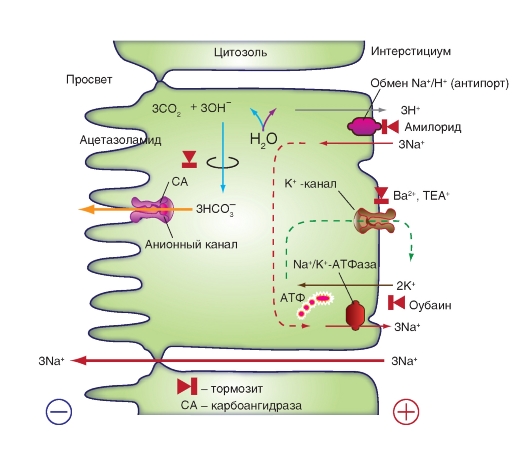
Для секреции HCO3- (например, в протоках поджелудочной железы, в железах Бруннера или в желчных протоках) необходим Na+/Н+-обменник в базолатеральной клеточной мембране (рис. 10-17). Ионы Н+ с помощью вторичного активного транспорта выводятся из клетки, в результате в ней остаются ионы ОН-, которые взаимодействуют с СО2 с образованием НСО3-. В роли катализатора в этом процессе выступает карбоангидраза. Образовавшийся НСО3- выходит из клетки в направлении просвета желудочнокишечного тракта либо через канал (рис. 10-17), либо с помощью белка-переносчика, осуществляющего обмен С1-/ НСО3-. По всей вероятности, в протоке поджелудочной железы активны оба механизма.
Рис. 10-17. Трансэпителиальная секреция NaHCO3 становится возможной тогда, когда H+-ионы активно выводятся из клетки через базолатеральную мембрану. За это отвечает белок-переносчик, который по механизму вторичного активного транспорта обеспечивает перенос ионов H+. Движущая сила этого процесса - химический градиент Na+, поддерживаемый Na+/K+-ATФазой. (В отличие от рис. 10-16, через базолатеральную мембрану из клетки через K+-каналы выходят ионы K+, поступающие в клетку в результате работы Na+/K+-ATФазы). На каждый ион H+, покидающий клетку, остается один ион OH-, который связывается с CO2, образуя HCO3-. Эта реакция катализируется карбоангидразой. HCO3- диффундирует через анионные каналы в просвет протока, что приводит к возникновению трансэпителиального потенциала, при котором содержимое просвета протока заряжено отрицательно по отношению к интерстициуму. Под действием такого трансэпителиального потенциала ионы Na+ через плотные контакты между клетками устремляются в просвет протока. Количественный баланс показывает, что на секрецию 3 моль NaHCO3 затрачивается 1 моль ATФ
Трансэпителиальная секреция NaCl
Большинство секретирующих эпителиальных клеток сначала секретируют анион (например, Cl-). Движущей силой этого транспорта является электрохимический градиент Na+, направленный из экстраклеточного пространства в клетку, который устанавливается благодаря механизму первичного активного транспорта осуществляемого Na+-К+-насосом. Потенциальная энергия градиента Na+ используется белками-переносчиками, причем Na+ переносится через клеточную мембрану в клетку вместе с другим ионом или молекулой (котранспорт) или обменивается на другой ион или молекулу (антипорт).
Похожий механизм отвечает за первичную секрецию Cl-, которая обеспечивает движущими силами процесс секреции жидкости в концевых
отделах слюнных желез рта, в ацинусах поджелудочной железы, а также в слезных железах. Вместо обменника Na+/H+ вбазолатеральной мембране эпителиальных клеток этих органов локализован переносчик, обеспечивающий сопряженный перенос Na+-К+-2Сl- (котранспорт; рис. 10-18). Этот переносчик использует градиент Na+ для (вторичного активного) накопления Cl- в клетке. Из клетки Cl- может пассивно выходить через ионные каналы люминальной мембраны в просвет протока железы. При этом возникает отрицательный в просвете протока трансэпителиальный потенциал, и Na+устремляется в просвет протока: в данном случае через плотные контакты между клетками (межклеточный транспорт). Высокая концентрация NaCl в просвете протока стимулирует ток воды по осмотическому градиенту.
Рис. 10-18. Вариант трансэпителиальной секреции NaCl, который требует активного накопления Cl- в клетке. В желудочно-кишечном тракте за это отвечают по крайней мере два механизма (см. также рис. 10-19), для одного из которых необходим локализованный в базолатеральной мембране переносчик, обеспечивающий одновременный перенос Na+-2Cl--K+ через мембрану (котранспорт). Он работает под действием химического градиента Na+, который, в свою очередь, поддерживается Na+/K+-ATФазой. Ионы K+ попадают в клетку как с помощью механизма котранспорта, так и посредством Na+/K+-ATФазы и выходят из клетки через базолатеральную мембрану, а Cl-покидает клетку через каналы, локализованные в люминальной мембране. Вероятность их открывания повышается благодаря цAMФ (тонкий кишечник) или цитозольному Ca2+ (концевые отделы желез, ацинусы). Возникает трансэпителиальный потенциал отрицательный в просвете протока, обеспечивающий межклеточную секрецию Na+. Количественный баланс показывает, что на 1 моль ATФ выделяется 6 моль NaCl
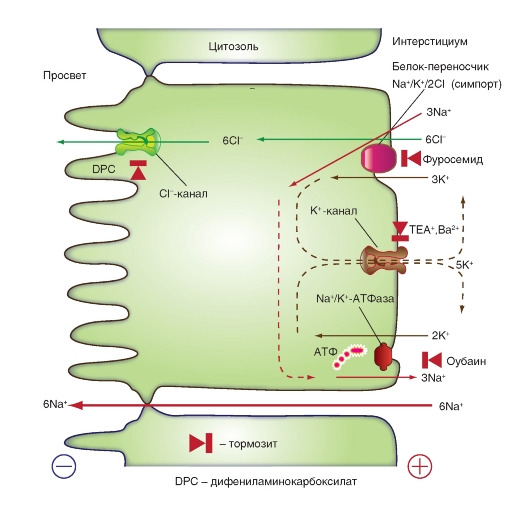
Трансэпителиальная секреция NaCl (вариант 2)
Этот, иной механизм секреции наблюдается в клетках ацинуса поджелудочной железы, которые
обладают двумя переносчиками, локализованными в базолатеральной мембране и обеспечивающими ионные обмены Na+/Н+ и С1-/НСО3- (антипорт; рис. 10-19).
Рис. 10-19. Вариант трансэпителиальной секреции NaCl (см. такжe рис. 10-18) который начинается с того, что с помощью базолатерального Na+/Н+-обменника (как на рис. 10-17) ионы HCO3- накапливаются в клетке. Однако позднее этот HCO3- (в отличие от рис. 10-17) покидает клетку с помощью переносчика Cl--HCO3- (антипорт), расположенного на базолатеральной мембране. Как следствие Cl- в результате («третичного») активного транспорта попадает в клетку. Через Cl--каналы, расположенные в люминальной мембране, Cl- выходит из клетки в просвет протока. В результате в просвете протока устанавливается трансэпителиальный потенциал, при котором содержимое просвета протока несет отрицательный заряд. Na+ под влиянием трансэпителиального потенциала устремляется в просвет протока. Энергетический баланс: здесь на 1 моль использованной ATФ выделяется 3 моль NaCl, т.е. в 2 раза меньше, чем в случае механизма, описанного на рис. 10-18 (DPC = дифениламинкарбоксилат; SITS = 4-ацетамино-4'-изотиоциан-2,2'-дисульфонстилбен)

Синтез секретируемых белков в желудочно-кишечном тракте
Определенные клетки синтезируют белки не только для собственных нужд, но и для секреции. Матричная РНК (mRNA) для синтеза экспортных белков несет не только информацию об аминокислотной последовательности белка, но и о включенной вначале сигнальной последовательности аминокислот. Сигнальная последовательность обеспечивает попадание синтезируемого на рибосоме белка в полости шероховатого эндоплазматического ретикулума (RER). После отщепления сигнальной последовательности аминокислот, белок попадает в комплекс Гольджи и, наконец - в конденсирующие вакуоли и зрелые запасающие гранулы. При необходимости он выбрасывается из клетки в результате экзоцитоза.
Первый этап любого синтеза белка - поступление аминокислот в базолатеральную часть клетки. С помощью аминоацил-tRNA-синтетазы аминокислоты прикрепляются к соответствующей транспортной РНК (tRNA), которая доставляет их к месту синтеза белка. Синтез белка осущест-
вляется на рибосомах, которые «считывают» с матричной РНК информацию о последовательности аминокислот в белке(трансляция). mRNA для белка, предназначенного на экспорт (или для встраивания в клеточную мембрану), несет не только информацию о последовательности аминокислот пептидной цепочки, но и подключенную вначале mRNA информацию осигнальной последовательности аминокислот (сигнальный пептид). Длина сигнального пептида составляет около 20 аминокислотных остатков. После того как сигнальный пептид будет готов, он тотчас же связывается с цитозольной молекулой, распознающей сигнальные последовательности - SRP (signal recognition particle). SRP блокирует синтез белка до тех пор, пока весь рибосомальный комплекс не закрепится на SRP-рецепторе (причальный белок) шероховатого цитоплазматического ретикулума (RER). После этого синтез начинается снова, при этом белок выделяется не в цитозоль и через пору попадает в полости RER (рис. 10-20). После окончания трансляции сигнальный пептид отщепляется пептидазой, расположенной в мембране RER, и новая белковая цепочка готова.
Рис. 10-20. Синтез белка, предназначенного на экспорт, в выделяющей белки клетке.
1. Рибосома связывается с цепочкой mRNA, и конец синтезируемой пептидной цепочки начинает выходить из рибосомы. Сигнальная последовательность аминокислот (сигнальный пептид) белка, предназначенного на экспорт, связывается с молекулой, распознающей сигнальные последовательности (SRP, signal recognition particle). SRP блокирует в рибосоме позицию (участок А), к которой во время синтеза белка подходит tRNA с прикрепленной аминокислотой. 2. В результате трансляция приостанавливается, и (3) SRP вместе с рибосомой связывается с SRP-рецептором, расположенным на мембране шероховатого эндоплазматического ретикулума (RER), так что конец пептидной цепочки оказывается в (гипотетической) поре мембраны RER. 4. SRP отщепляется 5. Трансляция может продолжаться, и пептидная цепочка растет в полости RER: транслокация

Секреция белков в желудочнокишечном тракте
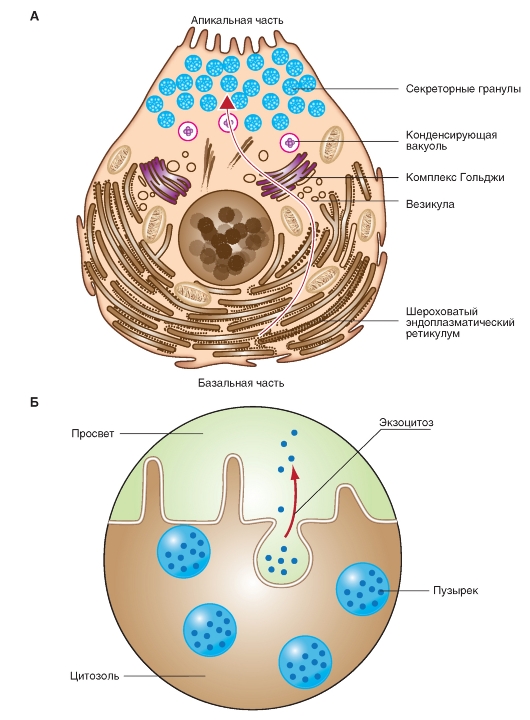
концентрируется. Такие вакуоли превращаются в зрелые секреторные гранулы, которые собираются в люминальной (апикальной) части клетки (рис. 10-21 А). Из этих гранул белок высвобождается в экстраклеточное пространство (например, в просвет ацинуса) за счет того, что мембрана гранулы сливается с клеточной мембраной и при этом разрывается:экзоцитоз (рис. 10-21 Б). Экзоцитоз является постоянно текущим процессом, однако влияние нервной системы или гуморальная стимуляция могут значительно его ускорить.
Рис. 10-21. Секреция белка, предназначенного на экспорт, в выделяющей белки клетке.
А - типичная экзокринная секретирующая белок клетка содержит в базальной части клетки плотно упакованные слои шероховатого эндоплазматического ретикулума (RER), на рибосомах которого синтезируются экспортируемые белки (см. рис. 10-20). На гладких концах RER отделяются везикулы, содержащие белки, которые попадают к cis -области аппарата Гольджи (посттрансляционная модификация), от trans-областей которого отделяются конденсирующие вакуоли. Наконец, с апикальной стороны клетки лежат многочисленные зрелые секреторные гранулы, которые готовы к экзоцитозу (панель Б). Б - на рисунке продемонстрирован экзоцитоз. Три нижних, окруженных мембраной везикулы (секреторная гранула; панель А) пока еще лежат свободно в цитозоле, тогда как везикула слева вверху прилегает к внутренней стороне плазматической мембраны. Мембрана везикулы справа вверху уже слилась с плазматической мембраной, и содержимое везикулы изливается в просвет протока
Синтезированный в полости RER белок упаковывается в небольшие везикулы, которые отделяются от RER. Везикулы, содержащие белок, подходят к комплексу Гольджи и сливаются с его мембраной. В комплексе Гольджи пептид модифицируется (посттрансляционная модификация), например гликолизируется и покидает затем комплекс Гольджи внутри конденсирующих вакуолей. В них белок снова модифицируется и
Регуляция процесса секреции в желудочно-кишечном тракте
Экзокринные железы пищеварительного тракта, лежащие вне стенок пищевода, желудка и кишечника, иннервируются эфферентами как симпатической, так и парасимпатической нервной системы. Железы в стенке пищеварительной трубки иннервируются нервами подслизистого сплетения. Эпителий слизистой оболочки и встроенные в него железы содержат эндокринные клетки, которые высвобождают гастрин, холецистокинин, секретин, GIP (glucose-dependent insuli-releasing peptide) и гистамин. После выброса в кровь эти вещества регулируют и координируют моторику, секрецию и переваривание в желудочно-кишечном тракте.
Многие, возможно даже все, секреторные клетки в состоянии покоя секретируют в небольших количествах жидкости, соли и белки. В отличие от реабсорбирующего эпителия, в котором транспорт веществ зависит от градиента Na+, обеспечиваемого активностью Na+/К+-АТФазой базолатеральной мембраны, уровень секреции может быть значительно увеличен в случае необходимости. Стимуляция секреции может осуществляться как нервной системой, так и гуморально.
Во всем желудочно-кишечном тракте между эпителиальными клетками разбросаны клетки, синтезирующие гормоны. Они высвобождают целый ряд сигнальных веществ: некоторые из которых по кровеносному руслу транспортируются к своим клеткам-мишеням (эндокринное действие), другие же - парагормоны - действуют на соседние с ними клетки (паракринное действие). Гормоны влияют не только на клетки, принимающие участие в процессе секреции различных веществ, но и на гладкую мускулатуру желудочно-кишечного тракта (стимулируют ее активность или тормозят). Кроме того, гормоны могут оказывать на клетки желудочно-кишечного тракта трофическое или антитрофическое действие.
Эндокринные клетки желудочно-кишечного тракта имеют форму бутылки, при этом узкая часть снабжена микроворсинками и направлена в сторону просвета кишечника (рис. 10-22 А). В отличие от эпителиальных клеток, обеспечивающих транспорт веществ, у базолатеральной мембраны эндокринных клеток можно обнаружить гранулы с белками, которые принимают участие в процессах транспорта в клетку и декарбоксилирования веществ-предшественников аминов. Эндокринные клетки синтезируют в том числе биологически активный 5-гидрокситримптамин. Такие
эндокринные клетки называются APUD (amine precursor uptake and decarboxylation) клетками, поскольку все они содержат переносчики, необходимые для захвата триптофана (и гистидина), и ферменты, обеспечивающие декарбоксилирование триптофана (и гистидина) до триптамина (и гистамина). В общей сложности имеется по крайней мере 20 сигнальных веществ, образующихся в эндокринных клетках желудка и тонкого кишечника.
Гастрин, взятый в качестве примера, синтезируется и высвобождается С(astrin)-клетками. Две трети G-клеток находится в эпителии, выстилающем антральный отдел желудка, и одна треть - в мукозном слое двенадцатиперстной кишки. Гастрин существует в двух активных формах G34 и G17 (цифры в названии означают количество аминокислотных остатков, составляющих молекулу). Обе формы отличаются друг от друга местом синтеза в пищеварительном тракте и биологическим временем полураспада. Биологическая активность обеих форм гастрина обусловлена C-концом пептида, -Try-Met-Asp-Phe(NH2). Эта последовательность аминокислотных остатков содержится также в синтетическом пентагастрине, BOC-β-Ala-TryMet-Asp-Phe(NH2), который вводится в организм для диагностики секреторной функции желудка.
Стимулом для высвобождения гастрина в кровь является прежде всего присутствие продуктов расщепления белков в желудке или в просвете двенадцатиперстной кишки. Эфферентные волокна блуждающего нерва также стимулируют высвобождение гастрина. Волокна парасимпатической нервной системы активируют G-клетки не напрямую, а через промежуточные нейроны, которые высвобождают GPR (Gastrin-Releasing Peptide). Высвобождение гастрина в антральном отделе желудка затормаживается, когда значение pH желудочного сока снижается до уровня меньше 3; таким образом возникает отрицательная петля обратной связи, с помощью которой прекращается слишком сильная или слишком длительная секреция желудочного сока. С одной стороны, низкий уровень pH прямо тормозит G-клетки антрального отдела желудка, а с другой стороны, стимулирует расположенные по соседству D-клетки, которые высвобождают соматостатин(SIH). Впоследствии соматостатин оказывает тормозное действие на G-клетки (паракринное действие). Еще одна возможность для торможения секреции гастрина заключается в том, что волокна блуждающего нерва могут стимулировать секрецию соматостатина из D-клеток посредством CGRP (calcitonin gene-related peptide)- эргических интернейронов (рис. 10-22 Б).
Рис. 10-22. Регуляция секреции.
А - эндокринная клетка желудочно-кишечного тракта. Б - регуляция секреции гастрина в антральном отделе желудка

Реабсорбция натрия в тонком кишечнике
Главными отделами, где происходят процессы реабсорбции (или в русской терминологии всасывания) в желудочно-кишечном тракте, являются тощая кишка, подвздошная кишка и верхний отдел толстой кишки. Специфика тощей кишки и подвздошной кишки заключается в том, что поверхность их люминальной мембраны увеличена более чем в 100 раз за счет кишечных ворсинок и высокой щеточной каемки
Механизмы, с помощью которых реабсорбируются соли, вода и питательные вещества, похожи на почечные. Транспорт веществ через клетки эпителия желудочно-кишечного тракта зависит от активности Na+/К+-АТФазы или Н+/К+-АТФазы. Различное встраивание переносчиков и ионных каналов в люминальную и/или базолатеральную клеточную мембрану определяет, какое вещество будет реабсорбироваться из просвета пищеварительной трубки или секретироваться в нее.
Для тонкого и толстого кишечника известно несколько механизмов всасывания.
Для тонкой кишки преимущественны механизмы всасывания, представленные на рис. 10-23 А и
рис. 10-23 В.
Механизм 1 (рис. 10-23 А) локализован прежде всего в тощей кишке. Na+-ионы пересекают здесь щеточную каемку с помощью различных белков-переносчиков, которые используют энергию (электрохимического) градиента Na+, направленного в клетку, для реабсорбции глюкозы, галактозы, аминокислот, фосфата, витаминов и других веществ, поэтому эти вещества попадают в клетку в результате (вторичного) активного транспорта (котранспорт).
Механизм 2 (рис. 10-23 Б) присущ тощей кишке и желчному пузырю. Он основан на одновременной локализации двухпереносчиков в люминальной мембране, обеспечивающих обмены ионов Na+/H+ и Cl-/HCO3- (антипорт), что позволяет реабсорбировать NaCl.
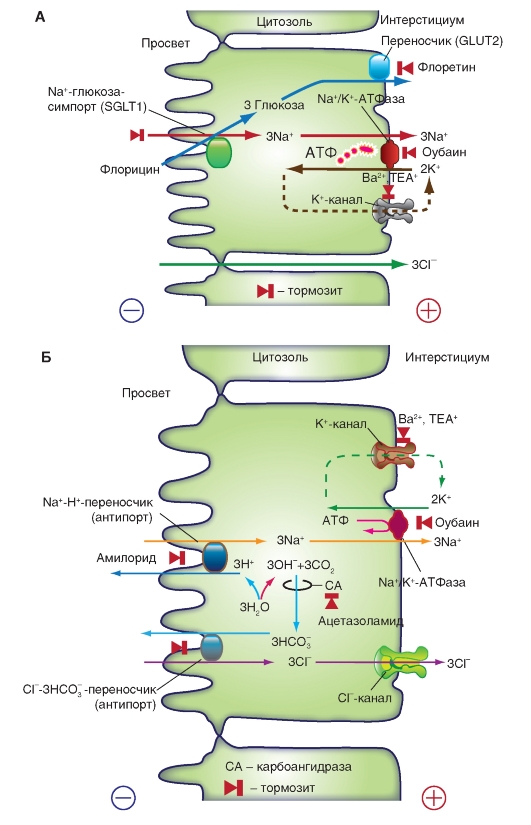
Рис. 10-23. Реабсорбция (всасывание) Na+ в тонком кишечнике.
А - сопряженная реабсорбция Na+, Cl- и глюкозы в тонком кишечнике (прежде всего в тощей кишке). Направленный в клетку электрохимический градиент Na+, который поддерживается Na+/K+-АТФазой, служит движущей силой для люминального переносчика (SGLT1), с помощью которого по механизму вторичного активного транспорта Na+ и глюкоза поступают в клетку (котранспорт). Поскольку Na+ имеет заряд, а глюкоза нейтральна, то люминальная мембрана деполяризуется (электрогенный транспорт). Содержимое пищеварительной трубки приобретает отрицательный заряд, который способствует реабсорбции Cl- через плотные межклеточные контакты. Глюкоза покидает клетку через базолатеральную мембрану по механизму облегченной диффузии (переносчик глюкозы GLUT2). В результате на один затраченный моль АТФ реабсорбируется 3 моля NaCl и 3 моля глюкозы. Механизмы реабсорбции нейтральных аминокислот и целого ряда органических веществ похожи на описанный для глюкозы. Б- реабсорбция NaCl за счет параллельной активности двух переносчиков люминальной мембраны (тощая кишка, желчный пузырь). Если в мебрану клетки рядом встроены переносчик, осуществляющий обмен Na+/Н+(антипорт), и переносчик, обеспечивающий обмен Cl-/HCO3- (антипорт), то в результате их работы ионы Na+ и Cl- будут накапливаться в клетке. В отличие от секреции NaCl, когда оба переносчика расположены на базолатеральной мембране, в данном случае оба переносчика локализованы в люминальной мембране (реабсорбция NaCl). Химический градиент Na+ является движущей силой секреции Н+. Ионы Н+ выходят в просвет пищеварительной трубки, а в клетке остаются ионы ОН-, которые реагируют с CO2 (катализатором реакции является карбоангидраза). В клетке накапливаются анионы HCO3-, химический градиент которых обеспечивает движущей силой переносчик, транспортирующий Cl- в клетку. Cl- покидает клетку через базолатеральные Cl--каналы. (в просвет пищеварительной трубки Н+ и HCO3- реагируют друг с другом с образованием Н2О и CO2). В данном случае реабсорбируется 3 моль NaCl на 1 моль АТФ
Реабсорбция натрия в толстом кишечнике
Механизмы, с помощью которых происходит всасывание в толстом кишечнике, несколько отличается от механизмов, имеющих место в тонком кишечнике. Здесь также можно рассмотреть два механизма, преобладающих в этом отделе, что проиллюстировано на рис. 10-23 как механизм 1 (рис. 10-24 А) и механизм 2 (рис. 10-24 Б).
Механизм 1 (рис. 10-24 А) преобладает в проксимальном отделе толстого кишечника. Суть его заключается в том, что Na+ попадает в клетку через люминальные Na+-каналы.
Механизм 2 (рис. 10-24 Б) представлен в толстом кишечнике благодаря К+/Н+-АТФазе, расположенной на люминальной мембране, первичноактивно реабсорбируются ионы К+.
Рис. 10-24. Реабсорбция (всасывание) Na+ в толстом кишечнике.
А - реабсорбция Na+ через люминальные Na+-каналы (прежде всего в проксимальном отделе толстого кишечника). По направленному в клетку градиенту ионы Na+ могут реабсорбироваться, участвуя в механизмах вторичного активного транспорта с помощью переносчиков (котранспорт или антипорт), и входить в клетку пассивно через Na+-каналы (ENaC = Epithelial Na+ Channel), локализованными в люминальной клеточной мембране. Так же, как и на рис. 10-23 А, этот механизм поступления Na+ в клетку является электрогенным, поэтому и в данном случае содержимое просвета пищевой трубки заряжается отрицательно, что способствует реабсорбции Cl- через межклеточные плотные контакты. Энергетический баланс составляет, как и на рис. 10-23 А, 3 моля NaCl на 1 моль АТФ. Б - работа Н+/К+-АТФазы способствует секреции ионов Н+ и реабсорбции ионов K+ по механизму первичного активного транспорта (желудок, толстый кишечник). За счет этого «насоса» мембраны обкладочных клеток желудка, требующего энергии АТФ, Н+-ионы накапливаются в просвете пищеварительной трубки в очень высоких концентрациях (этот процесс тормозится омепразолом). Н+/К+-АТФазы в толстом кишечнике способствует реабсорбции KHCO3 (затормаживается оубаином). На каждый секретируемый ион Н+ в клетке остается ион OH-, который реагирует с CO2 (катализатором реакции является карбоангидраза) с образованием HCO3-. HCO3- выходит из обкладочной клетки через базолатеральную мембрану с помощью переносчика, обеспечивающего обмен Cl-/HCO3-(антипорт; здесь не показан), выход HCO3- из клетки эпителия толстого кишечника осуществляется через HCO^-канал. На 1 моль реабсорбируемого KHCO3 затрачивается 1 моль АТФ, т.е. речь идет о достаточно «дорогом» процессе. В данном случае Na+/К+-АТФаза не играет значительной роли в данном механизме, поэтому нельзя выявить стехиометрической зависимости между количеством затраченной АТФ и количествами перенесенных веществ

Экзокринная функция поджелудочной железы
Поджелудочная железа обладает экзокринным аппаратом (наряду с эндокринной частью), который состоит из гроздеобразных концевых участков - ацинусов (долек). Они расположены на концах разветвленной системы протоков, эпителий которых выглядит сравнительно однотипно (рис. 10-25). По сравнению с другими экзокринными железами в поджелудочной железе особенно заметно полное отсутствие миоэпителиальных клеток. Последние в других железах поддерживают концевые участки во время секреции, когда давление в выводящих протоках возрастает. Отсутствие миоэпителиальных клеток в поджелудочной железе означает, что ацинарные клетки во время секреции легко лопаются, поэтому определенные ферменты, предназначенные на экспорт в кишечник, попадают в интерстициум поджелудочной железы.
Дата добавления: 2019-09-13; просмотров: 394; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
