Восстановление N 2 в апротонных и протонных средах
В 1964 году М.Е. Вольпин и В.Б. Шур опубликовали первое сообщение о возможности восстановления N2 в апротонных средах (эфиры, углеводороды) в мягких условиях в присутствии комплексов переходных металлов [4] (реакция Вольпина-Шура). Использовали системы, аналогичные катализаторам полимеризации олефинов, открытым К. Циглером и Дж. Натта [5]: MLn - восстановитель. Среди переходных металлов активностью в реакции с N2 обладают соединения Mo(III), Cr(III), Ti(IV), Fe(III), W(VI), Mn(II), Co(II), Zr(IV) и Nb(IV). В качестве восстановителей использовали RMgBr, AlR3 , RLi, LiAlH4 , Mg, Na, K и Al. Реакции протекают стехиометрически по переходному металлу при комнатной температуре и давлении азота от 0,1 до 15 МПа. Например, система Cp2TiCl2-EtMgBr (Cp = C5H5) восстанавливает азот при комнатной температуре и атмосферном давлении с образованием 0,7 молей NH3 на 1 г-атом Ti. Первичным продуктом реакции является нитридный комплекс титана (Ti-N<), гидролиз которого дает аммиак. В системе TiCl3-Mg в тетрагидрофуране (ТГФ) при 0,1 МПа за 2-3 ч получается 1 моль NH3 на 1 г-атом Ti. Было установлено, что в зависимости от природы металла, восстановителя и условий процесс может не доходить до нитрида и останавливаться на интермедиате, гидролиз которого дает гидразин. Таким образом, общая схема восстановления может быть представлена следующей последовательностью реакций:
Если связь Ti-N в нитридном интермедиате разорвать с помощью апротонной кислоты, процесс может стать каталитическим по переходному металлу. Наиболее простая каталитическая система TiCl4-AlBr3-Al при 10 МПа и 130?C производит 286 молей NH3 на моль TiCl4 (после гидролиза образующихся нитридов алюминия). Реакцию можно проводить в бензоле или расплаве AlBr3 . Суммарный процесс восстановления N2 описывается уравнением (8) и катализируется Ti(II), полученным восстановлением TiCl4 :
|
|
|
N2 + 2Al + 4AlBr3=2[N(AlBr2)3] [5]
Следующая важная страница в химии молекулярного азота была открыта А.Е. Шиловым и его сотрудниками в 1970 году. Были обнаружены реакции восстановления азота до гидразина и аммиака в водных или водно-спиртовых средах (в протонных средах). Катализаторами реакций восстановления в этих гетерогенных системах служат Mo(III) и V(II), а восстановителями - Ti(III), Cr(II) и V(II). Система V(OH)2-Mg(OH)2 стехиометрически при pH > 10 (25?C и = 0,1 МПа) восстанавливает азот по реакции
4V(OH)2 + 4H2O + N2=4V(OH)3 + NH2NH2
Изучена и гомогенная система V(OH)2 - пирокатехин (pH = 10). Интересно, что сам гидроксид Mo(OH)3 не восстанавливает N2 без участия Ti(OH)3 или Cr(OH)2, которые без Mo(III) также неспособны восстанавливать N2 . Установлено, что в присутствии амальгамы натрия в системе Mo(III)-Ti(OH)3 параллельно образуются NH3 и гидразин [1,2,3].
Механизм восстановления N 2
|
|
|
Не вызывает сомнений образование первичных комплексов N2 с соединениями переходных металлов, участвующих в его активации в апротонных и протонных средах. В 1965 году Аллен и Зеноф действием гидразина на RuCl3 получили первый диазотный комплекс [Ru(NH3)5N2]Cl2 . В 1966 году А.Е. Шилов, А.К. Шилова и Ю.Г. Бородько впервые показали, что такие комплексы могут образоваться непосредственно из N2 [3]. Устойчивые комплексы с N2 получены в настоящее время с соединениями Ti, Zr, Nb, Cr, Mo, W, Mn, Tc, Re, Fe, Ru, Os, Co, Rh, Ir, Ni. В большинстве случаев комплексы азота являются s-комплексами:
Частота валентных колебаний N-N понижена в комплексах на 140-240 см- 1, длина связи N-N увеличена, но незначительно. Известен комплекс Ni(0), в котором молекула азота расположена перпендикулярно к линии Ni-Ni (Ni2N2 образует искаженный тетраэдр) {[(PhLi)3Ni]2N2 " 2Et2O}2 . В этом комплексе N2 сильно восстановлен (длина связи N-N 1,35 Б является промежуточной между длинами N-N и N=N связей).
Среди комплексов молекулярного азота имеются устойчивые моно- и биядерные комплексы, в которых координированная молекула N2 не взаимодействует с восстановителями и электрофильными реагентами (Ru, Rh, Ir, Os, Re - тип А). В устойчивых моноядерных комплексах типа Б (WL4(N2)2 и MoL4(N2)2) N2 реагирует с электрофильными частицами HX, RCOX. В малоустойчивых биядерных комплексах Ti(III) и Ti(II) (типа В) молекула N2 легко реагирует с восстановителями и электрофильными частицами (H+, комплексы Ti(II)) с образованием гидразина и аммиака. К этой группе относятся, вероятно, и еще не выделенные комплексы Mo(III) и V(II).
|
|
|
Как следует из табл. 1, наиболее существенным для активации азота является перенос электрона (или электронов) на разрыхляющие орбитали молекулы N2 . Именно этот процесс переноса электронов с металла на N2 и наблюдается в первичных комплексах LnM-N2 или LnMNNMLn . Комплексы металлов, способных к эффективному переносу электронов на молекулярный азот, и являются наиболее эффективными восстановителями и катализаторами восстановления N2 (комплексы типа Б и В). Вследствие переноса электронов на N2 в комплексе основность координированной молекулы азота возрастает. Из-за высокой энергии разрыва первой связи в молекуле N2 одно- и двухэлектронное восстановление азота требует очень сильных восстановителей. Так, для образования N2H2 требуется восстановитель с потенциалом > - 1,1 В (pH = 0) и > - 1,5 В (pH = 7). И это в протонных средах, где энергетические требования к восстановителю ниже, чем в апротонных. Если процесс восстановления будет многоэлектронным (четырехэлектронным), то можно использовать более слабые одно- и двухэлектронные восстановители (А.Е. Шилов, Г.И. Лихтенштейн, 1970). Таким образом, частичное восстановление азота в биядерном комплексе и образование связей M-N
|
|
|
M-N=N-M или M=N-N=M
или восстановление азота в одноядерном комплексе в результате образования связей M-X и N-E (E - электрофил)
X-M-N=N-E
позволяет компенсировать энергии разрыва связей в молекуле азота.
Детальный механизм реакции Вольпина-Шура в апротонных средах установлен для реакций Cp2TiCl2 (или Cp2TiCl) с RMgX [4, 6].
Основные черты механизма, в котором комплекс (I) есть производное диазена Cp2TiIII-N=N-TiIIICp2 , комплекс (II) - производное гидразина , а комплекс (III) - нитридное производное Cp2Ti-N(MgCl)2 . Магнийорганическое соединение в этих реакциях выполняет роль одноэлектронного восстановителя.
Восстановление азота в комплексах типа Б происходит в результате атаки азотного лиганда, на котором повышена электронная плотность за счет переноса электронов с металла, протоном (НХ) или другим электрофилом E(EX) (окислительное присоединение к металлу) [5].
Восстановление N2 в протонных средах в реакциях с относительно слабыми восстановителями (TiIII, VII) происходит, по мнению А.Е. Шилова [3], через
биядерные комплексы типа M-N=N-M (IV), M=N-N=M (V) в результате образования четырехядерных комплексов (VI) из (IV) или протонирования (V) до (VII).
Биологическая фиксация N 2
Изучение механизмов активации и восстановления азота в растворах комплексов переходных металлов, несомненно, очень важно для понимания механизма действия фермента нитрогеназы и создания химических моделей этого фермента. В этой связи очень интересны последние достижения в изучении структуры окислительно-восстановительных центров фермента.
Фермент нитрогеназа содержится в нескольких видах микроорганизмов. Фермент, выделенный из Azotobacter vinelandii, состоит из двух белков с молекулярной массой 240 000 и ~ 60 000Da. Первый белок (тетрамер из четырех белковых глобул) содержит атомы Mo и Fe в редокс-центрах (MoFe-белок). Второй белок (димер из двух белковых глобул) содержит только атомы железа в виде сульфидного кластера Fe4S4 (Fe-белок). Кластер соединен с белковой молекулой четырьмя тиольными (RS) группами аминокислотных остатков цистеина (Cys). В MoFe-белке имеются два окислительно-восстановительных центра: MoFe-кофактор (активный центр фермента) и P-кластер, содержащий два кубаноподобных кластера Fe4S4, соединенных двумя Cys-группами. Недавно на основании кристаллографических исследований MoFe-белка нитрогеназы из Azotobacter vinelandii предложена структура этих двух центров. Структура кофактора (без дополнительных лигандов) приведена на рис. 1, а. Короткие расстояния Fe_Fe (~ 2,5 Б) между двумя кластерами Fe4S3 и Fe3MoS3 , связанными двумя сульфидными мостиками и третьим лигандом (Y), говорят о возможности взаимодействия Fe_Fe. Предполагается, что три слабые Fe_Fe-связи могут разорваться при взаимодействии с N2 и молекула N2 может быть включена во внутреннюю полость кофактора, замещая связи Fe_Fe связями Fe_N. В таком комплексе создаются условия для переноса нескольких (4, 6) электронов на азот от восстановителя через P-кластер. Атом Mo в рамках этой модели является одним из источников электронов. Очевидно, что Mo не обязательный участник восстановления N2 , поскольку известны и другие нитрогеназы, в которых атом Mo замещен атомами ванадия или железа. Процесс восстановления N2 на молибденсодержащих нитрогеназах включает три основных этапа переноса электронов:
1) восстановление Fe-белка донорами электронов (ферредоксином в клетке или дитионитом Na2S2O4 в колбе);
2) перенос электронов с восстановленного Fe-белка (через P-кластер) на MoFe-белок. Этот процесс зависит от гидролиза магниевой соли аденозинтрифосфата (MgАТФ) до аденозиндифосфата (MgАДФ);
3) перенос электронов на N2 (или другой субстрат), связанный с кофактором.
Суммарная стехиометрия восстановления описывается уравнением
N2 + + 8H+ + 16MgАТФ 2NH3 + H2 +
+ 16MgАДФ + 16Pi (Pi - фосфат-анион)
Роль многоцентровых взаимодействий (участие нескольких атомов металла) в активации молекулярного азота в протонных и апротонных средах в целом согласуется с результатами изучения структуры кофактора и железных кластеров в нитрогеназе [4].
Водородные соединения азота
Азот и водород взаимодействуют, образуя соединения, отдаленно напоминающие углеводороды. Стабильность азотоводородов уменьшается с увеличением числа атомов азота в цепи в отличие от углеводородов, которые устойчивы и в длинных цепях. Наиболее важные нитриды водорода – аммиак NH3 и гидразин N2H4. К ним относится также азотистоводородная кислота HNNN (HN3).
Аммиак NH3. Аммиак – один из наиболее важных промышленных продуктов современной экономики. В конце 20 в. США производили ок. 13 млн. т аммиака ежегодно (в пересчете на безводный аммиак).
Строение молекулы. Молекула NH3 имеет почти пирамидальное строение. Угол связи H–N–H составляет 107°, что близко к величине тетраэдрического угла 109°. Неподеленная электронная пара эквивалентна присоединенной группе, в результате координационное число азота равно 4 и азот располагается в центре тетраэдра.

Таблица 3. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА И ВОДЫ
| Свойство | Аммиак | Вода |
| Плотность, г/см3 | 0,65 (–10° С) | 1,00 (4,0° С) |
| Температура плавления, °С | –77,7 | 0 |
| Температура кипения, °С | –33,35 | 100 |
| Критическая температура, °С | 132 | 374 |
| Критическое давление, атм | 112 | 218 |
| Энтальпия испарения, Дж/г | 1368 (–33° С) | 2264 (100° С) |
| Энтальпия плавления, Дж/г | 351 (–77° С) | 334 (0° С) |
| Удельная электропроводность | 5Ч10–11 (–33° С) | 4Ч10–8 (18° С) |
Температуры кипения и плавления у аммиака намного ниже, чем у воды, несмотря на близость молекулярных масс и сходство строения молекул. Это объясняется относительно большей прочностью межмолекулярных связей у воды, чем у аммиака (такая межмолекулярная связь называется водородной).
Аммиак как растворитель
Высокая диэлектрическая проницаемость и дипольный момент жидкого аммиака позволяют использовать его как растворитель для полярных или ионных неорганических веществ. Аммиак-растворитель занимает промежуточное положение между водой и органическими растворителями типа этилового спирта. Щелочные и щелочноземельные металлы растворяются в аммиаке, образуя темносиние растворы. Можно полагать, что в растворе происходит сольватация и ионизация валентных электронов по схеме:

Синий цвет связывают с сольватацией и движением электронов или с подвижностью «дырок» в жидкости. При высокой концентрации натрия в жидком аммиаке раствор принимает бронзовую окраску и отличается высокой электропроводностью. Несвязанный щелочной металл можно выделить из такого раствора испарением аммиака или добавлением хлорида натрия. Растворы металлов в аммиаке являются хорошими восстановителями. В жидком аммиаке происходит автоионизация

аналогично процессу, протекающему в воде:

Жидкий аммиак как растворитель имеет преимущество в некоторых случаях, когда невозможно проводить реакции в воде из-за быстрого взаимодействия компонентов с водой (например, окисление и восстановление). Например, в жидком аммиаке кальций реагирует с KCl с образованием CaCl2 и K, поскольку CaCl2 нерастворим в жидком аммиаке, а К растворим, и реакция протекает полностью. В воде такая реакция невозможна из-за быстрого взаимодействия Ca с водой [8,10].
Получение аммиака
Газообразный NH3 выделяется из солей аммония при действии сильного основания, например, NaOH:

Метод применим в лабораторных условиях. Небольшие производства аммиака основаны также на гидролизе нитридов, например Mg3N2, водой. Цианамид кальция CaCN2 при взаимодействии с водой также образует аммиак. Основным промышленным методом получения аммиака является каталитический синтез его из атмосферного азота и водорода при высоких температуре и давлении:

Водород для этого синтеза получают термическим крекингом углеводородов, действием паров воды на уголь или железо, разложением спиртов парами воды или электролизом воды. На синтез аммиака получено множество патентов, отличающихся условиями проведения процесса (температура, давление, катализатор). Существует способ промышленного получения при термической перегонке угля. С технологической разработкой синтеза аммиака связаны имена Ф.Габера и К.Боша [8,9,10].
Оксиды азота
В соединениях с кислородом азот проявляет все степени окисления, образуя оксиды: N2O, NO, N2O3, NO2 (N2O4), N2O5. Имеется скудная информация об образовании пероксидов азота (NO3, NO4).
Оксид азота(I) N2O (монооксид диазота) получается при термической диссоциации нитрата аммония:

Молекула имеет линейное строение

N2O довольно инертен при комнатной температуре, но при высоких температурах может поддерживать горение легко окисляющихся материалов. N2O, известный как «веселящий газ», используют для умеренной анестезии в медицине.
Оксид азота(II) NO – бесцветный газ, является одним из продуктов каталитической термической диссоциации аммиака в присутствии кислорода:
NO образуется также при термическом разложении азотной кислоты или при реакции меди с разбавленной азотной кислотой:

NO можно получать синтезом из простых веществ (N2 и O2) при очень высоких температурах, например в электрическом разряде. В структуре молекулы NO имеется один неспаренный электрон. Соединения с такой структурой взаимодействуют с электрическим и магнитным полями. В жидком или твердом состоянии оксид имеет голубую окраску, поскольку неспаренный электрон вызывает частичную ассоциацию в жидком состоянии и слабую димеризацию в твердом состоянии: 2NO N2O2.
Оксид азота(III) N2O3 (триоксид азота) – ангидрид азотистой кислоты:
N2O3 + H2O = 2HNO2.
Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (–20° С) из эквимолекулярной смеси NO и NO2. N2O3 устойчив только в твердом состоянии при низких температурах (т.пл. –102,3° С), в жидком и газообразном состояния он снова разлагается на NO и NO2.
Оксид азота(IV) NO2 (диоксид азота) также имеет в молекуле неспаренный электрон (см. выше оксид азота(II)). В строении молекулы предполагается трехэлектронная связь, и молекула проявляет свойства свободного радикала (одна линия соответствует двум спаренным электронам)

NO2 получается каталитическим окислением аммиака в избытке кислорода или окислением NO на воздухе:

а также по реакциям:
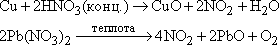
При комнатной температуре NO2 – газ темнокоричневого цвета, обладает магнитными свойствами благодаря наличию неспаренного электрона. При температурах ниже 0° C молекула NO2 димеризуется в тетраоксид диазота, причем при –9,3° C димеризация протекает полностью: 2NO2 N2O4. В жидком состоянии недимеризовано только 1% NO2, а при 100° C остается в виде димера 10% N2O4.
NO2 (или N2O4) реагирует в теплой воде с образованием азотной кислоты: 3NO2 + H2O = 2HNO3 + NO. Технология NO2 поэтому очень существенна как промежуточная стадия получения промышленно важного продукта – азотной кислоты.
Оксид азота(V) N2O5 (устар. ангидрид азотной кислоты) – белое кристаллическое вещество, получается обезвоживанием азотной кислоты в присутствии оксида фосфора P4O10:

N2O5 легко растворяется во влаге воздуха, вновь образуя HNO3. Свойства N2O5 определяются равновесием

N2O5 – хороший окислитель, легко реагирует, иногда бурно, с металлами и органическими соединениями и в чистом состоянии при нагреве взрывается. Вероятную структуру N2O5 можно представить как

Оксокислоты азота. Для азота известны три оксокислоты: гипоазотистая H2N2O2, азотистая HNO2 и азотная HNO3.
Гипоазотистая кислота H2N2O2 – очень нестабильное соединение, образуется в неводной среде из соли тяжелого металла – гипонитрита при действии другой кислоты: M2N2O2 + 2HX 2MX + H2N2O2. При выпаривании раствора образуется белое взрывчатое вещество с предполагаемой структурой H–O–N=N–O–H.
Азотистая кислота HNO2 не существует в чистом виде, однако водные растворы ее невысокой концентрации образуются при добавлении серной кислоты к нитриту бария:

Азотистая кислота образуется также при растворении эквимолярной смеси NO и NO2 (или N2O3) в воде. Азотистая кислота немного сильнее уксусной кислоты. Степень окисления азота в ней +3 (ее структура H–O–N=O), т.е. она может являться и окислителем, и восстановителем. Под действием восстановителей она восстанавливается обычно до NO, а при взаимодействии с окислителями окисляется до азотной кислоты.
Скорость растворения некоторых веществ, например металлов или иодид-иона, в азотной кислоте зависит от концентрации азотистой кислоты, присутствующей в виде примеси. Соли азотистой кислоты – нитриты – хорошо растворяются в воде, кроме нитрита серебра. NaNO2 применяется в производстве красителей [15,9,14].
Получение и применение азота
В лаборатории азот легко может быть получен при нагревании концентрированного нитрита аммония:
NH4NO2 = N2 + 2H2
В лаборатории чистый («химический») азот получают добавляя при нагревании насыщенный раствор хлорида аммония NH4Cl к твердому нитриту натрия NaNO2 при нагревании:
NaNO2 + NH4Cl = NaCl + N2 + 2H2O
O. Технический способ получения азота основан на разделении предварительно сжиженного воздуха, который затем подвергается разгонке. Для этого воздух сначала охлаждают, сжижают, а жидкий воздух подвергают перегонке (дистилляции). Температура кипения азота немного ниже (–195,8°C), чем другого компонента воздуха — кислорода (–182,9°C), поэтому при осторожном нагревании жидкого воздуха азот испаряется первым. Потребителям газообразный азот поставляют в сжатом виде (150 атм. или 15 МПа) в черных баллонах, имеющих желтую надпись «азот».
Основная часть добываемого свободного азота используется для промышленного производства аммиака, который затем в значительных количествах перерабатывается на азотную кислоту, удобрения, взрывчатые вещества и т. д. Помимо прямого синтеза аммиака из элементов, промышленное значение для связывания азота воздуха имеет разработанный в 1905 цианамидный метод, основанный на том, что при 10000С карбид кальция (получаемый накаливанием смеси известии угля в электрической печи) реагирует со свободным азотом:
CaC2 + N2= CaCN2 + C
Образующийся цианамид кальция при действии перегретого водяного пара разлагается с выделением аммиака:
CaCN2 + 3H2O = CaCO3 + 2NH3.
Cвободный азот применяют во многих отраслях промышленности: как инертную среду при разнообразных химических и металлургических процессах, для заполнения свободного пространства в ртутных термометрах, при перекачке горючих жидкостей и т. д. Жидкий азот находит применение в различных холодильных установках. Его хранят и транспортируют в стальных сосудах Дьюара, газообразный азот в сжатом виде - в баллонах. Широко применяют многие соединения азота. Производство связанного азота стало усиленно развиваться после 1-й мировой войны и сейчас достигло огромных масштабов [14].
Дата добавления: 2019-07-15; просмотров: 229; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
