Тема: «Спирты. Простые эфиры»
Цель работы: освоить экспериментальный способ распознавания одноатомных и многоатомных спиртов, изучить химические свойства этанола.
Опыт № 1. Растворимость спиртов
В разные пробирки внесите 2-3 капли этилового, бутилового спирта и глицерина. В каждую пробирку добавьте по 4-5 капель воды, взболтайте. Допишите схемы растворения спиртов:
С2Н5ОН +Н2О →
С4Н9ОН +Н2О →
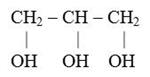 + Н2О →
+ Н2О →
Отметьте наблюдения и сделайте вывод.
Опыт № 2. Получение и гидролиз алкоголята калия
Налейте в одну пробирку 5 капель воды, в другую — 5 капель абсолютного этилового спирта. Положите в каждую из них по очень маленькому кусочку металлического калия. Добавьте в пробирки по капле фенолфталеина. Отметьте наблюдения. В пробирку, где спирт, добавьте 2 капли воды. Взболтайте. Наблюдается ли изменение окраски. Допишите уравнения реакций:
С2Н5ОН +К →
С2Н5ОК + Н2О →
Сделайте вывод.
Опыт № 3. Окисление спиртов
Поместите в пробирку 3 капли этанола, добавьте 2 капли раствора бихромата калия и 2 капли раствора серной кислоты. Полученный раствор нагрейте до изменения цвета. Осторожно понюхайте. Запах какого вещества вы ощущаете? Допишите уравнение реакции:
С2Н5ОН + K2Cr2O7 + H2SO4 
Отметьте наблюдения. Сделайте вывод о том, подвержены ли спирты действию окислителей в каких условиях и какие продукты окисления при этом получаются.
Опыт № 4. Образование глицерата меди
Поместите в пробирку 2 капли раствора сульфата меди (II) и добавьте 4 капли раствора едкого натра. Отметьте наблюдения.
|
|
|
Добавьте в эту же пробирку добавьте 3 капли глицерина и тщательно перемешайте содержимое. Что произошло с осадком? Допишите уравнения реакций:
CuSO4 + NaOH →
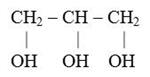 + Сu(OH)2 →
+ Сu(OH)2 →
Проделайте аналогичный опыт с этиловым спиртом. Отметьте наблюдения. Сделайте вывод.
Оснащение: реактивы — вода, этанол металлический натрий (калий), фенолфталеин, раствор бихромата калия, раствор серной кислоты, раствор сульфата меди (II), концентрированный раствор щелочи, глицерин.
Оборудование - пробирки, спиртовки, пипетки, спички, стеклянные палочки.
ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Фенолы»
Цель работы: экспериментально получить и изучить свойства фенолята натрия и сравнить его свойства со свойствами других алкоголятов, доказать на практике влияние гидроксогруппы на бензольное кольцо.
Опыт № 1. Получение фенолята натрия
В пробирке растворите кристаллы фенола в растворе щелочи. Допишите уравнение реакции:
 + NaOH →
+ NaOH →
Сделайте вывод, какая разница в отношении к щелочам фенола и этанола. Чем объяснить эту разницу? Полученный раствор фенолята натрия оставьте для опытов№2 и №5.
|
|
|
Опыт № 2. Разложение фенолята натрия кислотой
К полученному раствору фенолята натрия в опыте№1 добавьте 1-2 капли HCl. Жидкость мутнеет, вследствие выделения фенола. Отметьте наблюдения. Допишите уравнение реакции:
С6Н5ОNa + HCl→
Сделайте вывод.
Опыт № 3. Бромирование фенола
Налейте в пробирку 4 капли насыщенного раствора бромной воды и добавьте 1-2 капли концентрированного раствора фенола. Встряхните. Отметьте наблюдения. Допишите уравнение реакции, протекающей между фенолом и бромом:
 + Br2 →
+ Br2 →
Какого типа эта реакция? Сделайте вывод.
Опыт № 4. Качественная реакция на фенольный гидроксил
Налейте в пробирку 10 капель раствора фенола и добавьте 1 каплю раствора хлорида железа (III). Отметьте наблюдения. Допишите уравнение реакции:
 + FeCl3 →
+ FeCl3 →
Сделайте вывод.
Опыт № 5. Антисептические свойства фенола
К раствору белка добавьте щелочной раствор фенола, полученный в опыте№1. Отметьте наблюдения. Сделайте вывод и обоснуйте антисептическое свойство фенола.
Опыт № 6. Свойства двухатомных фенолов
Приготовьте три предметных стекла. На первое предметное стекло поместите каплю раствора пирокатехина, на второе – каплю раствора резорцина, на третье – каплю раствора гидрохинона. На каждое стекло добавьте по 1 капле раствора хлорида железа (III).
|
|
|
На первом предметном стекле наблюдайте зеленую окраску, на втором– сине-фиолетовую и на третьем – зелёную, быстро переходящую в желтую. Допишите уравнения реакций:
 + FeCl3 →
+ FeCl3 →
 + FeCl3 →
+ FeCl3 →
 + FeCl3 →
+ FeCl3 →
Сделайте вывод, с какой целью можно применять данные реакции в анализе лекарственных препаратов.
Оснащение: реактивы — фенол (кр), раствор щелочи, бромная вода. этанол, раствор хлорида железа (III), раствор белка, раствор пирокатехина, раствор резорцина, раствор гидрохинона.
Оборудование — пробирки, предметные стекла, глазные палочки.
ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Карбоновые кислоты»
Цель работы: освоить технику проведения качественных реакций на одноосновные и двухосновные карбоновые кислоты и их соли
Опыт № 1. Свойства уксусной и бензойной кислот
В первую пробирку поместите 1 каплю уксусной кислоты, во вторую несколько кристалликов бензойной кислоты. В каждую добавьте по 3- 5 капли воды. Чтобы ускорить растворение бензойной кислоты раствор слегка нагрейте. По 1 капле полученных растворов кислот поместите на универсальную индикаторную бумагу. Индикаторная бумага краснеет. Допишите схемы реакции диссоциации кислот:
|
|
|
СН3СООН ↔ 
С6Н5СООН ↔
Сделайте вывод, почему изменился цвет универсальной индикаторной бумаги.
Опыт № 2. Качественная реакция на уксусную кислоту и ее соли
В пробирке нейтрализуйте 3-5 капель уксусной кислоты раствором аммиака. После этого добавьте 2-3 капли раствора хлорида железа (III). Отметьте наблюления. Нагрейте раствор до кипения. Есть ли изменения? Допишите схемы реакций образования ацетата железа (III) и его гидролиза:
СН3СООН +FeCl3 →
(CH3COO)3Fe +H2O 
Сделайте вывод.
Опыт № 3. Отношение уксусной кислоты к окислителям
К раствору уксусной кислоты добавьте несколько капель перманганата калия и H2SO4. Перемешайте. Что наблюдаете? Сделайте вывод.
Опыт № 4. Окисление муравьиной кислоты
К раствору муравьиной кислоты добавьте 2-3 капли аммиачного раствора нитрата серебра, осторожно нагрейте. Образуется черный осадок и блестящий зеркальный налет на стенках пробирки. Допишите схему реакции окисления муравьиной кислоты:
НСООН + [Ag(NH3)2]OH→
Сделайте вывод.
Опыт № 5. Качественная реакция на бензойную кислоту и ее соли
В пробирку внесите 1 лопаточку бензойной кислоты, добавьте 6-8 капель раствора щелочи. Встряхните, затем прилейте 2-3 капли раствора хлорида железа (III). Отметьте наблюдения. Допишите схему реакции:
 + NaOH +FeCI3 →
+ NaOH +FeCI3 →
Сделайте вывод.
Опыт № 6. Свойства щавелевой кислоты
6.1. К раствору щавелевой кислоты добавьте раствор перманганата калия и раствор серной кислоты. Отметьте наблюдения. Допишите схему реакции окисления щавелевой кислоты:
HOOC-COOH + KMnO4 +H2SO4→
6.2. На предметное стекло поместите 3 капли раствора щавелевой кислоты и 2-3 капли раствора хлорида кальция. Отметьте наблюдения. Допишите схему реакции:
HOOC-COOH + CaCl2→
Проверьте растворимость осадка в растворе уксусной кислоты.
Сделайте вывод о свойствах щавелевой кислоты.
Опыт № 7. Образование сложного эфира
В пробирку поместите 4 капли спирта и 5 капель уксусной кислоты. Добавьте 3 капли концентрированной серной кислоты и осторожно нагрейте до кипения. Содержимое вылейте в пробирку с холодной водой. Эфир всплывает наверх и появляется характерный приятный запах. Отметьте наблюдения. Допишите схему реакции этерификации:
СН3СООН + С2Н5ОН 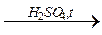
Сделайте вывод.
Оснащение: реактивы — раствор уксусной кислоты, бензойная кислота, спирт этиловый, концентрированная серная кислота, раствор хлорида желез (III), лакмусовая бумага (синяя), вода, муравьиная кислота, раствор аммиака, раствор щелочи, аммиачный раствор нитрата серебра, щавелевая кислота (кр), раствор перманганата калия, раствор серной кислоты, раствор хлорида кальция.
Оборудование — пробирки, спиртовки, спички, часовые стекла, стеклянные палочки.
ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Амины»
Цель работы: доказать экспериментально, что анилин, обладая основными свойствами, может вступать в реакции с кислотами, образуя соли; доказать, что аминогруппа усиливает реакционную способность бензольного кольца.
Опыт № 1. Свойства анилина и его солей
Проверьте растворимость анилина в воде. Часть эмульсии анилина отлейте в другую пробирку. Налейте 1 каплю раствора анилина на красную лакмусовую бумагу. Почему цвет ее не меняется?
В первую пробирку добавьте 1 каплю раствора соляной кислоты, во вторую 1 каплю раствора серной кислоты. Отметьте наблюдения. Допишите схемы реакций:
 + НСl →
+ НСl →
 + Н2SO4→
+ Н2SO4→
Сделайте вывод о свойствах анилина.
Опыт № 2. Качественная реакция на анилин
Получите из имеющихся реактивов 2,4,6 - триброманилин. Вспомните особенности этой реакции. Отметьте наблюдения. Допишите уравнение реакции:
 + Вr2→
+ Вr2→
Сделайте вывод.
Опыт № 3. Цветные реакции на анилин
3.1. 1 каплю хлористоводородной соли анилина поместите на полоску газетной бумаги, и 1 каплю на полоску фильтровальной бумаги. Отметьте наблюдения.
3.2. На часовое стекло поместите 2 капли хлористоводородной соли анилина. Добавьте 1 каплю раствора бихромата калия и 1 каплю раствора серной кислоты. Допишите схему реакции окисления анилина:
 + K2Cr2O7 + H2SO4→
+ K2Cr2O7 + H2SO4→
3.3. На часовом стекле проведите цветную реакцию анилина с раствором хлорной извести. Отметьте наблюдения.
Сделайте вывод.
Опыт № 4. Качественная реакция на ароматическую аминогруппу.
4.1. Диазотирование стрептоцида
В пробирке растворите 0,05 г стрептоцида в воде. Подкислите раствором соляной кислоты и добавьте 2 капли раствора нитрита натрия. Допишите схему реакции образования соли диазония:
 + NaNO2 +HCl →
+ NaNO2 +HCl →
Раствор сохраните для опыта № 4.2.
4.2. Реакция азосочетания
Полученный в предыдущем опыте раствор хлорида диазония добавьте в щелочной раствор ß - нафтола. Отметьте наблюдения. Допишите схему реакции образования азокрасителя:

Сделайте вывод.
Оснащение: реактивы — анилин, раствор серной кислоты, раствор соляной кислоты, лакмусовая бумага (красная), газетная бумага, фильтровальная бумага, бромная вода, раствор бихромата калия, раствор хлорной извести стрептоцид (кр), раствор соляной кислоты, раствор нитрита натрия, щелочной раствор ß-нафтола. Оборудование — пробирки, часовые стекла, стеклянные палочки, глазные пипетки.
ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Оксикислоты»
Цель работы: доказать экспериментально строение (наличие функциональных групп) и свойства оксикислот.
Опыт №1. Образование тартрата и гидротартрата калия
На часовое стекло поместите 2 капли раствора винной кислоты и 1 каплю раствора гидроксида калия, потрите стеклянной палочкой о стенки часового стекла. Выпадает мелкокристаллический осадок кислой соли. Добавьте избыток щелочи. Отметьте наблюдения. Допишите схемы реакций образования кислой и средней солей винной кислоты:
НООС-СН(ОН)-СН(ОН)-СООН + КОН →
НООС-СН(ОН)-СН(ОН)-СООК + КОН →
Сделайте вывод.
Опыт № 2. Доказательство наличия гидроксильных групп в винной кислоте
В пробирке получите гидроксид меди (II). Добавьте к выпавшему голубому осадку раствор сегнетовой соли. Осадок растворяется, образуется ярко-синий раствор. Допишите схемы реакций образования жидкости Фелинга:
CuSO4 + NaOH →
 + Cu(OH)2 →
+ Cu(OH)2 →
Сделайте вывод о строении винной кислоты и сегнетовой соли.
Опыт № 3. Качественная реакция на лимонную кислоту и ее соли
В пробирку поместите несколько кристалликов лимонной кислоты и растворите ее в 1 мл воды очищенной. Раствор нейтрализуйте на лакмус раствором аммиака и добавьте 1-2 капли раствора хлорида кальция. Раствор прокипятите 2-3 минуты, выпадает осадок. Допишите схему реакции:
 + CaCl2
+ CaCl2 
Сделайте вывод.
Оснащение: реактивы — раствор винной кислоты, раствор гидроксида калия, раствор сульфата меди, раствор сегнетовой соли, лимонная кислота, концентрированная серная кислота, вода очищенная, раствор аммиака, раствор хлорида кальция.
Оборудование — пробирки, часовые стекла, спиртовки, спички, глазные палочки, пипетки.
ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Фенолокислоты»
Цель работы: доказать экспериментально строение (наличие функциональных групп) и свойства фенолокислот.
Опыт №1. Отношение фенолокислот к растворителям
В три пробирки добавьте по 1 мл воды очищенной, в первую поместите несколько кристалликов салициловой кислоты, во вторую – салицилат натрия, в третью – ацетилсалициловую кислоту, слегка нагрейте над пламенем спиртовки. Обратите внимание на растворимость данных веществ в воде. Полученные растворы оставьте для опыта №2. Проделайте тот же опыт, растворяя салициловую кислоту, салицилат натрия и ацетилсалициловую кислоту в спирте. Отметьте наблюдения. Полученные результаты оформите схематично:
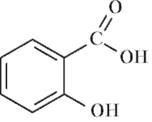 + Н2О →
+ Н2О →
 + Н2О →
+ Н2О →
 + Н2О →
+ Н2О →
 + С2Н5ОН →
+ С2Н5ОН →
 + С2Н5ОН →
+ С2Н5ОН →
 + С2Н5ОН →
+ С2Н5ОН →
Сделайте вывод.
Опыт № 2. Качественные реакции на фенолокислоты
В пробирки с водными растворами фенолокислот из опыта №1 добавьте по 2-3 капли раствора хлорида железа(III). Отметьте наблюдения. Допишите схемы реакций:
 + FeCl3→
+ FeCl3→
 + FeCl3 →
+ FeCl3 →
 + FeCl3 →
+ FeCl3 →
В каком случае реакция не идёт? Сделайте вывод о строении фенолокислот.
Опыт № 3. Омыление ацетилсалициловой кислоты
В пробирку поместите несколько кристалликов ацетилсалициловой кислоты, добавьте 1 мл воды очищенной и 5-7 капель раствора щёлочи. Раствор нагрейте в течение 5-6 минут и добавьте 2-3 капли раствора хлорида железа(III). Отметьте наблюдения. Допишите схемы реакций:
 + NaOH →
+ NaOH →
 + FeCl3 →
+ FeCl3 →
Сделайте вывод о химическом строении молекулы ацетилсалициловой кислоты.
Оснащение: реактивы — салициловая кислота, салицилат натрия, ацетилсалициловая кислота, раствор гидроксида натрия, раствор хлорида железа(III), вода очищенная, этанол.
Оборудование — пробирки, спиртовки, спички, глазные палочки, пипетки.
ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Аминокислоты. Белки»
Цель работы: изучить способы коагуляции (денатурирование) белков, изучить качественные реакции на белки.
Опыт № 1. Амфотерные свойства глицина
В пробирку поместите 5 капель 1% раствора глицина, добавьте 1 каплю метилового красного. Раствор имеет желтую окраску. Укажите среду. В пробирку добавьте 2 капли формалина. Изменения? Напишите уравнения реакций. Сделайте вывод.
Опыт № 2. Свертывание белков при нагревании
В пробирку поместите 5 капель раствора белка. Нагрейте до кипения.
Содержимое охладите, и попробуйте растворить в воде. Сделайте вывод об изменениях в структуре белка.
Опыт № 3. Ксантопротеиновая реакция
В пробирку поместите 10 капель раствора белка и 2 капли концентрированной азотной кислоты. Смесь осторожно нагрейте до появления желтого осадка, охладите. Добавьте по каплям концентрированный раствор аммиака. Отметьте наблюдения. Сделайте вывод, можно ли считать данную реакцию качественной на белок?
Опыт № 4. Биуретовая реакция
В пробирку поместите 5 капель раствора белка и 5 капель 10% раствора гидроксида натрия. Добавьте 1-2 капли раствора сульфата меди (II). Отметьте наблюдения. Сделайте вывод.
Оснащение: реактивы — раствор белка, раствор глицина, метиловый красный, формалин, концентрированная азотная кислота, раствор аммиака, раствор сульфата меди (II), раствор щелочи.
Оборудование — пробирки, спиртовки, спички, глазные палочки, пипетки.
ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Глициды»
Цель работы: доказать экспериментально строение (наличие функциональных групп) и свойства глицидов. Изучить качественные реакции на глициды.
Опыт № 1. Доказательство наличия альдегидной группы в молекуле глюкозы
1.1. Реакция «серебряного зеркала»:
Поместите в пробирку 5 капель раствора нитрата серебра и 5 капель раствора аммиака. Добавьте 3-5 капель раствора глюкозы и подогрейте полученную смесь. Отметьте наблюдения. Допишите уравнение реакции:
 + [Ag(NH3)2]OH
+ [Ag(NH3)2]OH 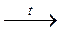
1.2. Реакция «медного зеркала»:
Поместите в пробирку 5 капель раствора сульфата меди и 5 капель раствора щёлочи. Добавьте 3-5 капель раствора глюкозы и подогрейте полученную смесь. Отметьте наблюдения. Допишите уравнения реакций:
CuSO4 + NaOH →
 + Cu(OH)2
+ Cu(OH)2 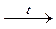
Сделайте вывод о строении молекулы глюкозы.
Опыт № 2. Образование сахарата меди
Поместите в пробирку 5 капель раствора сульфата меди и 5 капель раствора щёлочи. Добавьте 3-5 капель раствора глюкозы и взболтайте полученную смесь. Допишите уравнения реакций:
CuSO4 + NaOH →
 + Cu(OH)2 →
+ Cu(OH)2 →
Отметьте наблюдения. Сделайте вывод о строении молекулы глюкозы.
Опыт № 3. Реакция с жидкостью Фелинга
В пробирку поместите 5-7 капель раствора глюкозы и 2-3 капли жидкости Фелинга. Смесь осторожно нагрейте до появления кирпично-красного осадка. Допишите схему реакции:
ОН СООК
│ │
 СН2-СН-СН-СН-СН-СОН + НСО
СН2-СН-СН-СН-СН-СОН + НСО
 │ │ │ │ │ Cu
│ │ │ │ │ Cu 
ОН ОН ОН ОН НСО
│
СООNa
Отметьте наблюдения. Сделайте вывод, можно ли считать данную реакцию качественной на глюкозу.
Оснащение: реактивы — раствор глюкозы, раствор аммиака, раствор сульфата меди (II), раствор щелочи, жидкость Фелинга, раствор нитрата серебра.
Оборудование — пробирки, спиртовки, спички, пипетки.
ПРАКТИЧЕСКАЯ РАБОТА
Дата добавления: 2019-02-22; просмотров: 2155; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
