Окислительно-восстановительные реакции и электрохимические процессы
Окислительно-восстановительные реакции – это химические процессы, сопровождающиеся изменением степени окисления элементов, входящих в состав реагирующих веществ.
Окислительно-восстановительные реакции представляют собой единство двух процессов – окисления и восстановления.
Окисление – процесс отдачи электронов атомом, молекулой или ионом. Степень окисления элемента при этом повышается.
Восстановление – процесс присоединения электронов атомом, молекулой или ионом. Степень окисления элемента при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, окисляются, сами при этом являются восстановителями. Частицы, принимающие электроны, восстанавливаются, сами при этом являются окислителями.
Для окислительно-восстановительных реакций существует правило: число электронов, отданных восстановителем, равно числу электронов, присоединенных окислителем.
Соединения, содержащие атомы элементов в их максимальной степени окисления, могут быть только окислителями за счет этих атомов. Соединения, содержащие атомы элементов в их низшей степени окисления, наоборот, могут служить только восстановителями за счет этих атомов. Соединения, содержащие атомы элементов в их промежуточной степени окисления, могут быть как окислителями, так и восстановителями в зависимости от условий реакции и от природы других веществ, участвующих в реакции.
|
|
|
Если пластинку металла погрузить в раствор его соли, то под действием диполей воды ионы металла, находящиеся в узлах кристаллической решетки, гидратируются и переходят в раствор, оставляя в металле избыточные электроны. Но одновременно происходит обратный процесс: ионы металла из раствора переходят на пластинку (будем называть ее электродом) и разряжаются, превращаясь в атомы металла. В конце концов, скорости этих двух процессов выравниваются, и между металлом и его ионами в растворе устанавливается равновесие:
Men + + ne - ⇆ Me .
На границе металл-раствор возникает двойной электрический слой. Поверхность металла имеет один заряд, а примыкающий к ней раствор заряжается противоположно. Двойной электрический слой характеризуется разностью потенциалов. Знак и величина потенциала электрода будет зависеть от природы металла, концентрации его ионов в растворе, температуры.
Абсолютное значение электродного потенциала j отдельного электрода экспериментально определить нельзя, его измеряют относительно другого электрода, потенциал которого известен. Условились принимать потенциал стандартного водородного электрода равным нулю.
|
|
|
Стандартный водородный электрод представляет собой платиновую пластинку, покрытую губчатой платиной, погруженную в раствор кислоты с активностью ионов водорода, равной 1 моль/л. Электрод омывается газообразным водородом при давлении 1 атм. и температуре 298 К. При этом устанавливается равновесие:
2Н++2 е - ⇆ Н2
Если стандартный водородный электрод связать через электролитический ключ с раствором соли металла, в который погружена пластинка металла (металлический электрод), то при соединении электродов металлическим проводником, по нему потечет электрический ток. Возникнет гальванический элемент – устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в энергию электрического тока. ЭДС (электродвижущая сила) гальванического элемента e равна разности равновесных потенциалов электродов:
e = j К – j А ,
где j К – потенциал катода (электрода, на котором идут процессы восстановления, сам электрод является окислителем);
j А – потенциал анода (электрода, на котором идут процессы окисления, сам электрод является восстановителем).
В гальваническом элементе анод заряжен отрицательно, а катод – положительно. При работе гальванического элемента электроны по внешней цепи переходят от восстановителя (анода) к окислителю (катоду).
|
|
|
В гальваническом элементе полуреакции окисления и восстановления разъединены в пространстве, если же восстановитель непосредственно взаимодействует с окислителем, то направление перехода электронов такое же, и самопроизвольно будет идти только та окислительно-восстановительная реакция, в которой у окислителя электродный потенциал больше, чем у восстановителя.
ЭДС гальванического элемента можно измерить. За стандартный потенциал j 0 данного металлического электрода принимается ЭДС гальванического элемента, составленного из стандартного водородного электрода и пластинки металла, помещенной в раствор соли этого металла, причем активность (в разбавленных растворах можно использовать концентрацию) катионов металла в растворе должна бать равна 1 моль/л; Т=298 К; р=1 атм. (стандартные условия). Значение стандартного электродного потенциала всегда относят к полуреакции восстановления
Men + + ne - = Me.
Располагая металлы в порядке возрастания величины их стандартных электродных потенциалов j 0 , отвечающих полуреакции восстановления, получают ряд напряжений металлов (ряд стандартных электродных потенциалов). В этот же ряд помещают стандартный электродный потенциал водородного электрода, принимаемый за нуль. Далее, в таблице 2.10.1, приводится ряд напряжений для наиболее распространенных металлов:
|
|
|
Таблица 2.10.1 – Стандартные электродные потенциалы металлических электродов
| Электрод | φ0, В | Электрод | φ0, В | Электрод | φ0, В |
| Li + /Li | -3,045 | Mn 2+ /Mn | -1,180 | Pb 2+ /Pb | -0,126 |
| K + /K | -2,925 | Zn 2+ /Zn | -0,763 | 2 H + /H 2 | 0,000 |
| Ba 2+ /Ba | -2,906 | Cr 3+ /Cr | -0,744 | Sb 3+ /Sb | +0,200 |
| Sr 2+ /Sr | -2,891 | Fe 2+ /Fe | -0,440 | Bi 3+ /Bi | +0,230 |
| Ca 2+ /Ca | -2,866 | Cd 2+ /Cd | -0,403 | Cu 2+ /Cu | +0,337 |
| Na + /Na | -2,714 | Co 2+ /Co | -0,277 | Hg 2+ /Hg | +0,854 |
| Mg 2+ /Mg | -2,363 | Ni 2+ /Ni | -0,250 | Ag + /Ag | +0,799 |
| Al 3+ /Al | -1,662 | Sn 2+ /Sn | -0,136 | Au 3+ /Au | +1,498 |
Зависимость электродных потенциалов от концентрации и температуры выражается уравнением Нернста, которое применительно к системе Men + + ne - = Me запишется в виде:
 , (2.10.1)
, (2.10.1)
где  – стандартный электродный потенциал;
– стандартный электродный потенциал;
R – газовая постоянная;
F – постоянная Фарадея (»96500 Кл/моль);
n – число электронов, участвующих в процессе;
аМе n + - активность ионов металла в растворе.
Принимая Т=298К, получим:
 , (2.10.2)
, (2.10.2)
причем активность в разбавленных растворах можно заменить концентрацией ионов, выраженной в моль/л.
Гальванические элементы часто записывают схематически, при этом границу раздела между проводником с электронной проводимостью (проводник первого рода) и проводником с ионной проводимостью (проводник второго рода) изображают одинарной чертой; двойной чертой показывают границу раздела между двумя проводниками второго рода; слева записывают символ более отрицательного электрода (анода), а справа – более положительного электрода (катода); полуреакция, протекающая на левом электроде, записывается как окислительная, а полуреакция на правом электроде – как восстановительная. В соответствии с этим схематическая запись для гальванического элемента Даниэля-Якоби, в котором цинковый и медный электроды погружены в растворы их солей, выглядит следующим образом:
Zn / ZnSO 4 // CuSO 4 / Cu или Zn / Zn 2+ // Cu 2+ / Cu .
Пример 1
Определите степень окисления серы в соединениях: Н2S, Na2S2O3, H2SO3, H2SO4.
Решение
При определении степени окисления элемента в соединении исходят из предпосылок:
- молекула в целом электронейтральна;
- все связи в молекуле между разными по природе элементами – ионные;
- из двух соседствующих атомов отрицательный заряд приобретает тот, который более электроорицателен;
- степень окисления элементов в простых веществах равна нулю;
- атом водорода в соединениях имеет степень окисления +1, кроме гидридов, где водород имеет степень окисления -1;
- степень окисления кислорода в соединениях, кроме перекисных соединений и соединений с фтором, всегда равна -2;
- степень окисления фтора в соединениях равна -1;
- степень окисления щелочных металлов в соединениях равна +1;
- степень окисления щелочноземельных металлов в соединениях равна +2
Определим степень окисления серы в перечисленных соединениях.
(Н+12Sх)0
2(+1) + х = 0
х = -2.
(Na+12Sх2O-23)0
2(+1) + 2х + 3(-2) =0,
х= +2.
(H+12SхO-23)0
2(+1) + х + 3(-2) =0
х= +4.
(H+12SхO-24)0
2(+1) + х + 4(-2) =0,
х= +6.
Пример 2
Методами электронного баланса и полуреакций расставить коэффициенты в межмолекулярной окислительно-восстановительной реакции
FeSO4 + KMnO4 + H2SO4 " Fe2(SO4)3 + MnSO4+ K2SO4 + H2O
Решение
Определив степени окисления элементов в составе соединений, участвующих в ОВР, можно убедиться, что железо (II) окисляется до железа (Ш), а марганец (VII) восстанавливается до марганца (II).
Fe+2 – 1 е - " Fe+3, Mn+7 + 5 е - " Mn+2
Метод электронного баланса предусматривает уравнивание количества электронов в процессах окисления и восстановления. Так как в продуктах реакции имеем два атома железа, то это необходимо учесть в электронном балансе  .
.
2Fe+2 – 2 е - " 2Fe+3 ´ 5
 Mn+7 + 5 е - " Mn+2 ´ 2
Mn+7 + 5 е - " Mn+2 ´ 2
10Fe+2 + 2Mn+7 " 10Fe+3 + 2Mn+7
Перенеся соответствующие коэффициенты в уравнение реакции, получим:
10FeSO4 + 2KMnO4 + H2SO4 " 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + H2O
Коэффициент перед серной кислотой можно вычислить как разницу между количеством сульфат-анионов в продуктах и исходных веществах:
(3´5 + 2 + 1) – 10 = 8
10FeSO4 + 2KMnO4 + 8H2SO4 " 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + H2O
Коэффициент для воды, равный 8, получим, исходя из числа катионов водорода в серной кислоте.
Таким образом, можно написать окончательное уравнение окислительно-восстановительной реакции:
10FeSO4 + 2KMnO4 + 8H2SO4 " 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + 8H2O
Теперь применим к указанной реакции метод полуреакций, он еще называется методом электронно-ионного баланса.
Для составления уравнений окислительно-восстановительных реакций, протекающих в водных растворах, предпочтительно использовать именно этот метод. В нем рассматриваются частицы, реально существующие в растворе, видна роль среды, не обязательно знать все образующиеся вещества, недостающие продукты реакции сами появляются при выводе уравнения реакции.
При составлении уравнений окислительно-востановительных реакций методом электронно-ионного баланса рекомендуется придерживаться определенного алгоритма.
- На основании знания свойств веществ, вступающих в реакцию, определяются окислитель, восстановитель и продукты их превращения.
- Составляются схемы полуреакций окисления и восстановления, в которых указываются реально существующие в растворе частицы.
- Уравнивается число атомов элементов в схемах полуреакций. При необходимости для этого используются частицы, существующие в водных растворах: Н2О, Н+, ОН –.
Необходимо учитывать, что в кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов.
Присоединение недостающего кислорода в кислых и нейтральных средах происходит за счет молекул воды и приводит к образованию ионов водорода, в то время как в щелочной среде присоединение кислорода идет за счет гидроксид-ионов с образованием молекул воды.
- Учитывается правило электронейтральности: сумма зарядов в левой и правой части полуреакции должна быть одинакова. Для этого нужно прибавить или отнять от левой части полуреакции соответствующее число электронов. Оно определяется как разность между суммарными зарядами в левой и правой части полуреакции.
- Уравнивается число электронов, отданных восстановителем и принятых окислителем. Для этого вводятся соответствующие коэффициенты для полуреакций.
- Складываются левые и правые части полуреакций.
Таким образом, получают ионно-молекулярное уравнение окислительно-восстановительной реакции.
- Записывается уравнение реакции в молекулярной форме. При этом учитываются частицы, не принимавшие участия в окислительно-восстановительном процессе, но присутствующие в растворе.
 2Fe2+ – 2е- " 2Fe3+ ´ 5
2Fe2+ – 2е- " 2Fe3+ ´ 5
(MnO4)– + 8Н+ + 5е- " Mn2+ + 4 H2O ´ 2
 10Fe2+ + 2(MnO4)– + 16 Н + " 10Fe3+ + 5 Mn2+ + 8H2O
10Fe2+ + 2(MnO4)– + 16 Н + " 10Fe3+ + 5 Mn2+ + 8H2O
10FeSO4 + 2KMnO4 + 8H2SO4 " 5Fe2(SO4)3 + 2MnSO4+ K2SO4 + 8H2O
Пример 3
Закончите реакцию и расставьте коэффициенты методом электронного баланса.
Na2 S O3 + KMnO4 + KOH " Na2 S O4 + …
Решение
В данной реакции Na2AsO3 является восстановителем, так как
S +4 -2е- " S +6,
тогда KMnO4 – окислитель.
Известно, что в зависимости от рН среды Mn+7 может восстанавливаться
по-разному, а именно:

 рН >7 (MnO4)2–
рН >7 (MnO4)2–

 Mn+7 рН=7 MnO2
Mn+7 рН=7 MnO2
 рН< 7 Mn2+
рН< 7 Mn2+
Так как в нашем случае реакция протекает в присутствии щелочи, то есть рН>7, то продуктами реакции будут К2MnO4 и вода.
Na2SO3 + KMnO4 + KOH " Na2SO4 + К 2 MnO4 + H2O
Расставим коэффициенты методом электронного баланса:
 Mn+7 + 1 е - " Mn+6 ´ 2
Mn+7 + 1 е - " Mn+6 ´ 2
S+4 - 2 е - " S+6 ´ 1
Na2SO3 + 2KMnO4 + 2KOH " Na2SO4 + 2 К 2 MnO4 + H2O
Пример 4
Стандартные электродные потенциалы олова и свинцы равны -0,14 В и
-0,13 В соответственно. Будет ли олово вытеснять свинец из раствора его соли при 250С, если концентрация Sn 2+ в растворе равна 0,1 моль/л, а концентрация Pb 2+ составляет 0,001 моль/л?
Решение
Так как стандартные электродные потенциалы олова и свинца близки по величине, то для ответа на вопрос задачи необходимо рассчитать электродные потенциалы систем Pb 2+ + 2 e - = Pb и Sn 2+ + 2 e - = Sn в условиях, отличных от стандартных. Для этого воспользуемся уравнением Нернста:
 .
.
j Sn = -0,14 + 0,059 : 2 ×lg0,1 = -0,17 В;
j Pb = -0,13 + 0,059 : 2 ×lg0,001 = -0,22 В.
Так как потенциал олова в данных условиях больше потенциала свинца, то олово не может выступать в качестве восстановителя, оно не будет вытеснять свинец из раствора его соли.
Пример 5
Гальванический элемент составлен из свинцовых пластинок, контактирующих с растворами нитрата свинца (II) различных концентраций:
10–1 моль/л и 10–4 моль/л. Принимается, что степень электролитической диссоциации нитрата свинца равна 100%, температура 298 К. Определите потенциалы электродов. Какой из них является катодом, какой – анодом? Запишите схему гальванического элемента, вычислите его ЭДС, запишите уравнеиия полуреакций на катоде и на аноде.
Решение
Определить потенциалы электродов в условиях, отличных от стандартных, можно в соответствии с уравнением Нернста: 
 .
.
Стандартный электродный потенциал свинца 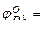 0,126 В; n=2, так как в процессе Pb 2+ + 2е- = Pb участвуют два электрона.
0,126 В; n=2, так как в процессе Pb 2+ + 2е- = Pb участвуют два электрона.
Вычислим потенциал первого электрода, погруженного в раствор нитрата свинца концентрацией 10 –1моль/л. Так как диссоциация соли считается полной, то концентрация нитрата свинца равна концентрации катионов свинца в растворе, и тогда
 .
.
Вычислим потенциал второго электрода, погруженного в раствор нитрата свинца концентрацией 10 –4моль/л:
 .
.
В гальваническом элементе катодом является электрод с большим значением электродного потенциала, а анодом – с меньшим значением. Следовательно, та свинцовая пластинка, которая погружена в 0,1 М раствор нитрата свинца, является катодом, а та, которая находится в 0,0001 М растворе – анодом.
Схема гальванического элемента:
(-) Pb/Pb 2+(0,0001 М)//Pb 2+(0,1 М)/Pb (+).
В схеме одинарной чертой показана граница раздела между проводниками первого и второго рода (металл – раствор электролита), а двойной чертой – граница между проводниками второго рода (растворы электролита различной концентрации).
ЭДС гальванического элемента вычисляется как разность потенциалов катода и анода:
ЭДС= j 1 – j 2 =-0,156 – (-0,244)=0,088 (В).
Анодный процесс (окисление): Pb – 2 e - = Pb 2+ .
Катодный процесс (восстановление): Pb 2+ + 2 e - = Pb .
Варианты заданий
Варианты заданий расчетно-графической работы представлены в
таблице 3.1. Условия задач приводятся после таблицы. Задачи сгруппированы по десяти разделам:
- Основные понятия и стехиометрические законы химии (1 – 30)
- Основные классы неорганических соединений (31 – 57)
- Химическая кинетика и равновесие (58 – 87)
- Способы выражения состава растворов. Коллигативные свойства растворов (88 – 107)
- Электролитическая диссоциация, ионное произведение воды, произведение растворимости (108 – 140)
- Буферные растворы (141 – 160)
- Гидролиз солей (161 – 178)
- Жесткость воды (179 – 191)
- Коллоидно-дисперсные системы (192 – 216)
- Окислительно-восстановительные реакции и электрохимические системы (217 – 249)
Таблица 3.1 – Варианты заданий
| Вариант | Номера заданий |
| 1 | 1; 31; 58; 88; 108; 141; 161; 179; 215; 235 |
| 2 | 2; 32; 59; 89; 140; 142; 162; 180; 214; 249 |
| 3 | 3; 33; 60; 90; 139; 143; 163; 181; 213; 248 |
| 4 | 4; 34; 61; 91; 138; 144; 164; 182; 212; 347 |
| 5 | 5; 35; 62; 92; 137; 145; 165; 183; 211; 246 |
| 6 | 6; 36; 63; 93; 136; 146; 166; 184; 210; 245 |
| 7 | 7; 37; 64; 94; 135; 147; 167; 185; 209; 244 |
| 8 | 8; 38; 65; 95; 134; 148; 168; 186; 208; 243 |
| 9 | 9; 39; 66; 96; 133; 149; 169; 187; 207; 242 |
| 10 | 10; 40; 67; 97; 132; 150; 170; 188; 206; 241 |
| 11 | 11; 41; 68; 98; 131; 151; 171; 189; 205; 240 |
| 12 | 12; 42; 69; 99; 130; 152; 172; 190; 204; 239 |
| 13 | 13; 43; 70; 100; 129; 153; 173; 191; 203; 238 |
| 14 | 14; 44; 71; 101; 128; 154; 174; 179; 202; 237 |
| 15 | 15; 45; 72; 102; 127; 155; 175; 180; 201; 236 |
| 16 | 16; 46; 73; 103; 126; 156; 176; 181; 200; 235 |
| 17 | 17; 47; 74; 104; 125; 157; 177; 182; 199; 234 |
| 18 | 18; 48; 75; 105; 124; 158; 178; 183; 198; 233 |
| 19 | 19; 49; 76; 106; 123; 159; 161; 184; 197; 232 |
| 20 | 20; 50; 77; 107; 122; 160; 162; 185; 196; 231 |
| 21 | 21; 51; 78; 88; 121; 141; 163; 186; 195; 230 |
| 22 | 22; 52; 79; 89; 120; 142; 164; 187; 194; 229 |
| 23 | 23; 53; 80; 90; 119; 143; 165; 188; 193; 228 |
| 24 | 24; 54; 81; 91; 118; 144; 166; 189; 192; 227 |
| 25 | 25; 55; 82; 92; 117; 145; 167; 190; 216; 226 |
| 26 | 26; 56; 83; 93; 116; 146; 168; 191; 215; 225 |
| 27 | 27; 57; 84; 94; 115; 147; 169; 179; 214; 224 |
| 28 | 28; 31; 85; 95; 114; 148; 170; 180; 213; 223 |
| 29 | 29; 32; 86; 96; 113; 149; 171; 181; 212; 222 |
| 30 | 30; 33; 87; 97; 112; 150; 172; 182; 211; 221 |
| 31 | 1; 34; 58; 98; 111; 151; 173; 183; 210; 220 |
| 32 | 2; 35; 59; 99; 110; 152; 174; 184; 209; 219 |
| 33 | 3; 36; 60; 100; 109; 153; 175; 185; 208; 218 |
| 34 | 4; 37; 61; 101; 108; 154; 176; 186; 207; 217 |
| 35 | 6; 38; 62; 102; 140; 155; 177; 187; 206; 249 |
| 36 | 7; 39; 63; 103; 139; 156; 178; 188; 205; 248 |
| 37 | 8; 40; 64; 104; 138; 157; 161; 189; 204; 247 |
| 38 | 9; 41; 65; 105; 137; 158; 162; 190; 203; 246 |
| 39 | 10; 42; 66; 106; 136; 159; 163; 191; 202; 245 |
| 40 | 11; 43; 67; 107; 135; 160; 164; 179; 201; 244 |
| 41 | 12; 44; 68; 88; 134; 141; 165; 180; 200; 243 |
| 42 | 13; 45; 69; 89; 133; 142; 166; 181; 199; 242 |
| 43 | 14; 46; 70; 90; 132; 143; 167; 182; 198; 241 |
| 44 | 15; 47; 71; 91; 131; 144; 168; 183; 197; 240 |
| 45 | 16; 48; 72; 92; 130; 145; 169; 184; 196; 239 |
| 46 | 17; 49; 73; 93; 129; 146; 170; 185; 195; 238 |
| 47 | 18; 50; 74; 94; 128; 147; 171; 186; 194; 237 |
| 48 | 19; 52; 75; 95; 127; 148; 172; 187; 193; 236 |
| 49 | 20; 53; 76; 96; 126; 149; 173; 188; 192; 235 |
| 50 | 21; 54; 77; 97; 125; 150; 174; 189; 216; 234 |
| 51 | 22; 55; 78; 98; 124; 151; 175; 190; 215; 233 |
| 52 | 23; 56; 79; 99; 123; 152; 176; 191; 214; 232 |
| 53 | 24; 57; 80; 100; 122; 153; 177; 179; 213; 231 |
| 54 | 25; 31; 81; 101; 121; 154; 178; 180; 212; 230 |
| 55 | 26; 32; 82; 102; 120; 155; 161; 181; 211; 229 |
| 56 | 27; 33; 83; 103; 119; 156; 162; 182; 210; 228 |
| 57 | 28; 34; 84; 104; 118; 157; 163; 183; 209; 227 |
| 58 | 29; 35; 85; 105; 117; 158; 164; 184; 208; 226 |
| 59 | 30; 36; 86; 106; 116; 159; 165; 185; 207; 225 |
| 60 | 1; 37; 87; 107; 115; 160; 166; 186; 206; 224 |
| 61 | 2; 38; 58; 88; 114; 141; 167; 187; 205; 223 |
| 62 | 3; 39; 59; 89; 113; 142; 168; 188; 204; 222 |
| 63 | 4; 40; 60; 90; 112; 143; 169; 189; 203; 221 |
| 64 | 5; 41; 61; 91; 111; 144; 170; 190; 202; 220 |
| 65 | 6; 42; 62; 92; 110; 145; 171; 191; 201; 219 |
| 66 | 7; 43; 63; 93; 109; 146; 172; 179; 200; 218 |
| 67 | 8; 44; 64; 94; 108; 147; 173; 180; 199; 217 |
| 68 | 9; 45; 65; 95; 140; 148; 174; 181; 198; 249 |
| 69 | 10; 46; 66; 96; 139; 149; 175; 182; 197; 248 |
| 70 | 11; 47; 67; 97; 138; 150; 176; 183; 196; 247 |
| 71 | 12; 48; 68; 98; 137; 151; 177; 184; 195; 246 |
| 72 | 13; 49; 69; 99; 136; 152; 178; 185; 194; 245 |
| 73 | 14; 50; 70; 100; 135; 153; 161; 186; 193; 244 |
| 74 | 15; 51; 71; 88; 134; 154; 162; 187; 192; 243 |
| 75 | 16; 52; 72; 89; 133; 155; 163; 188; 216; 242 |
| 76 | 17; 53; 73; 90; 132; 156; 164; 189; 215; 241 |
| 77 | 18; 54; 74; 91; 131; 157; 165; 190; 214; 240 |
| 78 | 19; 55; 75; 92; 130; 158; 166; 191; 213; 239 |
| 79 | 20; 56; 76; 93; 129; 159; 167; 179; 212; 238 |
| 80 | 21; 57; 77; 94; 128; 160; 168; 180; 211; 237 |
| 81 | 22; 51; 78; 95; 127; 141; 169; 181; 210; 236 |
| 82 | 23; 31; 79; 96; 126; 142; 170; 182; 209; 235 |
| 83 | 24; 32; 80; 97; 125; 143; 171; 183; 208; 234 |
| 84 | 25; 33; 81; 98; 124; 144; 172; 184; 207; 233 |
| 85 | 26; 34; 82; 99; 123; 145; 173; 185; 206; 232 |
| 86 | 27; 35; 83; 100; 122; 146; 174; 186; 205; 231 |
| 87 | 28; 36; 84; 101; 121; 147; 175; 187; 204; 230 |
| 88 | 29; 37; 85; 102; 120; 148; 176; 188; 203; 229 |
| 89 | 30; 38; 86; 103; 119; 149; 177; 189; 202; 228 |
| 90 | 1; 39; 87; 104; 118; 150; 178; 190; 201; 227 |
| 91 | 2; 40; 58; 105; 117; 151; 161; 191; 200; 226 |
| 92 | 3; 41; 59; 106; 116; 152; 162; 179; 199; 225 |
| 93 | 4; 42; 60; 107; 115; 153; 163; 180; 198; 224 |
| 94 | 5; 43; 61; 101; 114; 154; 164; 181; 197; 223 |
| 95 | 6; 44; 62; 102; 113; 155; 165; 182; 196; 222 |
| 96 | 7; 45; 63; 103; 112; 156; 166; 183; 195; 221 |
| 97 | 8; 46; 64; 104; 111; 157; 167; 184; 194; 220 |
| 98 | 9; 47; 65; 105; 110; 158; 168; 185; 193; 219 |
| 99 | 10; 48; 66; 106; 109; 159; 169; 186; 192; 218 |
| 100 | 11; 49; 67; 107; 108; 160; 170; 187; 201; 217 |
Дата добавления: 2019-02-13; просмотров: 202; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
