ОРГАНИЧЕСКИЕ КИСЛОТЫ И ОСНОВАНИЯ
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
РЕАКЦИИ ОКИСЛЕНИЯ
КОНЦЕПЦИИ КИСЛОТНОСТИ И ОСНОВНОСТИ
Теория Бренстеда-Лоури. Кислоты представляют собой вещества, способные в растворах отдавать протон, а основания — вещества, способные присоединять протон. Эта теория получила название протолитической, так как кислотность и основность связывают со способностью отдавать или присоединять протон.
В общем виде кислотно-основное взаимодействие можно описать уравнением:

Кислотность по Бренстеду. Большинство органических соединений можно рассматривать как кислоты, поскольку в них содержатся поляризованные связи атома водорода с различными элементами (О, N, S, С).
Органические кислоты классифицируют по природе кислотного центра:
- ОН-кислоты: спирты, фенолы, карбоновые кислоты, сульфокислоты, гидроксикислоты, аминокислоты;
- SH-кислоты: тиоспирты, SH-содержащие аминокислоты и др. соединения;
- NH-кислоты: амины, имины, гетероциклические соединения с атомом азота;
- СН-кислоты: углеводороды, радикалы гетерофункциональных соединений.
Кислотами могут быть не только нейтральные молекулы, но и положительно заряженные ионы, а также диполярные ионы.
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА КИСЛОТНЫХ СВОЙСТВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Органические кислоты — слабые электролиты, и процесс диссоциации идет до установления обратимого равновесия, которое характеризуется константой диссоциации (К). Например, диссоциация уксусной кислоты:
|
|
|

 ;
; 
Ка – константа кислотности. Для количественной характеристики кислотных свойств используется величина
pKa = - lg Ka.
Чем меньше рКа, тем больше кислотность по Бренстеду.
Качественной характеристикой кислотных свойств может служить стабильность образующегося аниона. Сила кислоты определяется стабильностью аниона, образующегося из этой кислоты: чем стабильнее анион, тем сильнее кислота. Стабильность аниона, в свою очередь, определяется характером распределения отрицательного заряда аниона и зависит от ряда факторов:
1) природы атома в кислотном центре (электроотрицательности и поляризуемости элемента);
2) характера связанного с кислотным центром органического радикала (электроноакцепторного или электронодонорного);
3) сольватационных эффектов.
Электроотрицательность имеет значение, когда сравнивается кислотность соединений, имеющих одинаковые радикалы и элементы кислотного центра, относящиеся к одному и тому же периоду периодической системы Д.И. Менделеева (т.е. когда практически не изменяется поляризуемость):
|
|
|
| С—Н кислота | N—H кислота | О—Н кислота | S—H кислота | О—Н кислоты | |
| С2Н5СH2—Н пропан | С2Н5NH—H этиламин | С2Н5О—Н этанол | С2Н5S—H этантиол | С6Н5О—Н фенол | СН3СОО—Н уксусная кислота |
| рКа = 50 | рКа = 30 | рКа = 18 | рКа = 12 | рКа = 10 | рКа = 4,7 |
Чем более электроотрицательным является элемент в кислотном центре, тем он более способен нести отрицательный заряд, и тем стабильнее образующийся анион, и соответственно, сильнее кислота.
Поляризуемость атома характеризует меру смещения (рассредоточения) валентных электронов под действием внешнего электрического поля. Чем больше электронов в атоме и чем дальше они расположены от ядра, тем больше его поляризуемость. В пределах группы таблицы элементов Менделеева стабильность анионов возрастает с увеличением атомного номера элемента, так как увеличивается объем электронных орбиталей, и создается лучшая возможность для делокализации отрицательного заряда. Поэтому SH-кислоты являются более сильными кислотами, чем ОН-кислоты.
Тиолы, как более сильные кислоты, в отличие от спиртов, реагируют не только со щелочными металлами, но и со щелочами, а также оксидами и солями тяжелых металлов (ртуть, свинец, мышьяк, хром, висмут и др.):
|
|
|


Меркаптиды ртути, серебра нерастворимы в воде, поэтому эта реакция лежит в основе амперометрического определения тиолов в биологических жидкостях. Тиолы, в частности, 2,3-димеркаптопропанол,

используются в качестве антидотов при отравлении солями тяжелых металлов, люизитом.
Итак, при одинаковых радикалах кислотность уменьшается в ряду:
S Н-кислота > O Н-кислота > N Н-кислота > СН-кислота
Характер связанного с кислотным центром органического радикала является определяющим фактором при оценке кислотности соединений, имеющих одинаковый кислотный центр. При этом главную роль играют электронные эффекты заместителей и образование системы сопряженных связей. Сравним кислотность этанола и фенола:


Этоксид-анион неустойчив, так как содержит электронодонорную этильную группу. В феноксид-анионе отрицательный заряд делокализуется по сопряженной системе p-связей ароматического кольца, что стабилизирует анион и увеличивает кислотные свойства фенола по сравнению с этанолом.
Высокая кислотность карбоновых кислот обусловлена образованием в карбоксилат-анионе резонансной р-p сопряженной системы, где отрицательный заряд распределяется поровну между атомами кислорода:
|
|
|

Электроноакцепторные заместители способствуют делокализации отрицательного заряда, стабилизируют анион и увеличивают кислотность. Так, введение ОН группы в молекулу пропановой кислоты (рКа =4,9) приводит к увеличению кислотности на порядок:

Электронодонорные заместители, наоборот, препятствуют делокализации отрицательного заряда и понижают кислотность.
Растворители оказывают существенное влияние на стабилизацию аниона (эффект сольватации). Как правило, лучше гидратируются небольшие по размеру ионы с низкой степенью делокализации заряда. Например, в ряду карбоновых кислот с увеличением длины алифатического (гидрофобного) радикала кислотность уменьшается.
| НСООН муравьиная | СН3СООН уксусная | СН3 -СН2 -СООН пропановая | С15Н31 -СООН пальмитиновая | |
| рКа | 3.7 | 4,7 | 4,9 |
Кислотные свойства могут проявлять не только молекулы, но и положительно заряженные ионы: алкилоксониевый ион — R O+H2 (OH-кислота), алкиламмониевый ион — RN+H3 (NH-кислота), s-комплекс —

При диссоциации таких кислот образуются нейтральные молекулы.


ОСНОВНОСТЬ ПО БРЕНСТЕДУ
Органические основания, чтобы присоединить протон должны иметь либо неподеленную пару электронов у гетероатома — n-основания (аммониевые, оксониевые, тиониевые), либо быть анионами:
| n-основания: | анионы |
| R—ОН — спирты | НО- — гидроксид-ион |
| R—O—R — простые эфиры | RO- — алкоксид-ион |
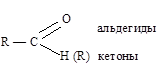
| RS- — алкил-тиолят-ион |

| H2N- — амид-ион |
| R — SH — тиолы | RCOO- — ацилат-ион |
| R — NH2 — амины | Н- — гидрид ион |
Существует еще одна группа оснований — p-основания, где центром основности являются электроны p-связи или ароматической системы. Это слабые основания, которые с протоном образуют не ковалентные связи, а короткоживущие p-комплексы:
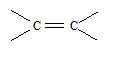
| 
|
| p-основания | |
Реакция основания В: с водой описывается уравнением:

Поскольку органические основания, как и кислоты, слабые электролиты, то константа равновесия этой реакции будет равна:

и соответственно, константа основности:

Так как органическая кислота отщепляет протоны, а основание их присоединяет, то их силу можно количественно характеризовать одной величиной - сродством к иону водорода. Это позволяет применять константы кислотной ионизации как для кислот, так и для оснований:
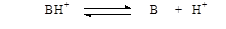

Как и для кислот пользуются значениями рКв = - lg К в. Зная величину рКв, можно перейти к значениям рКвн+ : для этого из отрицательного логарифма ионного произведения воды (рКн2о) при данной температуре надо вычесть значение рКв. Чем сильнее основание, тем выше его рКвн+.
Значение рКвн+ некоторых оснований
| Гидроксид натрия | > 14 |
| Этиламин | 11 |
| Аммиак | 9 |
| Хинин | 8 |
| Анилин, пиридин | 5 |
| п-Нитроанилин | 1 |
Качественно выраженность основных свойств зависит от тех же факторов, что и кислотных, но влияние их противоположно.
В пределах одного и того же периода таблицы Менделеева, чем больше электроотрицательность элемента основного центра, тем прочнее он удерживает неподеленную пару электронов, и тем менее она доступна для протона. Поэтому, если сравнивать основность соединений с одинаковыми радикалами,

В тиониевых основаниях, например,СН3 - S - СН3 электронная плотность атома серы рассредоточена в большем объеме (поляризуемость атома серы больше, чем кислорода), и плотность заряда значительно меньше. Поэтому тиониевые основания слабее оксониевых и не способны образовывать прочные связи с протоном. В целом, сила n-оснований с одинаковыми радикалами уменьшается в ряду: N > O > S. Наибольшую основность среди органических соединений проявляют амины.
Электронодонорные заместители повышают основные свойства, так как увеличивают электронную плотность на атоме основного центра, а электроноакцепторные заместители понижают электронную плотность и выраженность основных свойств. Обсудим влияние этих заместителей на примере новокаина — сложного эфира n-аминобензойной кислоты и диэтиламиноэтанола, который применяется в хирургической практике для местной анестезии. Новокаин плохо растворим в воде, лучше растворимы его соли, например, новокаина гидрохлорид:

| 
|
В новокаине два наиболее выраженных основных центра: 1) атом азота, связанный с бензольным ядром, 2)атом азота, связанный с алифатическими радикалами. Неподеленная пара электронов атома азота в первом основном центре вступает в р,p-сопряжение с p-системой ароматического кольца, что приводит к уменьшению основных свойств. Алкильные радикалы, являясь электронодонорами, увеличивают электронную плотность на атоме азота второго основного центра и его основные свойства. Протон от кислоты присоединяется ко второму центру.
Во вторичных и третичных алифатических аминах с атомом азота связаны, соответственно, два и три алифатических радикала, обладающих электронодонорными свойствами. Поэтому можно было бы ожидать, что основность увеличивается в ряду:
NH3 < первичный < вторичный < третичный амин.
Есть, однако, еще один важный фактор, от которого зависит основность - сольватация алкиламмониевого иона молекулами воды:



Способность к образованию водородных связей с молекулами воды растет в ряду: третичный амин < вторичный амин < первичный амин < NH3.
Комбинация этих двух факторов приводит к следующему ряду основности аминов:
NH3 < третичный < первичный < вторичный амин
АМФОТЕРНЫЕ СВОЙСТВА СПИРТОВ
Наличие полярной связи между кислородом и водородом в группе -ОН обуславливает кислотные свойства спиртов, а неподеленные пары электронов на атоме кислорода — основные свойства.
Кислотные свойства убывают в ряду:
первичный спирт > вторичный спирт > третичный спирт.
Основные свойства в этом ряду, наоборот, возрастают, что обусловлено электронодонорными алифатическими радикалами.
Многоатомные спирты являются более сильными кислотами, чем одноатомные, что обусловлено -I эффектом групп ОН, стабилизацирующим анион:

Благодаря более выраженным кислотным свойствам многоатомные спирты реагируют с Сu (OH)2, образуя растворимые комплексные соединения - хелаты.

Наличие слабых кислотных и основных центров в одной и той же молекуле приводит к образованию водородных связей. В растворе спиртов молекулы связаны друг с другом межмолекулярными водородными связями.

Энергия водородной связи небольшая, примерно 10 - 30 кДж/ моль, но обычно их образуется много и действует кооперативный эффект. Образование водородных связей в спиртах приводит к повышению температуры кипения по сравнению с углеводородами.
Водородные связи играют важную роль в стабилизации пространственной структуры белков, двойной спирали ДНК.
Кислоты и основания Льюиса
Дж. Льюисом была предложена более общая теория кислот и оснований. Основания Льюиса – это доноры пары электронов (спирты, алкоголят-анионы, простые эфиры, амины и т.д.) Кислоты Льюиса – это акцепторы пары электронов, т.е. соединения, имеющие вакантную орбиталь (ион водорода и катионы металлов: H+, Ag+, Na+, Fe2+; галогениды элементов второго и третьего периодов BF3, AlCl3, FeCl3, ZnCl2; галогены; соединения олова и серы: SnCl4, SO3). Таким образом, основания Бренстеда и Льюиса – это одни и те же частицы. Однако основность по Бренстеду есть способность присоединять только протон, в то время как основность по Льюису – понятие более широкое и означает способность к взаимодействию с любой частицей, имеющей низколежащую свободную орбиталь.
Кислотно-основное взаимодействие по Льюису есть доноро-акцепторное взаимодействие и любую гетеролитическую реакцию можно представить как взаимодействие кислоты и основания Льюиса:

Единой шкалы для сравнения силы кислот и оснований Льюиса не существует, так как их относительная сила будет зависеть от того, какое вещество взято за стандарт (для кислот и оснований Бренстеда таким стандартом является вода). Для оценки легкости протекания кислотно-основного взаимодействия по Льюису Р. Пирсоном была предложена качественная теория “жестких” и “мягких” кислот и оснований.
АМФОТЕРНОСТЬ a-АМИНОКИСЛОТ, ЦВИТТЕР-ИОНЫ.
Кислотно-основные свойства аминокислот определяет одновременное присутствие в их структуре основной аминной и кислотной — карбоксильных групп, которые находятся у одного углеродного атома и максимально влияют друг на друга.
В водной среде a-аминокислоты существуют в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы:

Соотношение между этими формами в растворе зависит от рН среды. Однако следует отметить, что присутствие положительно заряженной аммонийной группы в a-положении делает a-карбоксильную группу значительно более сильной по сравнению с карбоксилом алифатических кислот. Так, если рКа уксусной кислоты составляет 4,7, то у большинства
a-аминокислот от 1,82 до 2,36. Точно также a-аминогруппа в a-аминокислотах испытывает влияние карбоксилат-аниона и становится менее основной, чем аминогруппа первичных алифатических аминов — ее рКа равна 9,6-9,7 в отличие от 10,7 для этиламина.
Согласно более общей электронной теории Льюиса, кислота — акцептор пары электронов; основание — донор пары электронов. Важным следствием теории Льюиса является то, что любое органическое соединение можно представить как кислотно-основной комплекс.
ОРГАНИЧЕСКИЕ КИСЛОТЫ И ОСНОВАНИЯ
План
- Протонная теория кислот и оснований Бренстеда.
- Классификация кислот и оснований по Бренстеду.
- Влияние структурных факторов на кислотность и основность.
- Кислоты и основания Льюиса. Теория жестких и мягких кислот и оснований.
В настоящее время существуют две основных теории кислот и оснований: теория Бренстеда и теория Льюиса.
Дата добавления: 2019-02-12; просмотров: 2459; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
