В реакции, протекающей в соответствии с термохимическим уравнением
ТЕСТЫ к МОДУЛЮ №1 (для итогового рубежного контроля)
ТЕРМОДИНАМИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
1) Известно, что для реакции 2CH4(г) + 2NH3(г)=2HCN(г) + 3H2O (ж) ΔH0=-345,2кДж и ΔG0=-325,9кДж. Следовательно, это реакция…
1) эндотермическая и при стандартных условиях протекает в прямом направлении
2) эндотермическая и при стандартных условиях протекает в обратном направлении
3) экзотермическая и при стандартных условиях протекает в обратном направлении
4) экзотермическая и при стандартных условиях протекает в прямом направлении
2) Для получения 1132 кДж тепла по реакции 2NO(г)+O2(г)↔2NO2(г), ∆Но= -566кДж необходимо затратить____ литр(ов) кислорода
1) 56 2) 11,2 3) 44,8 4) 22,4
3) Теплота, необходимая для испарения 18 г воды, если DfH0 образования жидкой воды (-285,3 кДж/моль), DfH0 образования газообразной воды (-241,8 кДж/моль) равна…
1) 43,5 кДж 2) 527,1 кДж 3) -43,5 кДж 4) 174 кДж
4) Для нахождения  реакции
реакции  , следует воспользоваться формулой…
, следует воспользоваться формулой…
1) 
2) 
3) 
4) 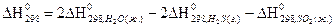
5) Для нахождения  реакции
реакции  , следует воспользоваться формулой …
, следует воспользоваться формулой …
1) 
2) 
3) 
4) 
6) Если энтальпия образования SO2 равна -297 кДж/моль, то количество теплоты, выделяемое при сгорании 16г серы, равно . . . кДж
1) 148,5 2) 297 3) 594 4) 74,25
В реакции, протекающей в соответствии с термохимическим уравнением
3 H2 + N2 = 2 NH3 + 92 кДж
Выделилось 23 кДж теплоты. Объём полученного (при н.у.) аммиака составляет
|
|
|
1) 5,6 л 2) 11,2л 3) 22,4л 4) 44,8л
8) По термохимическому уравнению реакции С2Н4 + Н2О ↔ С2Н5ОН +46 кДж вычислите объём взятого этилена (н,у.), если известно, что выделившаяся в этом процессе теплота составила 138 кДж.
1) 44,8 л 2) 22,4л 3) 67,2л 4) 89,6л
9) В реакцию, протекающую в соответствии с термохимическим уравнением2 Al + 3 S = Al2 S3 +509 кДж вступило 108 г алюминия. Количество выделившейся теплоты равно
1) 242,5 кДж 2) 509 кДж 3) 1018 кДж 4) 2036 кДж
10. В результате реакции, термохимическое уравнение которой 2 Al + Fe2 O3 = Al2 O3 + 2 Fe +848 кДж, выделилось 169,6 кДж теплоты. Масса образовавшегося железа равна:
1) 11,2 г 2) 22,4 г 3) 56 г 4) 28 г
11) По термохимическому уравнению реакции горения ацетилена 2С2Н4 + 5О2 = 4СО2 + 2Н2О +2610 кДж рассчитайте, сколько выделится теплоты, если в реакцию вступило 67, 2 л ацетилена (н.у.)
1) 870 кДж 2) 3915 кДж 3) 5220 кДж 4) 7830 кДж
В результате реакции, описываемой термохимическим уравнением
2С2Н4+ 5О2 = 4СО2 + 2Н2О +2610 кДж выделилось 652, 5 кДж теплоты. Оцените объём сгоревшего ацетилена
|
|
|
1) 11,2 л 2) 22,4 л 3) 44,8 л 4) 67,2 л
13. Согласно термохимическому уравнению реакции СН4 + 2О2 = СО2 + 2Н2О + 802 кДж количество теплоты, выделившейся при сжигании 24 г метана, равно
1) 1604 кДж 2) 1203 кДж 3) 601,5 кДж 4) 401 кДж
14. В результате реакции, термохимическое уравнение которой 4 NH3 + 5 O2 = 4 NO + 6 H2 O + 902 кДж, выделилось 1127,5 кДж теплоты. Объём (н.у.) образовавшегося при этом оксида азота ( II) равен
1) 112л 2) 11,2 л 3) 89,6 л 4) 896 л
В результате реакции, термохимическое уравнение которой
2 KClO 3 = 2 KCl + 3 O2 +91 кДж выделилось 182 кДж теплоты. Масса образовавшегося при этом кислотрода равна
1) 96 г 2) 192 г 3) 288 г 4) 576 г
16. В соответствии с термохимическим уравнением C6 H12 O6 + 6 O2 ↔ 6 CO2 + 6 H2 O + 2800кДж при образовании 12 моль углекислого газа
1) выделяется 2800 кДж теплоты
2) поглощается 2800 кДж теплоты
3) выделяется 5600 кДж теплоты
4) поглощается 5600 кДж теплоты
17. В соответствии с термохимическим уравнением 2 Na + Cl 2 = 2 NaCl + 411,3 кДж при окислении 4 моль натрия в избытке хлора
1) выделяется 411,3 кДж 2) поглощается 411,3 кДж
3) выделяется 822,6 кДж 4) поглощается 822,6 кДж
|
|
|
18. Согласно термохимическому уравнению ZnS + 2 HCl ↔ ZnCl 2 + H2 S +139,3 кДж при образовании 0,5 моль ZnS в реакции
1) выделяется 69,65 кДж теплоты 2) поглощается 69,65 кДж теплоты
3) выделяется 139,3 кДж теплоты 4) поглощается 139,3 кДж теплоты
19. В соответствии с термохимическим уравнением реакции 2С H3 OH +3 O2 = 2 CO2 +4 H2 O +1452 кДж при сгорании 8г метанола выделится ….. кДж теплоты
1) 181,5 2) 363 3) 726 4) 1452
20. В соответствии с термохимическим уравнением реакции С2 H5 OH +3 O2 = 2 CO2 +3 H2 O + 1370 кДж для получения 685 кДж теплоты требуется сжечь . . . г этанола
1) 23 2) 46 3) 92 4) 184
21. В результате реакции, термохимическое уравнение которой 2М g + O2 = 2 MgO +600 кДж выделилось 150 кДж теплоты. Масса сгоревшего магния составляет
1) 6 г 2) 12 г 3) 24 г 4) 48 г
22. При образовании аммиака согласно уравнению реакции N2 +3 H2 = 2 NH3 +92 кДж выделилось 230 кДж теплоты. При этом объём (н.у.) вступившего в реакцию водорода составил
1) 44,8 л 2) 56 л 3) 112 л 4) 168 л
В реакции, протекающей в соответствии с термохимическим уравнением
3 H2 + N2 = 2 NH3 + 92 кДж
|
|
|
Дата добавления: 2019-01-14; просмотров: 549; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
