Малюнок 41. Техніка інтраабдомінального введення препарату.
Дозування ретинолу ацетату визначають з поправками на рівень забезпеченості раціону каротином та ступінь депонування вітаміну А в печінці за розробленою нами формулою. В основі розрахунків лежать існуючі норми споживання вітаміну А для корів (табл. 11).
Таблиця 11
Норми споживання вітаміну А для корів
| Тварини | Потреба однієї тварини в вітаміні А (і.о.) на добу |
| Корови з надоєм 10 кг 20 кг | 40000-50000 70000 |
| Сухостійні корови | 40000 |
Формула розрахунку
Х = 5 · (А - 200·К), де
Х – доза ретинолу (і.о.) на добу;
А – добова норма вітаміну А (і.о.);
К – вміст каротину в раціоні (мг).
Множник 200 – еквівалент перерахунку (з 1 мг каротину утворюється 200 і.о. вітаміну А).
Множник 5 – ступінь депонування (після інтраабдомінального введення 20 % вітаміну А депонується в печінці корів).
Приклад 1. Для господарства з відсутнім вмістом каротину (К=0) в раціоні для корів доза розраховується таким чином:
Х = 5 · (А – 200·К) = 5(40000-200·0) = 200000 і.о.
А = 40000 – це норма вітаміну А для сухостійних корів на добу.
Приклад 2. В господарстві з 50 % вмістом каротину в раціоні для корів доза розраховується:
Х = 5 · (А – 200·К) = 5(40000-200·100) = 100000 і.о.
100 – 100 мг каротину в раціоні адекватно 50 % добової потреби.
Обробляють тварин в січні – квітні. Для чого формують початкову групу тварин, а потім від першої по дев’яту допоміжні. Обробку проводять за наведеною нижче схемою (табл. 12).
|
|
|
Пізня антенатальна патологія.
Внутрішньоутробна гіпотрофія. Діагностика. Дуже велике значення має своєчасна оцінка стану плода під час вагітності корів. Як уже повідомлялось низький рівень гормонів (головним чином естрогенів) призводить до різних порушень розвитку плода, в тому числі, до гіпотрофії.
Таблиця 12
Схема обробки корів і нетелів в ранньому антенатальному періоді
| Місяць року | Половина | Термін вагітності, | |||||||||||||||
| в місяцях | |||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |||||||||||
| в днях | |||||||||||||||||
| 15 | 30 | 45 | 60 | 75 | 90 | 105 | 120 | 135 | 150 | 165 | 180 | 195 | 210 | ||||
| Січень | I |  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
| Обробка тварин іншими препаратами | |
| II |  1ДСГ 1ДСГ
| ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ |  ПСГ ПСГ
| |||
| Лютий | I |  2ДСГ 2ДСГ
| 1ДСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ |  ПСГ ПСГ
| ||
| II |  3ДСГ 3ДСГ
| 2ДСГ | 1ДСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ |  ПСГ ПСГ
| |||
| Березень | I |  4ДСГ 4ДСГ
| 3ДСГ | 2ДСГ | 1ДСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ |  ПСГ ПСГ
| ||
| II |  5ДСГ 5ДСГ
| 4ДСГ | 3ДСГ | 2ДСГ | 1ДСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ |  ПСГ ПСГ
| |||
| Квітень
| I |  6ДСГ 6ДСГ
| 5ДСГ | 4ДСГ | 3ДСГ | 2ДСГ | 1ДСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ |  ПСГ ПСГ
| ||
| II |  7ДСГ 7ДСГ
| 6ДСГ | 5ДСГ | 4ДСГ | 3ДСГ | 2ДСГ | 1ДСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ |  ПСГ ПСГ
| |||
| Травень | I |  8ДСГ 8ДСГ
| 7ДСГ | 6ДСГ | 5ДСГ | 4ДСГ | 3ДСГ | 2ДСГ | 1ДСГ | ПСГ | ПСГ | ПСГ | ПСГ | ПСГ |  ПСГ ПСГ
| ||
| II |  9ДСГ 9ДСГ
|  8ДСГ 8ДСГ
|  7ДСГ 7ДСГ
|  6ДСГ 6ДСГ
|  5ДСГ 5ДСГ
|  4ДСГ 4ДСГ
|  3ДСГ 3ДСГ
|  2ДСГ 2ДСГ
|  1ДСГ 1ДСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|  ПСГ ПСГ
|   ПСГ ПСГ
| |||
|
|
| ||||||||||||||||
| Обробки тварин закінчені | |||||||||||||||||
Примітка - ПСГ (початково сформована група)
- ДСГ (від 1 до 9 допоміжно сформована група)
Тому гормональні тести повинні зайняти важливе місце в діагностиці порушень розвитку плода бо вони виявляють механізми порушень функції фето-плацентарного комплексу і його взаємовідношень з організмом матері.
Методи визначення гормонів в сечі, крові дуже складні, працемісткі і тому не можуть знайти широкого застосування в практиці ветеринарної медицини (Нежданов А.Г., 1987).
В цьому зв’язку закономірні пошуки більш простих, дешевших методів досліджень, які б могли визначити стан фето-плацентарного комплексу і своєчасно сигналізувати про порушення розвитку внутрішньоутробного плода. Природнім є припущення про те, що таким методом може бути дослідження клітинного складу вагінального мазка вагітних (колпоцітоскопія). Основою для такого припущення були роботи, в яких показаний зв’язок між секрецією і екскрецією гормонів і цитологічною картиною вагінального мазка у невагітних тварин.
|
|
|
Проби для колпоцітоскопії отримують на 8 – 9 місяцях вагітності за допомогою стерильного шпателя (металевої пластини, шириною 0,5 см з мілкою нарізкою) з бокової стінки передвер`я вагіни. Тонкі мазки наносять на чисті предметні скельця. Після висушування на повітрі мазки фіксують метанолом або в суміші етилового спирту з ефіром. На протязі 10-15 хвилин мазки фарбують гематоксиліном та 2-3 хвилини 1 % розчином еозину.
Мазки висушують, обезводнюють, просвітляють ксилолом і (якщо є необхідність готувати постійні препарати закріпляють просвітлені мазки полістиролом під накривними скельцями) вивчають під мікроскопом.
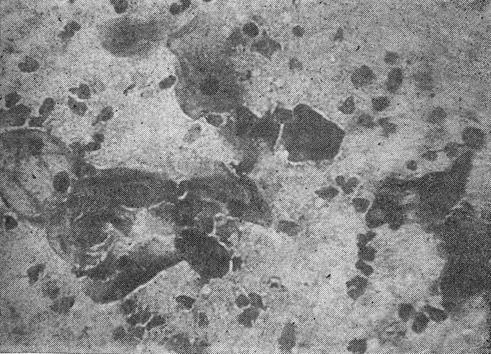
В мазках корів, що народили телят - гіпотрофіків встановлені явища цитолізу і дегенерації клітин. „Дегенеративний тип мазка” характеризується „розмитістю” контурів як ядер так і цитоплазми, руйнуванням клітин і виходом ядер, утворенням гомогенних пластів із клітин без чітких меж між ними. Дуже слабким, майже непомітним є фарбування цитоплазми. Все це свідчить про зниження рівня естрогенів. (мал. 42).
|
|
|
Дата добавления: 2018-11-24; просмотров: 402; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
