Теплоемкость идеального газа.
Теплоемкостью тела называют величину численно равную отношению количества теплоты. Сообщенное телу, к изменению его температуры Cтела=dQ/dT
Теплоемкость зависит от вещества, массы тела, от его термодинамического состояния, а так же от процесса изменения состояния тела. Различают молярную и удельную теп-сть. С=сμ-молярная теплоемкость, с-удельная теплоемкость. Сp при p=const, Cv при V=const dQ=dU+dA
Cv=(dQ/dT)v=dUμ/dT т.к. dA=pdV=0 Uμ=i/2RT Cv=i/2R
Cp=(dQ/dT)p=(dU+dA)/dT=Cv+dA/dT=Cv+pdV/dT=Cv+R
pV=RT
Cp=Cv+R-уравнение Майера
Cp=iR/2+R=(i+2)R/2
Т.о молярная теп-сть определяется лишь числом степеней свободы и не зависит от температуры
В случае реального газа молярные теплоемкости зависят от температуры.
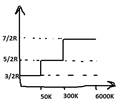 СV=7/2R
СV=7/2R
Ступенчатый характер зависимости молекулярной теплоёмкости газа от тем-ры обусловлен квантовой энергией молекул.
Если сообщенная теплота Q недостаточна для возбуждения колебаний в молекулах, то эти колебания не возникают и тем самым не вносят вклад во внутреннюю энергию. То же самое касается и степеней свободы вращательного движения.
Применение 1 начала термодинамики к изопроцессам.
Изобарный процесс, p=const.
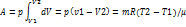
pV=mRT/μ
Универсальная газовая постоянная R численно равная работе расширения 1 моля газа при нагревании его на 1К.
В изобарном процессе газ получает теплоту dQ=mCpdT/μ, при этом dU= mCVdT/μ(его внутренняя энергия изменяется на dU), совершается газом работа A=mR(T2-t1)/μ
Изохорный процессб V=const
|
|
|
dA=pdV=0
dQ=dU
dUμ=CVdT
dQ, dU=mdUμ/μ=mCμdT/μ
Изотермический процесс, T=const.
dA=pdV
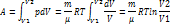
pV=mRT/μ p=mRT/μV
dU=0 В изотермическом процессе внутренняя энергия не меняется dQ=dA
Т.о в изотермическом процессе вся теплота, сообщаемая газом расходуется на совершение газом работе против внешних сил.
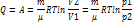
Адиабатический процесс. Уравнение Пауссона
Процесс происходящий без обмена с окружающей средой, в системе. Называют адиабатическим.
По 1 началу ТД dQ=0, dA=-dU “-“ говорит. Если положительная работа газ охлаждается
При совершении газом положительной работы он охлаждается, а при совершении работы внешними силами над газом он нагревается.
dA=pdV=-mCVdT/μ pV=mRT/μ
pdV+Vdp=mRdT/μ
(pdV+Vdp)/pdV=-R/CV
CP=CV+R
(pdV+Vdp)/pdV=-(Cp-CV)/CV
Vdp/pdV=-Cp/Cv j=Cp/CV
Vdp/pdV=-j dp/p=-jdV/V
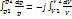
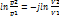
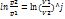 p2/p1=(V1/V2)^j
p2/p1=(V1/V2)^j
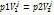 уравнение Пауссона
уравнение Пауссона

pV=mRT/μ pV=mRT/μ pVj=const
p1-jTj=const
TVj-1=const
Адиабата более крута, чем изотерма. Это объясняется тем что при адиабатическом сжатии газа увеличение давления газа обусловлено не только уменьшением объема, но также увеличением температуры газа
dA=-mCVdT/μ

Работа при изотермическом процессе расширения газа больше, чем при адиабатическом. И это объясняется тем, что при адиабатическом расширениигаза происходит охлаждение газа. Тогда как при изотермическом процессе тем-ра газа остается неизменным за счет притока тепла из вне.
|
|
|
Круговые процессы
Совокупность Тд-их процессов, в результате которых система вновь возвращается в исходное состояние, называется круговым процессом.
Тело совершающее круговой процесс и обменивающей энергией с другими телами называется рабочим телом.
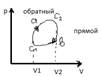
В процессе расширения газа, т.е. на участке С1 и С2 газ совершает положительную работу, численно равную площади фигуры V1C1иC2V2
На участке сжатия газа C2 в C1 газ совершает отрицательную работу численно равную площади фигуры V1C1вc2V2
A=A1+A2 вся совершенная работа будет равна площади самого цикла A=A1+A2=A1-A2’
Прямой процесс, обратный процесс.
При совершении обратного процесса совершаемая за цикл работа будет отрицательной, численно равная вновь площади самого цикла.
В обратном уикле рабочее тело передает теплоту от холодного к более нагретому телу.
За счет затраты положительной работе внешних сил.
Начало термодинамики
Для описания ТД-ых процессов 1 начала термодинамики не достаточно, поскольку 1 закон представляя закон сохранения энергии не показывает направление протекания процесса в природе.
|
|
|
Любая тепловая машина состоит из 4х частей.
Дата добавления: 2018-10-27; просмотров: 267; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
