Кислотно – лужна класифікація катіонів
На аналітичні групи
Для зручності проведення аналізу катіони поділяють на окремі аналітичні групи. Аналітична група — це група катіонів, яка з певним реактивом (за певних умов) дає подібні аналітичні реакції. Відомі дві класифікації: сульфідна та кислотно-лужна.
Сульфідна класифікація ґрунтується на неоднаковій розчинності карбонатів і сульфідів металів.
За кислотно-лужною класифікацією катіони розподіляються на групи щодо їх відношення до сульфатної, хлоридної кислот, їдких лугів та до амоніаку (табл. 4)
Аналіз катіонів із застосуванням сірководню (за сульфідною класифікацією) має ряд недоліків, найголовнішим з яких є робота із сірководнем, що шкідливо для здоров'я; роботу треба виконувати в лабораторії, устаткованій доброю витяжною системою. Виходячи з цього, краще аналіз катіонів проводити за кислотно-лужною класифікацією.
Перша група катіонів (К+, Nа+, NН4+) не має групового реактиву; катіони цієї групи не осаджуються ні мінеральними кислотами, ні лугами.
Катіони другої групи (Аg+, Рb2+, [Нg2]2+) осаджуються хлоридною кислотою.
Катіони третьої групи (Ва2+, Sr2+, Са2+) осаджуються сульфатною кислотою.
Четверту групу утворюють катіони (Zn2+, Al3+ , Сr+3, Sn2+, Sn(ІV), Аs(ІП), Аs(V)), які не випадають в осад при додаванні надлишку лугу.
Катіони п'ятої групи (Fе2+, Fе3+, Мn2+, Мg2+, Ві3+ , Sb(ІІІ), Sb(V)) осаджуються розчином лугу.
Шосту групу утворюють катіони (Нg2+, Сu2+, Сd2+, Со2+, Nі2+), що утворюють гідроксиди, розчинні в надлишку розчину амоніаку (w=25 %) (утворюються амоніакати).
|
|
|
Таблиця 4
Розподіл катіонів за кислотнo-лужною класифікацією
| Група | Катіони | Груповий реактив | Сполуки, що утворюються | Групова характеристика |
| 1 | К+, Na+,NН4+ | Немає | Хлориди, сульфати і гідроксиди розчиняються у воді | |
| 2 | Аg+, Рb2+, [Нg2]2+ | 2 н розчин НСl | Осади АgСl, РbС12, Нg2С12 | Хлориди нерозчинні у воді |
| 3 | Ва2+, Са2+ , Sг2+ | 2 н розчин Н2SО4 | Осади ВаSО4, СаSО4 SrSО4, | Сульфати нерозчинні (або погано розчинні) у воді і кислотах |
| 4 | Zn2+, Al3+ , Сr+3, Sn2+, Sn(ІV), Аs(ІП), Аs(V)) | Надлишок 4 н розчину NaОН або КОН | Розчин ZnO22–, AlO2‾, CrO2‾, SnO22–SnO32–, AsO33–, AsO43– | Гідроксиди розчинні у надлишку NaОН або КОН |
| 5 | Fе2+, Fе3+, Мn2+, Мg2+, Ві3+ , Sb(ІІІ), Sb(V) | Надлишок розчину NН4ОН (w=25%) | Осади Fе(ОН)2, Fе(ОН)3, Мn(ОН)2, Ві(ОН)3, Sb(ОН)3, Н[Sb(ОН)6] Мg(ОН)2, | Гідроксиди нерозчинні у надлишку NaОН або КОН |
| 6 | Сu2+, Со2+, Nі2+ Нg2+, Сd2+ | Надлишок NН4ОН (w=25%) | [Сu(NН3)4]2+ [Co(NH3)4]2+ [Nі(NН3)6]2+ [Cd(NН3)4]2+ [Hg(NH3)4]2+ | Гідроксиди розчинні у надлишку розчину амоніаку з утворенням амоніакатів |
К ласифікація аніонів на аналітичні групи
Аніони поділяють на аналітичні групи. Групові реактиви використовуються не для відокремлення груп аніонів, а для того, щоб зробити висновок: чи варто далі проводити реакції для виявлення кожного з іонів даної групи.
|
|
|
В основу класифікації аніонів покладена різна розчинність солей Барію і Аргентуму. Усі аніони можна поділити на три аналітичні групи (табл.5).
Таблиця 5
Розподіл аніонів на аналітичні групи
| Гру па | Аніони | Груповий реагент | Характерис тика групи |
| 1 | SO  , CO , CO  , PO , PO  ,
SO32-, SiO32-, CrO42-, MnO4- тощо ,
SO32-, SiO32-, CrO42-, MnO4- тощо
| Барій хлорид в нейтральному або слабколужному середовищі | Солі Барію, що мало розчиняються у воді |
| 2 |
CI  , Вr , Вr  , I , I  , S2-, SCN- тощо , S2-, SCN- тощо
| Аргентум нітрат в присутності нітратної кислоти | Солі Аргентуму, що не розчиняються у воді та розведеній нітратній кислоті |
| 3 |
NO  , CH , CH 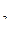 COO COO  , NO2- , NO2-
| Групового реагента немає. | Солі Барію і Аргентуму розчинні у воді |
До першої аналітичної групи аніонів відносяться аніони: SO  , CO
, CO  , PO
, PO  , SO32-, SiO32-, CrO42-, MnO4- тощо. Ці аніони утворюють з катіоном Ва
, SO32-, SiO32-, CrO42-, MnO4- тощо. Ці аніони утворюють з катіоном Ва  солі, що мало розчиняються у воді, але за виключенням барій сульфату, добре розчиняються у розведених мінеральних кислотах. Тому виділяти аніони цієї групи у вигляді осадів груповим реагентом – барій хлоридом – можна тільки в нейтральному або слабколужному середовищі. Аніони першої аналітичної групи утворюють з катіонами Аргентуму солі, що розчиняються у розведеній нітратній кислоті, а аргентум сульфат розчиняється навіть у воді.
солі, що мало розчиняються у воді, але за виключенням барій сульфату, добре розчиняються у розведених мінеральних кислотах. Тому виділяти аніони цієї групи у вигляді осадів груповим реагентом – барій хлоридом – можна тільки в нейтральному або слабколужному середовищі. Аніони першої аналітичної групи утворюють з катіонами Аргентуму солі, що розчиняються у розведеній нітратній кислоті, а аргентум сульфат розчиняється навіть у воді.
|
|
|
До другої аналітичної групи аніонів відносяться іони: CI  , Вr
, Вr  , I
, I  , S2-, SCN- тощо. Ці аніони утворюють з катіонами Ag
, S2-, SCN- тощо. Ці аніони утворюють з катіонами Ag  солі, що не розчиняються у воді та розведеній нітратній кислоті. Груповим реагентом другої групи аніонів є аргентум нітрат в присутності нітратної кислоти (в цих умовах аніони першої групи не дають осаду з аніонами Ag
солі, що не розчиняються у воді та розведеній нітратній кислоті. Груповим реагентом другої групи аніонів є аргентум нітрат в присутності нітратної кислоти (в цих умовах аніони першої групи не дають осаду з аніонами Ag  ). Барій хлорид з аніонами другої групи осадів не утворює.
). Барій хлорид з аніонами другої групи осадів не утворює.
До третьої групи аніонів відносяться іони NO  , CH
, CH 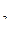 COO
COO  , NO2- тощо. Катіони Ba
, NO2- тощо. Катіони Ba  і Ag
і Ag  з аніонами даної групи не утворюють осадів, групового реагента на іони третьої групи немає.
з аніонами даної групи не утворюють осадів, групового реагента на іони третьої групи немає.
Дата добавления: 2018-09-20; просмотров: 1526; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
