Первый закон термодинамики. Его применение к изопроцессам. Теплоемкость в изобарном и изохорном процессе. Формулы Майера. Физический смысл газовой постоянной.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: ΔU = Q – A
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Формула Майера Cp = CV + R.
Г. п. имеет физический смысл работы расширения 1 моля идеального газа под постоянным давлением при нагревании на 1°. С другой стороны, разность молярных теплоёмкостей при постоянном давлении и постоянном объёме ср - cv = R.
Изохорный процесс (V=const). При изохорном процессе газ не совершает работы над внешними телами, т. е.
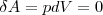 Из первого начала термодинамики (δQ=dU+δA) для изохорного процесса следует, что вся теплота, которая сообщается газу, идет на увеличение его внутренней энергии:
Из первого начала термодинамики (δQ=dU+δA) для изохорного процесса следует, что вся теплота, которая сообщается газу, идет на увеличение его внутренней энергии:
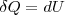 т.к. CV=dUm/dt,
т.к. CV=dUm/dt, 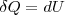
Тогда для произвольной массы газа получим 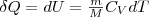 (1)
(1)
Изобарный процесс (p=const). При изобарном процессе работа газа при увеличения объема от V1 до V2 равна
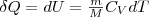 (2)
(2)
Если использовать уравнение Менделеева-Клапейрона для выбранных нами двух состояний, то
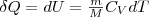 и
и 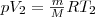 откуда
откуда 
Тогда выражение (2) для работы изобарного расширения примет вид 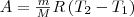 (3)
(3)
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2 —T1 = 1К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К. В изобарном процессе при сообщении газу массой m количества теплоты 
его внутренняя энергия возрастает на величину (т.к. CV=dUm/dt) 
Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля—Мариотта:
|
|
|

Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу, которая расположена на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Исходя из формул для работы газа и уравнения Менделеева-Клайперона найдем работу изотермического расширения газа: 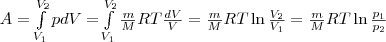
Так как при Т=const внутренняя энергия идеального газа не изменяется: 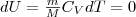
то из первого начала термодинамики (δQ=dU+δA) следует, что для изотермического процесса 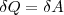
т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
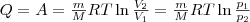 (4)
(4)
Значит, для того чтобы при расширении газа температура не становилась меньше, к газу в течение изотермического процесса необходимо подводить количество теплоты, равное внешней работе расширения.
Адиабатический процесс. Уравнение Пуассона. Отношение теплоёмкостей в процессах с постоянным давление и постоянным объемом.
Адиабатический процесс - это такое изменение состояний газа, при котором он не отдает и не поглощает извне теплоты. Следовательно, адиабатический процесс характеризуется отсутствием теплообмена газа с окружающей средой.
|
|
|
pVγ = const. Это соотношение называют уравнением Пуассона. Здесь γ = Cp / CV – показатель адиабаты, Cp и CV – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом. Для одноатомного газа 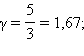 для двухатомного
для двухатомного 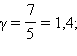 для многоатомного
для многоатомного 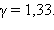
Дата добавления: 2018-08-06; просмотров: 709; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
