Основное уравнение молекулярно-кинетической теории идеального газа.
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа - это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:
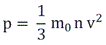
p – давление молекул газа на границы емкости,
m0 – масса одной молекулы,
n - концентрация молекул, число частиц N в единице объема V;
v2 - средне квадратичная скорость молекул.
Число степеней свободы молекулы. Равномерное распределение энергии по степеням свободы молекулы.
Числом степеней свободы тела называется число независимых координат, полностью определяющих положение тела в пространстве. Если одноатомную молекулу рассматривать как материальную точку, то для описания её положения в пространстве достаточно трёх независимых координат. Следовательно, одноатомная молекула имеет три степени свободы. Двухатомная молекула с жёсткой связью между атомами имеет пять степеней свободы. Три из них определяют поступательное движение молекулы, две - вращательное. Если в молекуле три (и более) атома, связанных жёсткой связью, то число степеней свободы равно 6. Во многих случаях необходимо принимать во внимание возможность относительных смещений атомов в молекуле, т.е. вводить в рассмотрение колебательные степени свободы молекул.
Согласно закону Больцмана о равномерном распределении энергии по степеням свободы молекул все степени свободы равноправны и вносят одинаковый вклад в ее среднюю энергию. Учитывая, что средняя энергия поступательного движения одноатомной молекулы по формуле (2.7), равна
|
|
|
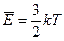 ,
,
получим кинетическую энергию, приходящуюся на одну степень свободы
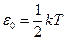 . (3.1)
. (3.1)
Если молекула имеет ί степеней свободы, то ее средняя кинетическая энергия
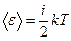 , (3.2)
, (3.2)
где 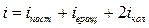 .
.
Колебательная степень обладает вдвое большей энергией поскольку на нее приходится не только кинетическая энергия, но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы.
С учетом (3.2), внутренняя энергия одного моля идеального газа равна
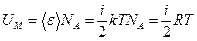 , (3.3)
, (3.3)
а произвольной массы газа
 . (3.4)
. (3.4)
Таким образом, внутренняя энергия идеального газа зависит от числа степеней свободы молекул и абсолютной температуры. Внутренняя энергия – однозначная функция состояния системы, она не зависит от пути перехода в данное состояние.
Изменение внутренней энергии газа связано с изменением температуры
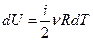 . (3.5)
. (3.5)
Эффективный диаметр молекул. Число столкновений и средняя длина свободного пробега молекул.
В случае соударения двух одинаковых шаров минимальное расстояние между центрами шаров равно их диаметру. Поэтому эффективным диаметром молекулы d называют минимальное расстояние, на которое сближаются при соударении центры двух молекул.
|
|
|
Ясно, что эффективный диаметр молекулы зависит от скорости их сближения (кинетической энергии на большом расстоянии), а значит - от температуры.
Длина свободного пробега молекулы — это среднее расстояние (обозначаемое  ), которое частица пролетает за время свободного пробега от одного столкновения до следующего.
), которое частица пролетает за время свободного пробега от одного столкновения до следующего.
Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега (<λ>). Величина <λ> является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры.
Формула
 , где
, где 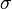 — эффективное сечение молекулы,
— эффективное сечение молекулы, 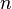 — концентрация молекул.
— концентрация молекул.
Обозначим эффективный диаметp молекулы чеpез d и молекулу пpедставим как шаp. Тогда число столкновений z молекулы с дpугими молекулами в секунду будет pавно числу молекул, центpы котоpых находятся в цилиндpе длиной, численно pавной <v>, и диаметpом 2d. Это число выpажается формулой
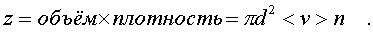
В фоpмулу нужно внести попpавку на то, что данная молекула сталкивается не с неподвижными молекулами, а с движущимися.
|
|
|
Дата добавления: 2018-06-27; просмотров: 387; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
