Первый закон термодинамики. Внутренняя энергия
Первый закон термодинамики вводит понятие внутренней энергии и с ее помощью определяет взаимосвязь между работой и теплопритоком.
Таким образом, и при совершении работы, и при осуществлении теплообмена термодинамическая система, ее масса является аккумулятором - носителем, приемником и источником - энергии, переносимой сквозь границу “система-среда”. Причем, здесь энергия может аккумулироваться при неподвижном центре массы системы, тем самым без изменения кинетической и потенциальной составляющих механической энергии термодинамической системы в целом. В таком случае аккумулятором, поглощающим или производящим потоки энергии, проходящие через границу термодинамической системы, является молекулярное и внутримолекулярное движение и межмолекулярное взаимодействие. Эта форма аккумулирования энергии, не проявляющаяся в механике, названа внутренней энергией.
Если состояние системы определяется, например, температурой и давлением, то и величина внутренней энергии однозначно определяется температурой и давлением. Говорят:
внутренняя энергия есть однозначная функция состояния термодинамической системы и изменяется только потоками энергии (работа, теплообмен) через границы системы.
Это утверждение выражает первый закон термодинамики. Его суть в том, что если после изменения параметров состояния (температура, давление) вернуть их к первоначальному значению, то и внутренняя энергия вернется к ее первоначальному значению
|
|
|
Уравнение первого закона термодинамики
В соответствии с формулировкой первого закона можно составить уравнение энергетического баланса термодинамической системы, достаточно лишь установить, какое направление для переноса энергии при работе и при теплообмене будет положительным. При совершении работы положительным принимают направление из термодинамической системы во внешнюю среду. В отношении теплообмена общепринято положительным считать теплообмен, направленный от внешней среды к термодинамической системе, т.е. теплоприток к системе.
Примем обозначения:
Q - теплоприток к термодинамической системе, Дж (джоуль);
U1, U2 - начальное и конечное значения внутренней энергии системы, Дж;
L – совершаемая над внешней средой работа, Дж
Теперь можно записать уравнение энергетического баланса для закрытой термодинамической системы, или, как его называют, уравнение первого закона термодинамики:
Q = U2 - U1 + L , (1-3)
т.е. теплоприток к закрытой термодинамической системе расходуется на увеличение ее внутренней энергии и на совершение работы.
|
|
|
Для удобства записи часто пользуются обозначением:
U2 - U1 = 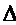 U.
U.
Тогда
Q =  U + L.
U + L.
То же в дифференциальной форме -
dQ = dU + dL. (1-3а)
Полученные равенства выражают закон сохранения энергии в природе и поэтому абсолютно верны. На их основе будут получены большинство расчетных формул термодинамики.
Согласно СИ единицами измерения теплопритока, внутренней энергии и работы являются Дж (джоуль) и кратные ему единицы: 103Дж = кДж (килоджоуль), 106Дж = МДж (мегаджоуль). Однако применяются и другие единицы. Так, счетчики электроэнергии измеряют работу L электрического тока, подводимую к потребителю через счетчик, в киловаттчасах (1кВт.ч=3,6МДж), в диетологии энергетическая ценность продуктов указывается обычно в калориях (кал) или килокалориях (1ккал=4,19кДж). В системах теплоснабжения горячей водой и паром единицей принимают гигакалорию.
Термодинамический процесс
 Термодинамическая система совершает работу L или воспринимает теплоприток Q только тогда, когда совершает термодинамический процесс. Процесс состоит из последовательности термодинамических состояний системы.
Термодинамическая система совершает работу L или воспринимает теплоприток Q только тогда, когда совершает термодинамический процесс. Процесс состоит из последовательности термодинамических состояний системы.
Рис.1-2. Изображение равновесного процесса 1-2 в рV-диаграмме. Площадь под кривой процесса выражает работу сил давления, представленную формулой (1-5).
Дата добавления: 2018-05-12; просмотров: 285; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
