Структурные и функциональные изменения митохондрий в условиях гипоксии
Мозг является одним из наиболее зависимых от кислорода органов. Несмотря на то, что вес мозга составляет всего 2% от общего веса организма, он использует до 20% потребляемого кислорода. Этот орган характеризуется также высоким потреблением энергии при низких ее запасах. Более того, в обеспечении энергозависимых процессов используется 80% АТФ, продуцируемого нейрональными митохондриями. По этой причине мозг чрезвычайно чувствителен к действию гипоксии. В особенности чувствительны такие отделы мозга как кора и гиппокамп. Поэтому важно понять, как функционирует митохондриальный аппарат мозга в условиях недостаточного обеспечения его кислородом.
Способность к обеспечению кислородного гомеостаза и, соответственно, зависимость от кислорода присуща всем высшим организмам, чья жизнеспособность напрямую связана с аэробным путем синтеза энергии, который обеспечивается работой дыхательной цепи на внутренней мембране митохондрий. У млекопитающих до 98% потребляемого организмом кислорода связано с процессом окислительного фосфорилирования, протекающим непосредственно в составе дыхательной цепи, где кислород выступает финальным акцептором электронов, переносимых с помощью НАДН и флавопротеинов. Энергия переноса электронов используется для генерации мембранного потенциала и синтеза АТФ, что играет ключевую роль в обеспечении разнообразных энергозависимых реакций, протекающих в клетке и способствующих поддержанию ее жизнеспособности.
|
|
|
Митохондрии, как кислород-зависимые органеллы, страдают от гипоксии в первую очередь. Снижение концентрации кислорода в клетке ведет к ухудшению аэробного синтеза, а значит, и к уменьшению содержания высокоэнергетических соединений (АТФ), а также снижению мембранного потенциала. Это, в свою очередь, приводит к подавлению ряда энергозависимых реакций, вовлеченных в транспорт ионов, электрогенную и рецепторную функции клетки, обеспечение мышечных сокращений, дыхания и так далее. Самым распространенным нарушением является деполяризация мембраны, бесконтрольный вход ионов Ca2+ через потенциал-зависимые кальциевые каналы, активация Ca-зависимых фосфорилаз и протеаз, неконтролируемое разбухание клеток, гидролиз большинства клеточных компонентов и, наконец, некроз (Lukyanova, Kirova, 2015).
При гипоксии в нервных клетках, как правило, наблюдается набухание митохондрий с разрушением крист и внутренних мембран. У некоторых митохонодрий внутренняя мембрана не выявляется и органелла превращается в вакуоль. Нередко в митохондриях наблюдаются лишь фрагментация и распад крист, при этом степень повреждения митохондрий варьирует не только в различных клетках, но и в пределах одной клетки. Распад крист и набухание митохондрий при гипоксии нередко сочетаются с повышением осмиофилии цитоплазмы, перераспределением полисом и другими изменениями (Боголепов, 1979).
|
|
|
Кислород, являющийся субстратомтерминального фермента дыхательной цепи – цитохромоксидазы, принимает участие в реакциях аэробного синтеза. Следовательно, его дефицит в окружающей клетку среде может подавлять аэробный синтез и снижать содержание макроэргов, а также мембранный потенциал.В результате происходит угнетение широкого спектра энергозависимых реакций: ионного транспорта, электрогенной и рецепторной функции клетки, мышечного сокращения и др.
Ответ организма на гипоксию включает различные адаптивные реакции, способствующие устранению функционально-метаболических нарушений, и направленных, прежде всего, на сохранение функции митохондрий. При этом используются 2 типа механизмов: 1) срочный компенсаторный, цель которого – предотвращение последствий острой гипоксии и быстрое восстановление в постгипоксический период, и 2) долгосрочные механизмы адаптации к гипоксии, которые формируются в течение более длительного периода и способствуют увеличению неспецифической резистентности к дефициту кислорода. Эти механизмы базируются на регуляторном репрограммировании активности митохондриальных ферментных комплексов (Лукьянова, 2013).
|
|
|
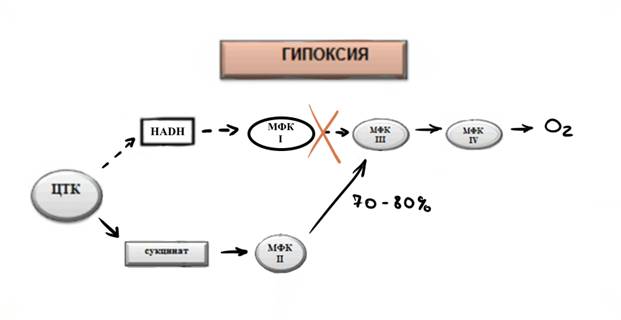
Рис. 5. Репрограммирование работы митохондриальной дыхательной цепи в условиях гипоксии (Лукьянова, 2013)
ЦТК – цикл трикарбоновых кислот
МФК I, II, III, VI – митохондриальные ферментные комплексы I, II, III и VI соответственно
HADH – НАД-зависимые субстраты
Как показано на рисунке 5, гипоксия индуцирует изменение функции дыхательной цепи и её программы: переход от окисления НАД-зависимых субстратов (комплекс I) к окислению сукцината (комплекс II). За обратимым подавлением электронно-транспортной функции МФК I следуеткратковременная, обратимая, компенсаторнаяактивация дыхательной цепи комплекса II, необходимая для синтеза энергии на основе сукцината в условиях недостатка кислорода, – это основной механизм незамедлительной адаптации к гипоксии и формирования необходимой устойчивости организма. Этот механизм принимает участие в обеспечении как минимум четырех важных регуляторных функций.Во-первых, это сенсорная функция, связанная с изменением кинетических свойств комплексов I и II в ответ на постепенное снижение концентрации кислорода во внешней среде. Эта функция необходима для подбора наиболее эффективного способа окисления субстрата в условиях гипоксии. Во-вторых, это компенсаторная функция,обеспечивающая формирование незамедлительного адаптивного ответа и необходимой защиты организма в условиях гипоксии. В-третьих, это транскрипционная функция, которая обеспечивает активацию экспрессии HIF-1 (Hypoxia-Inducible Factor 1) и других генов, обеспечивающих долгосрочную адаптацию к низкому парциальному давлению кислорода. И наконец, рецепторная функция, обеспечивающая участие митохондрий во внутриклеточной сигнальной системе вместе с сукцинат-зависимым рецептором, GPR91(G Protein-coupledReceptor 91) (Lukyanova, Kirova, 2015).
|
|
|
При активации МФК IIрезко возрастает содержание сукцината в крови и тканях.Вклад сукцинатоксидазного окисления в общее дыхание может достигать 70– 80 %. Кроме того, имеются многочисленные данные, свидетельствующие об особой роли сукцината в окислительном метаболизме ткани на ранней стадии гипоксии. Установлено, что его содержание в тканях и в крови уже в первые 30 минут гипоксии возрастает на порядок, достигая 4–7 ммоль/л, и продолжает увеличиваться в ранний период реоксигенации. При гипоксии наблюдается активация сукцинатдегидрогеназы и сукцинатоксидазного окисления, а также увеличение вклада последнего в дыхание и синтез энергии. Пути образования эндогенного сукцината при этом могут различаться. Однако в их основе лежат аспартат- и глутаматзависимые аминотрансферазные реакции. При гипоксии мощным источником глутамата в мозге может быть специфическая для него активация в этих условиях глутаматергической системы. Однако скорость образования эндогенного сукцината, по-видимому, может быть недостаточной для оптимальной компенсации энергетического дефицита в условиях недостатка кислорода. Именно этим можно объяснить тот факт, что экзогенно введенный сукцинат или сукцинатсодержащие препараты обладают выраженными антигипоксическими свойствами, способствуя увеличению внутриклеточного пула АТФ и предупреждая ранние нарушения энергетического обмена (энерготропное действие сукцината). При этом одновременно увеличивается переносимость животными острой гипоксии.Увеличение содержания эндогенного сукцината при гипоксии в цитозоле и в крови говорит о его способности проникать из матрикса митохондрий через плазматические мембраны. Имеются данные о том, что при гипоксии увеличивается пассивная проницаемость мембран для сукцината, его анионного антипорта с малатом, а также транспорта по концентрационному градиенту с использованием различных переносчиков. Возможен и обратный процесс – транспорт экзогенного сукцината в клеткуТаким образом, необходимый результат достигается путём активации сукцинат-зависимого пути окисления, что позволяет рассматривать сукцинат как сигнальную и маркерную молекулу (Лукьянова, 2013, Kushniretal., 2001, Correaetal., 2007,Sekineetal., 2006,Sadagopanetal., 2007, Lukyanova, Kirova, 2015).
Обратимая инактивация электронно-транспортной функции МФК I в условиях гипоксии и при прочих патологиях (так или иначе включающих гипоксическую компоненту) является одной из трех стадий развития митохондриальных нарушений при гипоксии, что также известно в литературе как митохондриальная дисфункция. В литературе имеется немалое количество экспериментальных подтверждений нарушения электронно-транспортной функции МФК I в условиях гипоксии, которая сохраняется и даже усиливается в постгипоксический период (первые 30 минут – 2 часа реоксигенации) (Лукьянова, 2013, Aganietal., 2002, Sadeketal., 2004).
Таким образом, переключение путей окисления субстратов дыхательной цепи от НАД-зависимого на сукцинатоксидазный путь при разных формах воздействия гипоксии предупреждает или ослабляет характерные для гипоксии нарушения синтеза АТФ и оказывает нормирующее действиена жизненно важные функции организма, способствует устранению гипоксического ацидоза, а такжеувеличению резистентности организма к дефициту кислорода и формированию срочной резистентности. По данным Л. Лукьяновой (2013), переключение путей окисления субстратов дыхательной цепи, а именно изменение кинетических показателей основных ферментов МФК I и МФК II происходит очень быстро – уже через 30 минут после различных гипоксических воздействий.Однако если такое переключение не происходит (некомпенсированная дисфункция МФК I), наблюдается более ранняя деэнергизация клеток, сопровождающаяся гораздо более выраженными нарушениями функционально-метаболических показателей, контролирующих жизнедеятельность клетки(Weinbergetal., 2000).
Ведущая роль в формировании молекулярных механизмов долгосрочной адаптации к гипоксии принадлежит специфическому белковому фактору, индуцируемому при гипоксии – HIF-1. Прямыми или опосредованными мишенями HIF-1 являются около 180 генов, экспрессирующих специфические белки, необходимые в условиях сниженного снабжения О2 для активации альтернативных компенсаторных аэробных и анаэробных реакций, ответственных за синтез энергии и сохранение функциональной активности.Регуляция активности HIF-1 определяется преимущественно субъединицей HIF-1α, еёэкспрессия (или подавление экспрессии) определяются состоянием митохондриальной дыхательной цепи. По данным Л. Лукьяновой (2013) было показано, что дефицит активности МФК Iприводил к резкому снижению гипоксической индукции HIF-1α, однако в присутствии сукцината она восстанавливалась. Иными словами, индукция HIF-1α усиливается в условиях низкой активности МФК I и высокой активности МФК II. В то же время показано, что HIF-1α может влиять на работу дыхательной цепи: через активацию пируватдегидрогеназыкиназы I он способствует ингибированию пируватдегидрогеназы и тем самым подавляет окисление пирувата, что может быть одной из причин инактивации МФК I(Kimetal., 2006, Semenza, 2007).
Интермедиаты цикла Кребса – сукцинат и α-кетоглутарат, помимо их участия в электронно-траспортной функции митохондриальной дыхательной цепи, являются специфическими лигандами двух G-белок-сопряженных рецепторов: GPR91 и GPR99 соответственно. Поступая из клеток в кровь, в которой эти субстраты обнаруживаются в микромолярных концентрациях, они выполняют регуляторную функцию сигнальных молекул, ответственных в конечном счете за поддержание метаболического гомеостаза на системном уровне. Помимо этого, с усилением сукцинатоксидазного окисления при гипоксии связывают увеличение содержания Са2+ в цитозоле и матриксе и сопряженный процесс активации фосфолипазы А2, набухание митохондрий, снижение постгипоксического ацидоза, активацию митохондриального КАТФ-зависимого канала (Лукьянова, 2013, Hakaketal., 2009, Vargasetal., 2009).
Дата добавления: 2018-05-12; просмотров: 784; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
