Расчет состава равновесной газовой смеси
Краткие теоретические сведения
Для определения состава системы при установившемся равновесии, а следовательно, и выхода продукта реакции необходимо знать константу равновесия и состав исходной смеси.
Примеры решения задач
Пример 7. Определить степень диссоциации иодоводорода на водород и иод
2HI(g) = I2(g) + H2(g)
при температуре 693 K и давлении 1 атм., если константа равновесия реакции в данных условиях равна 0,02.
Обозначим степень диссоциации иодоводорода через α.
1 .Баланс реакции:
2HI(g) = I2(g) + H2(g)
| Вещество | HI | I2 | H2 |
| Было: | n | 0 | 0 |
| Реакция: | –nα | nα/2 | nα/2 |
| Итого: | n – nα | nα/2 | nα/2 |
Пусть до начала реакции в системе было n моль HI.
Тогда на момент равновесия прореагировало nα моль этого вещества.
Согласно уравнению реакции, из 2 моль HI образуется по 1 моль H2 и I2.
Следовательно, если на момент равновесия в реакцию вступает nα моль HI, то образуется по 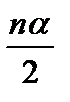 моль H2 и I2.
моль H2 и I2.
2. Определить равновесные мольные доли компонентов системы по формуле:
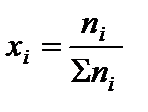 ,
,
где ni – количество вещества отдельного компонента системы; 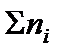 – суммарное количество вещества всех компонентов системы,
– суммарное количество вещества всех компонентов системы,
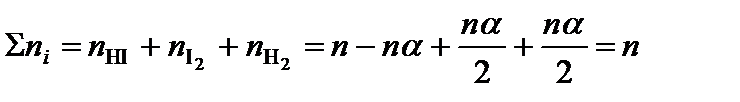 .
.
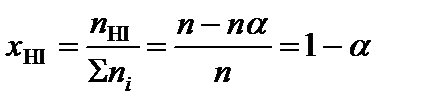 ;
;
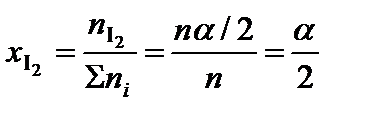 ;
;
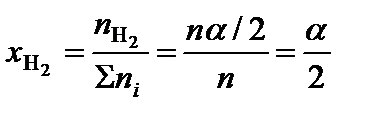 .
.
3. Определить равновесные парциальные давления компонентов системы согласно формуле:
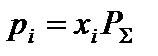 ,
,
где 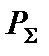 – общее давление в системе, атм.
– общее давление в системе, атм.
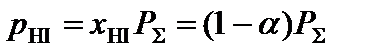 ;
;
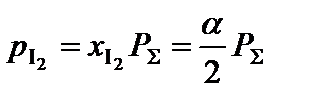 ;
;
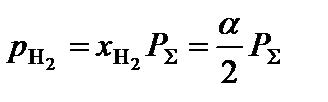 .
.
4. Составить уравнение константы равновесия процесса диссоциации иодоводорода
|
|
|
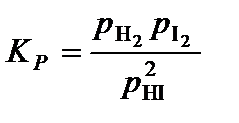 ,
,
и подставить в полученное уравнение определенные в п. 3 парциальные давления компонентов:
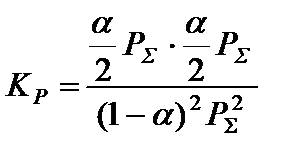 ,
,
упростить полученное уравнение:
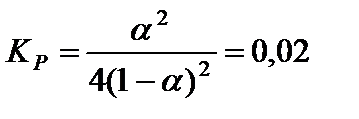
и решить его относительно α:
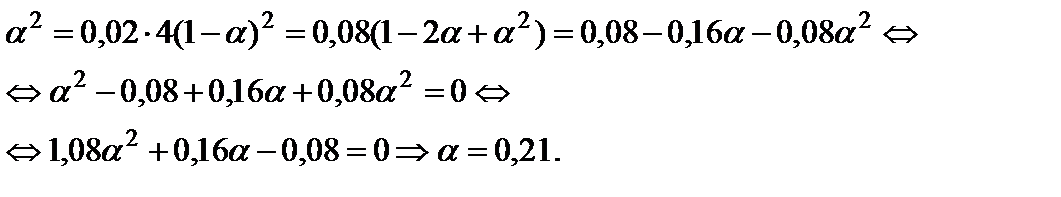
Пример 8. Вычислить состав равновесной смеси, образующейся при протекании реакции
C2H2(g) + N2(g) = 2HCN(g),
если процесс проводили при температуре 1500 K и давлении 1 атм. Константа равновесия реакции в данных условиях составляет 1,05·10−1. Для проведения реакции было взято 1 моль ацетилена и 1 моль азота.
Решение. Обозначим степень превращения реакции через α.
1.Составить баланс реакции:
С2Н2(g) + N2(g) = 2HCN(g)
| Вещество | С2Н2 | N2 | HCN |
| Было: | 1 | 1 | 0 |
| Реакция: | –α | –α | 2α |
| Итого: | 1–α | 1–α | 2α |
2. Определить равновесные мольные доли компонентов системы:
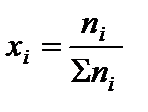 ,
,
где ni – количество вещества отдельного компонента системы; 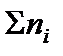 – суммарное количество вещества всех компонентов системы:
– суммарное количество вещества всех компонентов системы:
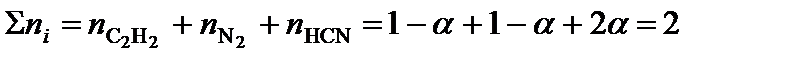 ;
;
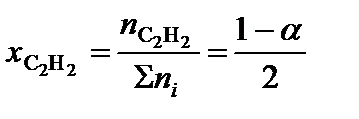 ;
;
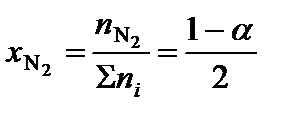 ;
;
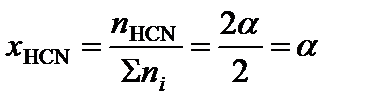 .
.
3. Определить равновесные парциальные давления компонентов системы согласно формуле:
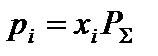 ,
,
где 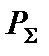 – общее давление в системе, атм.
– общее давление в системе, атм.
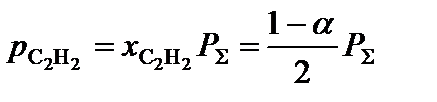 ;
;
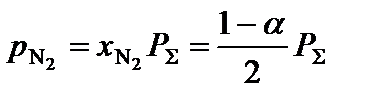 ;
;
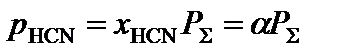 .
.
4. Составить уравнение константы равновесия процесса диссоциации иодоводорода,
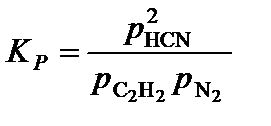 ,
,
подставить в полученное уравнение определенные в п.3 парциальные давления компонентов,
|
|
|
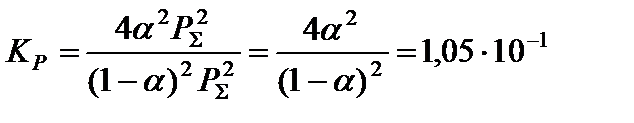
и решить его относительно α:
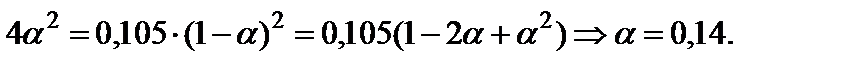
5. Вычислить равновесный состав системы:
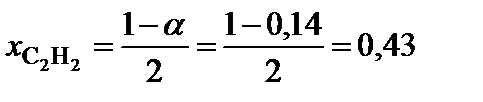 ;
;
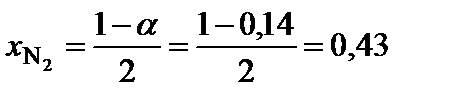 ;
;
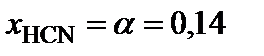 .
.
6. Выполнить проверку: сумма мольных долей компонентов системы должна быть равна единице.
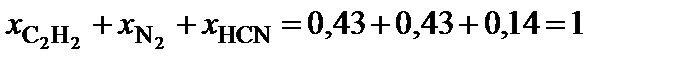 .
.
Задачи для решения
Задачи на расчет степени превращения вещества
121. Вычислить степень диссоциации четырехокиси азота на оксид азота (IV) по реакции N2O4 (г) = 2NO2 (г), если при температуре 50 °С и давлении 0,93 атм. константа равновесия равна 0,44.
122. При 2400 К для реакции 2H2O (г) = 2H2 (г) + O2 (г) lgKр = -2,41. При каком давлении степень диссоциации водяного пара уменьшится в два раза, если вначале давление равнялось 507 гПа?
123. При 49,7 °С и 348 гПа N2O4 диссоциирует на 63 % согласно уравнению N2O4 (г) = 2NO2 (г). Определить при каком давлением степень диссоциации при указанной температуре будет равна 50%.
124. Определить степень диссоциации фосгена по реакции COCl2 (г) = CO (г)+Cl2 (г), если при температуре 600 °С и давлении 1,36 атм. величина константы равновесия равна 5,8.
125. Определить степень диссоциации молекулы йода на атомы, если при температуре 527 °С и давлении 0,5 атм. константа равновесия равна 0,042.
126. При 494 °С и 990 гПа степень диссоциации оксида азота (IV) на оксид азота (II) и кислород составляет 56,5 %. Вычислить давление, при котором степень диссоциации равна 80 %.
|
|
|
127. Вычислить степень диссоциации N2O4 по реакции N2O4 (г) = 2NO2 (г) при температуре 50 °С и давлении 34800 Па, если константа равновесия равна 0,4.
128. Вычислить степень диссоциации хлорида фосфора (V) на хлорид фосфора (III) и хлор при температуре 230 °С и давлении 8,104∙105 Па, если константа равновесия равна 3,00.
129. Вычислить давление, при котором степень диссоциации фосгена на угарный газ и хлор при температуре 600 °С составит 10 %, если константа равновесия равна 5,8.
130. Вычислить давление, при котором степень диссоциации N2O4 на оксид азота (IV) при температуре 27 °С составит 40 %, если константа равновесия равна 0,042.
131. Вычислить степень диссоциации N2O4 на оксид азота (IV) при температуре 27 °С и атмосферном давлении, если константа равновесия равна 0,042
132. Вычислить степень диссоциации хлорида фосфора (V) на хлорид фосфора (III) и хлор при температуре 212 °С если константа равновесия равна 0,042 при условии, что 9,65 г хлорида фосфора (V) при указанной температуре занимают объем 2,64 л.
133. Вычислить давление, при котором степень диссоциации N2O4 на оксид азота (IV) при температуре 50 °С составляет 92 %, если константа равновесия равна 0,2.
134. При 49,7 °С и 348 гПа N2O4 диссоциирует на 63 % по уравнению N2O4 (г) = 2NO2 (г). Вычислить степень диссоциации при той же температуре и давлении 125 гПа.
|
|
|
135. При 830 °С и 1013 гПа степень диссоциации сероводорода 2H2S (г) = 2H2 (г)+S2 (г) равна 8,7 %. Определить константу равновесия Кр этой реакции.
136. При 1500 K и 1013 гПа степень диссоциации CO2 на угарный газ и кислород равна 0,1 %. Определить константу равновесия и рассчитать степень диссоциации CO2 при давлении 202,6·103 гПа, пренебрегая малыми значениями α по сравнению с единицей в (1 - α) и (1 + α/2).
137. Вычислить степень диссоциации иодоводорода на водород и йод при температуре 444 °С и давлении 20 атм., если константа равновесия равна 50. При каком давлении степень диссоциации составит 20 %?
138. Вычислить степень диссоциации молекулы брома на атомы при температуре 1000 K и атмосферном давлении, если величина константы равновесия равна 0,04.
139. Вычислить степень диссоциации молекулы хлора на атомы при температуре 1000 K и атмосферном давлении, если величина константы равновесия равна 0,14.
140. При 727 °С константа равновесия диссоциации оксида серы (VI) на оксид серы (IV) и кислород равна 3,461. Определить, под каким давлением степень диссоциации SO3 составит 20 %?
141. При каком давлении степень превращения оксида серы (IV) в оксид серы (VI) по реакции 2SO2 (г) + O2 (г) = 2SO3 (г) составит 95 % при температуре 700 °С и константе равновесия 0,29.
142. Вычислить давление, при котором степень диссоциации хлорида фосфора (V) на хлорид фосфора (III) и хлор составит 10 % при температуре 230 °С, если константа равновесия равна 3,0.
143. Вычислить общее давление в равновесной газовой смеси, при котором степень превращения метана по реакции CH4 (г) + CO2 (г) = 2CO (г) + 2H2 (г) при 1100 K составит 30 %, если константа равновесия равна 287,2.
144. Вычислить степень превращения метана при по реакции CH4 (г) + CO2 (г) = 2CO (г) + 2H2 (г), при температуре 900 K и давлении 1 атм., если константа равновесия равна 0,52.
145. Вычислить степень дегидрирования этана при температуре 1000 K и давлении 1 атм., если константа равновесия равна 0,32.
146. Вычислить выход этилена при дегидрировании этана при температуре 1200 K и давлении 1 атм., если константа равновесия равна 5,9.
147. Вычислить общее давление в равновесной газовой смеси, при котором степень диссоциации этана на этилен и водород при 1100 K составит 65 %; константа равновесия равна 1,6.
148. Вычислить общее давление в системе, при котором выход цианистого водорода, образующегося при реакции ацетилена и азота, при температуре 900 K составит 35 %; константа равновесия равна 0,03.
149. Вычислить общее давление в равновесной газовой системе, при котором выход оксида серы (VI), образующегося при окислении оксида серы (IV) кислородом при температуре 900 K и давлении 0,5 атм. составит 60 %; константа равновесия равна 48.
150. Вычислить степень диссоциации этанола на этилен и воду при температуре 500 K и давлении 1 атм., если константа равновесия равна 88,5.
Дата добавления: 2018-05-09; просмотров: 11966; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
