Тема роботи: Розпізнавання сполук неметалів. Розв'язування експериментальних задач
Мета роботи: навчитись розв'язувати практичні задачі з одержання основних сполук неметалів у лабораторних умовах, закріпити та перевірити на практиці вміння розпізнавати неорганічні сполуки, планувати та проводити досліди відповідно до поданої схеми.
Обладнання: штатив з пробірками, нагрівальний прилад.
Реактиви: амоній хлорид, амоній нітрат, натрій хлорид, натрій нітрат, натрій сульфат, барій хлорид, аргентум нітрат, кальцій карбонат, натрій гідрогенкарбонат, кальцій хлорид, сульфатна кислота, купрум хлорид, нітратна кислота, концентрована сульфатна кислота, мідні ошурки, хлоридна кислота, кальній гідроксид, натрій гідроксид, купрум (II) гідроксид.
Пам 'ятайте, що після роботи більша частина досліджуваних розчинів на розпізнавання речовин повинна залишатися невикористаною. Це необхідно на випадок, якщо доведеться повторювати дослідження.
Хіт роботи
Завдання І. Розпізнавання солей.
а) У трьох пронумерованих пробірках містяться кристали таких солей: натрій хлориду, натрій сульфату та натрій нітрату. Визначте, у якій з пробірок міститься яка речовина.
б) У трьох пронумерованих пробірках містяться амоній хлорид, натрій хлорид та натрій сульфат. Визначте, у якій з пробірок міститься яка речовина.
в) У трьох пронумерованих пробірках містяться розчини солей: калій карбонату, амоній хлориду, натрій сульфату. Як користуючись тільки одним реактивом, визначити в якій пробірці яка сіль міститься?
|
|
|
Запишіть рівняння лише тих реакцій, що відбуваються в розчинах до кінця.
а) Щоб визначити__________________________________________________
прилити в проби досліджуваних речовин_______________________________
При цьому в пробірці 1 спостерігається_________________________________
Рівняння реакції____________________________________________________
У пробірці 2 спостерігається__________________________________________
Рівняння реакції____________________________________________________
У пробірці 3 спостерігається__________________________________________
Рівняння реакції____________________________________________________
Висновок: у пробірці______знаходиться________________________________
б) Щоб визначити__________________________________________________
прилити в проби досліджуваних розчинів_______________________________
При цьому в пробірці 1 спостерігається_________________________________
Рівняння реакції____________________________________________________
Рівняння реакції____________________________________________________
У пробірці 3 спостерігається _________________________________________
Рівняння реакції____________________________________________________
Висновок: у пробірці_____знаходиться_________________________________
в) Щоб визначити___________________________________________________
прилити в проби досліджуваних розчинів_______________________________
При цьому в пробірці 1 спостерігається_________________________________
Рівняння реакції____________________________________________________
|
|
|
У пробірці 2 спостерігається__________________________________________
Рівняння реакції____________________________________________________
У пробірці 3 спостерігається__________________________________________
Рівняння реакції____________________________________________________
Висновок: у пробірці_____знаходиться_________________________________
Завдання II. Добування сполук неметалів за поданими схемами.
Використовуючи подані реактиви, проведіть реакції за наведеними схемами:
NН4СІ→ NН3 →NН 4ОН → NН4Сl
Звіт про роботу оформіть у вигляді таблиці.
| Реактиви, умови проведення реакції | Спостереження | Рівняння реакцій | Висновки |
Завдання III. Добування заданої речовини. Добудьте купрум (II) нітрат двома способами, використовуючи реакції обміну.
Результати запишіть у вигляді таблиці.
| Хід роботи | Спостереження | Рівняння реакцій | Висновки |
| Ланцюжок перетворень | |||
|
| |||
Завдання IV. Розпізнавання кислот. У трьох пронумерованих пробірках містяться розчини кислот: сульфатної, хлоридної, нітратної. Які реакції необхідно здійснити, щоб довести присутність тієї чи іншої кислоти в конкретній пробірці?
Рівняння реакцій напишіть у молекулярній та йонній формах______________
|
|
|
______________________________________________________________________________________________________________________________________________________________________________________________________
Висновок__________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Питання для заліку з роботи:
1. Загальні відомості про неметали, згідно роз положення їх у Періодичній системі хімічних елементів Д.І.Мєндєлєєва.
2. Охарактеризувати якісну реакцію на хлориди.
3. Охарактеризувати якісну реакцію на сульфати
4. Охарактеризувати якісну реакцію на нітрати.
Рекомендована література:
1. Буринська Н.М., Хімія 10-11 кл., К.:Перун, 2005 р.
2. Н.С.Романов. Загальна та неорганічна хімія. Підручник для студентів вищих навчальних закладів, Київ, 2002 р.
3. Н.Л.Глинка. Общая химия. Л.: Химия, 1980 г. – 719 с.
Додатки:
1. Таблиця-стенд “Періодична система хімічних елементів Д.І.Мендєлєєва”.
2. Таблиця-стенд “Розчинність солей, кислот і основ у воді”.
3. Таблиця-стенд “Електрохімічний ряд напруг металів”.
4. Таблиця-стенд “Основні назви солей, кислот і лугів”.
5. Таблиця-стенд “Назви важливих кислот”.
4. Таблиця-стенд “Правила безпеки при роботі з кислотами і лугами”.
|
|
|
5. Таблиця-стенд “Перша допомога при поранені”.
6. Таблиця-стенд “Вираження складу речовин”.
7. Таблиця-стенд “Назви солей”.
Лабораторна робота 2
Тема роботи: Хімічні властивості сульфатної кислоти. Виявлення сульфат-йонів.
Мета роботи: ознайомитися з хімічними властивостями сульфатної кислоти. Навчитися визначати сульфат-йони в розчині. Вдосконалити вміння працювати з хімічним посудом, закріпити набуті правила з техніки безпеки.
Обладнання: штатив з пробірками, піпетка, газовідвідна трубка.
Реактиви: розчини барій нітрату, розбавленої сульфатної кислоти, натрій сульфату, натрій та кальцій гідроксидів, натрій хлориду, барій хлориду, натрій гідрокарбонату, купрум (II) сульфату, розчини індикаторів (фенолфталеїн, метиловий оранжевий, лакмус), шматочки цинку, заліза, міді, купрум (II) оксид, солі.
Хід роботи
Дослід І. Дія кислоти на індикатори.
У три пробірки налийте по 0,5 мл розчину розбавленої сульфатної кислоти. У першу пробірку необхідно прилити 1-2 краплі фенолфталеїну, в другу - метилового оранжевого, в третю - лакмус. Свої спостереження занесіть у таблицю.
| Фенолфталеїн | Метиловий-оранжевий | Лакмус |
Висновок_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід II. Взаємодія розведеної сульфатної кислоти з металами.
У три пробірки налийте по і мл. розведеної сульфатної кислоти. У першу пробірку покладіть шматочок цинку, в другу - заліза, в третю - міді. Запишіть рівняння реакцій в молекулярній та йонній формах. Вкажіть, що окислюється, а що відновлюється
| № пробірки | Спостереження | Рівняння реакції |
| 1 | 2 | 3 |
| Zn |
| |
| Fe |
| |
| Cu |
| |
Висновок_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід III. Взаємодія сульфатної кислоти з основними оксидами.
У дві пробірки налийте розчин сульфатної кислоти. У першу пробірку внесіть 0,5 мг купрум (II) оксиду, в другу - ферум (III) оксиду. Пробірки злегка підігрійте в полум'ї спиртівки. Результати занесіть у таблицю.
| № пробірки | Спостереження, рівняння реакції |
| 1 | 2 |
| CuО | |
| Fe2О3 | |
Рівняння реакцій складіть у молекулярній та йонній формах ________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід IV. Взаємодія сульфатної кислоти з основами.
| Хід досліду | Спостереження |
| 1 | 2 |
| а) у пробірку налийте 0,5 мл лугу, додайте дві краплі фенолфталеїну, потім прилийте розчин сульфатної кислоти | |
| Рівняння реакції складіть в молекулярній та йонній формах | |
| б) додайте нерозчинну основу: долийте 0,5 мл лугу, додайте 0,5 мл купрум (II) сульфату. До утвореного розчину додайте 1мл розчину сульфатної кислоти | |
| Рівняння реакції напишіть у молекулярній та йонній формах | |
Висновок_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід V. Якісна реакція на сульфати.
| Хід досліду | Спостереження |
| 1 | 2 |
| 1. Налийте у пробірку 0,5 мл розчину сульфатної кислоти та 0,5 мл розчину барій хлориду | |
| 2. Налийте у пробірку 0,5 мл розчину натрій сульфату і 0,5 мл розчину барій хлориду | |
Запишіть рівняння відповідних реакцій в молекулярній та йонній формах:_______________________________________________________________________________________________________________________________________________________________________________________________
Вкажіть інший реактив, за допомогою якого можна визначити сульфат-йон у розчинах. Обґрунтуйте свій вибір, напишіть рівняння відповідних реакиій._____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Висновок________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Питання для заліку з роботи:
1. Загальні відомості про сульфур згідно розположення його у Періодичній системі хімічних елементів Д.І.Мєндєлєєва.
2. Загальні властивості сульфатної кислоти.
3. Якісна реакція на сульфати.
4. Як називається реакція взаємодії кислоти з лугом.
Рекомендована література:
1. Буринська Н.М., Хімія 10-11 кл., К.:Перун, 2005 р.
2. Н.С.Романов. Загальна та неорганічна хімія. Підручник для студентів вищих навчальних закладів, Київ, 2002 р.
3. Н.Л.Глинка. Общая химия. Л.: Химия, 1980 г. – 719 с.
Додатки:
1. Таблиця-стенд “Періодична система хімічних елементів Д.І.Мендєлєєва”.
2. Таблиця-стенд “Розчинність солей, кислот і основ у воді”.
3. Таблиця-стенд “Основні назви солей, кислот і лугів”.
4. Таблиця-стенд “Назви важливих кислот”.
2. Таблиця-стенд “Правила безпеки при роботі з кислотами і лугами”.
3. Таблиця-стенд “Перша допомога при поранені”.
4. Таблиця-стенд “Назви солей”.
Лабораторна робота 3
Тема роботи: Властивості нітратної кислоти, нітратів
Мета роботи: вивчити фізичні та хімічні властивості нітратної кислоти, навчитися визначати нітрат-йони в розчині. Вдосконалити вміння та навички проведення хімічного експерименту.
Реактиви: магній, залізо, мідь, кальцій, сірка, кальцій оксид, кальцій карбонат, калійна селітра, концентрована нітратна кислота, розбавлена нітратна кислота.
Обладнання: штатив з пробірками, спиртівка, сірники, фарфорова ступка, скіпка, пробіркотримач.
| Хід роботи | Спостереження |
| 1 | 2 |
| Дослід І. Взаємодія нітратної кислоти з металами. а) дія концентрованої нітратної кислоти (дослід виконується у витяжній шафі). У три різні пробірки покладіть магній, залізо і мідь. Прилийте до кожної по 1 мл концентрованої нітратної кислоти. | |
| б) взаємодія розбазленої нітратної кислоти з металами. У дві пробірки покладіть кальцій і мідь. Прилийте по 1 мл розбавленої нітратної кислоти. | |
| Рівняння реакції (коефіцієнти добрати методом електронного балансу) | |
| Дослід II. Взаємодія нітратної кислоти з неметалами (виконується у витяжній шафі). У пробірку покладіть шматочок сірки, залийте розчином концентрованої нітратної кислоти | |
| Рівняння реакції напишіть у молекулярній та йонній формах | |
| Дослід III. Взаємодія нітратної кислоти з оксидами металів. | |
| Насипте у пробірку купрум (II) оксид, налийте 1,5 мл розчину нітратної кислоти. Пробірку із сумішшю злегка підігрійте в полум'ї спиртівки. |
| 1 | 2 |
| Рівняння реакції напишіть у молекулярній та йонній формах | |
| Дослід IV. Взаємодія з основами. У пробірку налийте 1 мл натрій гідроксиду, додайте 1-2 краплі фенолфталеїну, прилийте 1 мл розчину нітратної кислоти. | |
| Рівняння реакції напишіть у молекулярній та йонній формах | |
| Дослід V. Взаємодія з солями. У першу пробірку налийте 1 мл розчину натрій карбонату, в другу покладіть на кінчику шпателя крейди (кальцій карбонату); в обидві пробірки долийте по 1 мл розчину нітратної кислоти, перевірте газ, який виділяється, запаленою скіпкою | |
| Рівняння реакції напишіть у молекулярній та йонній формах | |
| Дослід VI. Хімічні властивості нітратів. У порцелянову чашечку насипте кілька міліграм калійної селітри, нагрійте до розплавлення, в повітря над селітрою внесіть запалену скіпку. | |
| Рівняння реакції | |
| Дослід VII. Якісна реакція на нітрати* Налийте в пробірку 1-2 мл розчину солі -нітрату. Прилийте 1-2 мл концентрованої сульфатної кислоти; додайте шматочок міді, все підігрійте в полум'ї спиртівки. | |
| Рівняння реакції |
Висновок__________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Питання для заліку з роботи:
1. Загальні відомості про нітроген згідно розположення його у Періодичній системі хімічних елементів Д.І.Мєндєлєєва.
2. Загальні властивості нітратної кислоти.
4. Якісна реакція на нітрати.
5. Роль нітратів в агрономічній галузі.
Рекомендована література:
1. Буринська Н.М., Хімія 10-11 кл., К.:Перун, 2005 р.
2. Н.С.Романов. Загальна та неорганічна хімія. Підручник для студентів вищих навчальних закладів, Київ, 2002 р.
3. Н.Л.Глинка. Общая химия. Л.: Химия, 1980 г.
Додатки:
1. Таблиця-стенд “Періодична система хімічних елементів Д.І.Мендєлєєва”.
2. Таблиця-стенд “Розчинність солей, кислот і основ у воді”.
3. Таблиця-стенд “Основні назви солей, кислот і лугів”.
4. Таблиця-стенд “Назви важливих кислот”.
5. Таблиця-стенд “Правила безпеки при роботі з кислотами і лугами”.
6. Таблиця-стенд “Перша допомога при поранені”.
7. Таблиця-стенд “Назви солей”.
Лабораторна робота 4
Тема роботи: Добування карбон (IV) оксиду та вивчення його властивостей
Мета роботи: навчитись одержувати та визначати карбон (IV) оксид у лабораторних умовах, вивчити його властивості, дослідити умови взаємоперетворення карбонатів та гідрогенкарбонатів. Вивчити якісну реакцію на карбонат-йон.
Обладнання: штатив з пробірками, шпатель, нагрівальний прилад, лабораторний штатив з лапкою, пробка з газовідвідною трубкою.
Реактиви: мармур або крейда, натрій гідрогенкарбонат (кристалічний), вапняна вода, розчин хлоридної кислоти.
Хід роботи
1. Зберіть прилад, як показано на рисунку 4.1.
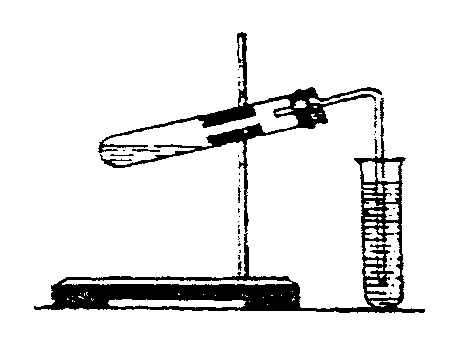
Рис. 4.1.
2. Виконайте роботу відповідно до рекомендацій, викладених у графі "Порядок дій", оформіть звіт, заповнивши таблицю.
| Хід роботи | Спостереження |
| 1 | 2 |
| Дослід І. Добування карбон (IV) оксиду. У пробірку покладіть 2-3 шматочки мармуру або крейди, додайте 2-3 мл розбавленої хлоридної кислоти, закрийте пробірку пробкою з газовідвідною трубкою. Кінець трубки занурте у | |
| 1 | 2 |
| порожній стакан. Запаленою скіпкою час від часу перевіряйте рівень заповнення посудини вуглекислим газом. | |
| Рівняння реакції напишіть у молекулярній, повній та скороченій йонній формах | |
| Дослід II. Взаємодія карбон (IV) оксиду з водою. Порцію вуглекислого газу пропустіть у велику пробірку, що на 1/3 заповнена холодною водою, періодично збовтуючи її. Добутий розчин розділіть на 2 пробірки, до кожної з них прилийте лакмус або метил оранжевий (1-3 краплі); до першої пробірки долийте вапняної води, вміст другої злегка підігрійте. | |
| Рівняння реакції напишіть у молекулярній, повній та скороченій йонній формах | |
| Дослід III. Взаємодія карбон (IV) оксиду з лугами. У першу пробірку налийте і мл розчину натрій гідроксиду, у другу - розчину вапняної води. Додайте 1-2 краплі фенолфталеїну, пропустіть вуглекислий газ спочатку в розчин натрій гідроксиду, а потім через вапняну воду. | |
| Рівняння реакції напишіть у молекулярній, повній та скороченій йонній формах | |
| Чому спочатку з'являється каламуть, а потім вона зникає?
| |
| Дослід IV. Якісна реакція на карбонати. а) у дві пробірки покладіть на дно кальцій карбонату та натрій карбонату. Долийте по 1 мл розведеної хлоридної кислоти. Після характерного «скипання» опустіть у пробірку запалену тонку скіпку. б) налийте в одну пробірку 0,5 мл розчину натрій карбонату. Долийте 5-6 крапель сульфатної кислоти, відразу закрийте пробірку пробкою з газовідвідною трубкою. Кінець трубки занурте в окремій пробірці з вапняною водою. | |
| Рівняння реакції напишіть у молекулярній, повній та скороченій йонній формах | |
Дослід V. Взаємоперетворення гідроген карбонатів на карбонати.
Зберіть прилад, як на рисунку 4.2.
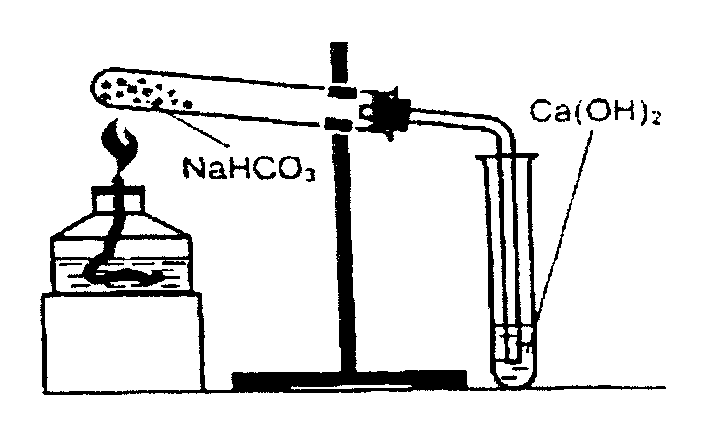
Рис. 4.2.
У суху пробірку помістіть трохи кристалічного натрій гідрогенкарбонату та закрийте пробкою з газовідвідною трубкою, кінець якої занурте у пробірку з невеликою кількістю вапняної води. Прогрійте спочатку всю пробірку, а потім те місце, де знаходиться сіль. Нагрівання треба проводити доти, доки не відбудуться зміни у пробірці.
У результаті реакції утворюється:_____________________________________
рівняння реакції ____________________________________________________
Карбон (IV) оксид можна одержати в результаті реакції___________________
__________________________________________________________________
Карбонати можна перевести в гідрогенкарбонати при_____________________
__________________________________________________________________
Гідрогенкарбонати перетворюються в карбонати за таких умов:____________
__________________________________________________________________
Якісною реакцією на карбонати є:_____________________________________
________________________________________________________________
Питання для заліку з роботи:
1. Загальні відомості про карбон згідно розположення його у Періодичній системі хімічних елементів Д.І.Мєндєлєєва.
2. Загальні властивості карбонатної кислоти.
3. Якісна реакція на карбонати.
4. Застосування карбонатів в різних галузях виробництва.
Рекомендована література:
1. Буринська Н.М., Хімія 10-11 кл., К.:Перун, 2005 р.
2. Н.С.Романов. Загальна та неорганічна хімія. Підручник для студентів вищих навчальних закладів, Київ, 2002 р.
3. Н.Л.Глинка. Общая химия. Л.: Химия, 1980 г.
Додатки:
1. Таблиця-стенд “Періодична система хімічних елементів Д.І.Мендєлєєва”.
2. Таблиця-стенд “Розчинність солей, кислот і основ у воді”.
3. Таблиця-стенд “Основні назви солей, кислот і лугів”.
4. Таблиця-стенд “Назви важливих кислот”.
8. Таблиця-стенд “Правила безпеки при роботі з кислотами і лугами”.
9. Таблиця-стенд “Перша допомога при поранені”.
10. Таблиця-стенд “Назви солей”.
Лабораторна работа № 5
Тема роботи: Загальні властивості металів
Мета роботи: практично ознайомитись з властивостями металів та їх сполук, окисно- відновними реакціями.
Обладнання : зразки металів, кислоти , луги
Хід роботи
Дата добавления: 2018-04-05; просмотров: 1753; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
