Инструктаж по технике безопасности
Теоретическая часть.
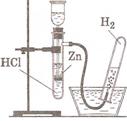
Водород – Н2- газ без цвета, запаха, легче воздуха, поднося зажженную спичку, слышим характерный хлопок. Получаем в лаборатории реакцией замещения цинка с соляной кислотой.
Zn + HCl = ZnCl2 + H2
Углекислый газ –СО2, без цвета, запаха, тяжелее воздуха. В лаборатории получают взаимодействием карбоната кальция с соляной кислотой.
CaCO3 + HCl = CaCl2 +CO2+ H2O , не поддерживает горения.
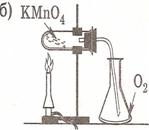
Кислород- О2, газ без цвета, запаха, легче воздуха. В лаборатории получают разложением KMnO4
Ход работы.
5.Запишите тему практического занятия и номер варианта в тетрадь.
6.Приготовьте в тетради таблицу по следующему образцу:
Оформите отчет в виде таблицы
| Название и формула газа | Способ собирания газа. На каком физическом свойстве газа он основан. | Уравнение химической реакции, лежащей в основе получения данного газа. Наблюдения. | Характерные химические реакции, используемые для доказательства наличия данного газа. Наблюдения |
7.Рассмотрите решение задания сначала теоретически, напишите уравнения соответствующих реакций.
8.Соберите прибор согласно рисунку и получите в нем нужное вещество.
9.Проведите характерные химические реакции, используемые для доказательства наличия данного газа.
10.Результаты работы запишите в таблицу.
|
|
|
11.Приведите в порядок используемые принадлежности и свое рабочее место.
| Вариант №1 Получить водород и доказать его наличие |
| |||
| Вариант №2 Получить кислород и доказать его наличие. |
| |||
| Вариант №3 Получить оксид углерода (IV) и доказать его наличие. | 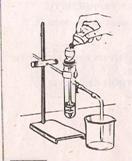
|
Ответьте на вопросы.
1. Какоесвойство водорода используют при его получении?
2. Как доказать наличие углекислого газа?
3.Если кислород легче воздуха, то его собирают…
. Приведите в порядок рабочее место.
|
|
|
|

Качественное определение углерода, водорода и хлора в органических веществах.
ЦЕЛЬ РАБОТЫ: проверить знания иумения на практике, закрепить знания свойств и состава органических веществ.
ОБОРУДОВАНИЕ и реактивы две пробирки, спиртовка, газоотводная трубка, парафин, безводный сульфат меди, порошок оксида меди(II), раствор известковой воды.
Учащийся должен ЗНАТЬ: правила техники безопасности, состав углеводородов, химические свойства.
Учащийся должен УМЕТЬ: собирать прибор для получения газов, писать уравнения реакции , подтверждающие качественный состав углеводородов.
|
|
|
ИНСТРУКТАЖ ПО ТБ:
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ:
Парафины –это смесь предельных углеводородов, в составе которого содержится
Более 16 атомов углерода. Основным свойством предельных углеводородов является их горючесть. Горение их заключается в том ,что кислород окисляет углерод и водород до их высших оксидов- СО2и Н2О:
СН4 + 2О2= СО2 + 2Н2О
метан
С16Н34 +24.5 О2= 16СО2 + 17Н2О
парафин
Предельные углеводлороды взаимодействуют с хлором ( реакция замещения), характерна реакция дегидрирования ( отщепление водорода), разложения при нагревании, реакция изомеризации( получение изомеров)
ХОД РАБОТЫ:
|
|
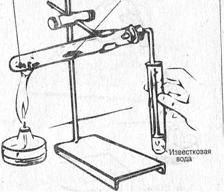
1.Соберите прибор согласно рисунку. Поместите ближе ко дну пробирки кусочек парафина (с горошину) и такое же количество порошка оксида меди (П), и ,ближе к пробке 1/2 ложки-дозатора безводного белого порошка сульфата меди.
Закройте пробирку пробкой с газоотводной трубкой. Закрепите прибор в лапке штатива. Нагревайте слегка дно пробирки, чтобы парафин расплавился и пропитал порошок оксида меди (П).
Опустите свободный конец газоотводной трубки в пробирку с 1 мл (20 капель) прозрачного раствора известковой воды.
|
|
|
Нагревайте пробирку с реакционной смесью, соблюдая правила нагревания!.
Наблюдайте за изменениями, происходящими с белым порошком сульфата меди, прозрачным раствором известковой воды и черным порошком оксида меди (II). Дайте объяснение происходящим явлениям.
2.После проведенных опытов заполните таблицу.
Оформите отчет в виде таблицы
| Реактивы | Наблюдения | Уравнение реакции |
Ответьте на вопросы:
1.Общая формула предельных углеводородов.
2.Продуктами горения парафинов является_________
3.Где используются предельные углеводороды?-
3.-Приведите в порядок рабочее место
|
|
 Получение этилена и изучение его свойств.
Получение этилена и изучение его свойств.
Цель:получить этилен экспериментальным путем, изучить свойства и отметить сходство и различие между углеводородами.
Оборудование и реактивы: пробирка с газоотводной трубкой, спиртовка, спички, штатив с пробирками, кристаллизатор, раствор перманганата калия, бромная вода, карбид кальция, вода очищенная, кварцевый песок (для равномерного кипения и предотвращения выбрасывания жидкости), спирта, серная кислота (3:2).
|
|
|
Учащийся должен знать: физические и химические свойства непредельных углеводородов, способы получения.
Учащийся должен уметь: пользоваться химической посудой и химическими реактивами, писать уравнения реакций.
Инструктаж по ТБ.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Этилен.
Этилен (этен), H2C=CH2, ненасыщенный углеводород, первый член гомологического ряда этиленовых углеводородов (СnН2n).
Физические свойства: бесцветный газ со слабым эфирным запахом; tnл — 169,5°С, tkип — 103,8°С, плотность 0,570 г/см3 (при tkип); практически нерастворим в воде, плохо — в спирте, лучше — в эфире, ацетоне. Температура воспламенения 540°С.
Способы получения:
t, Н2SО4 (конц.)
1.С2Н5ОН → CH2═СН2 + H2O
2. CH3─СН3→ CH2═СН2 + H2
3. CH3─СН2Br + КОН → CH2═СН2 + КBr + H2O
4. CH2Br─СН2Br + Zn → CH2═СН2 + ZnBr2
Химические свойства:
Горение.
С2Н4 + 3O2 → 2CO2 + 2H2O
горит слабокоптящим пламенем, с воздухом образует взрывоопасные смеси. Наиболее характерно для него присоединение по двойной углерод-углеродной связи.
2. Реакции присоединения идут за счет разрыва π – связи.
А) гидрирование
H2C = CH2 + H2 → H3C—CH3
б) присоединение галогенов (качественная реакция – обесцвечивание бромной воды)
H2C = CH2 + Br2 → BrH2C─СН2Br;
Дата добавления: 2018-04-05; просмотров: 344; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!