Задачі для самостійної роботи
ЗМІСТ
Вступ...............................................................................................................................................4
1. Розчини. Способи вираження концентрації розчинів…………………………………..5
1.1. Розв’язування типових задач…………………………………………………………...8
1.2. Задачі для самостійної роботи………………………………………………………....11
2. Теоретичні основи кислотно-основної взаємодії………………………….....................13
2.1. Властивості води. Йонний добуток води. Водневий показник……………………...13
2.2. Електролітична дисоціація. Розчини електролітів…………………………………...15
2.3. Гідроліз солей в хімічному аналізі…………………………………………………….18
2.4. Буферні розчини……………………………………………………………………..…22
2.5. Розв’язування типових задач………………………………………………………..…22
2.6. Задачі для самостійної роботи……………………………………………………...….25
3. Рівновага в системах осад - розчин. Добуток розчинності…………………………....28
3.1. Розв’язування типових задач………………………………………………………..…30
3.2. Задачі для самостійної роботи………………………………………………………....33
4. Реакції комплексоутворювання і окиснення-відновлення в хімічному аналізі……36
4.1. Розв’язування типових задач…………………………………………………………..38
4.2. Задачі для самостійної роботи…………………………………………………………42
5. Хімічні методи аналізу……………………………………………………………………..45
5.1. Гравіметричний метод аналізу………………………………………………………...45
|
|
|
5.1.1. Розв’язування типових задач……………………………………………………..48
5.1.2. Задачі для самостійної роботи……………………………………………………50
5.2. Титриметричний аналіз………………………………………………………………...52
5.2.1. Вимоги до реакцій в титриметричному аналізі…………………………………53
5.2.2. Класифікація методів титриметричного аналізу………………………………..53
5.2.3. Розрахунки в титриметричному аналізі…………………………………………55
5.2.4. Розв’язування типових задач…………………………………………………….56
5.2.5. Задачі для самостійної роботи…………………………………………………...59
6. Електрохімічні методи аналізу…………………………………………………………...62
6.1. Потенціометричний метод аналізу……………………………………………………63
6.2. Електрогравіметричний метод аналізу………………………………………………..64
6.4. Кулонометричний метод аналізу……………………………………………………...65
6.5. Полярографічний метод аналізу………………………………………………………66
6.5. Розв’язування типових задач…………………………………………………………..67
6.6. Задачі для самостійної роботи…………………………………………………………72
7. Оптичні методи аналізу……………………………………………………………………76
|
|
|
7.1. Фотометричний метод аналізу………………………………………………………...77
7.2. Атомно – абсорбційний метод аналізу………………………………………………..78
7.3. Атомно – емісійний метод аналізу……………………………………………………79
7.4. Рентгеноспектральний метод аналізу…………………………………………………81
7.5. Розв’язування типових задач…………………………………………………………..81
7.6. Задачі для самостійної роботи…………………………………………………………85
Література……………………………………………………………………………………...90
ВСТУП
Технічний прогрес будь-якої галузі промисловості неможливий без розвитку та вдосконалення аналітичного контролю технологічних процесів. Особливо важливим є цей контроль у тих галузях, де створюються нові матеріали із заданими властивостями. Виробництво металів і сплавів нерозривно зв’язане з виробництвом вогнетривів та коксу. Через це економічні показники металургійних підприємств залежать від покращення якості готової продукції, яка, в свою чергу, залежить від якості сировини, напівфабрикатів та допоміжних матеріалів. Для забезпечення високої якості продукції необхідний залежного рівня аналітичний контроль. Вирішенням питань, пов’язаних з розвитком методів аналітичного контролю займається аналітична хімія, теоретичні закономірності якої використовуються в хімічних, фізико-хімічних і фізичних методах визначення якісного і кількісного складу матеріалів.
|
|
|
Запропонований авторами навчальний посібник з аналітичної хімії є спробою допомогти студентам хімічних спеціальностей металургійних вищих учбових закладів краще оволодіти основними методами аналітичного контролю, покращити підготовку висококваліфікованих спеціалістів.
Особливість даного навчального посібника полягає в тому, що вперше в ньому органічно поєднуються теоретичні закономірності аналітичної хімії з основними методами аналізу, розрізненими в окремих книгах з якісного та кількісного аналізу речовин.
При складанні посібника використані матеріали з найпоширеніших підручників, задачників, монографій та довідників, які були перероблені у відповідності з сучасною хімічною термінологією, позначеннями, одиницями вимірювання фізичних величин.
Посібник містить 7 розділів, матеріал яких відповідає програмі з аналітичної хімії, що відповідає напряму 0916 – хімічна технологія та інженерія. Він може бути використаний для поглиблення знань з аналітичного контролю студентів за спеціальністю 0905 – металургія. В кожному розділі викладені основні теоретичні закономірності, наведені приклади розв’язування типових задач, запропоновані задачі для самостійної роботи студентів.
|
|
|
РОЗЧИНИ. СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЇ РОЗЧИНІВ
Розчинами називають термодинамічно стійкі рівноважні системи змінного складу з двох або більше компонентів. Той компонент, що кількісно переважає і зберігає свій агрегативний стан під час утворення розчину, прийнято вважати розчинником, інші компоненти – розчиненими речовинами. Кількісний склад розчину визначає концентрація, яка показує кількість одиниць маси розчиненої речовини в одиниці об’єму розчину або в одиниці маси розчинника (розчину).
В залежності від обраної одиниці виміру концентрації поділяють на об’ємні та масові.
Об’ємна концентрація – це кількість одиниць маси розчиненої речовини в одиниці об’єму розчину. Ці концентрації дуже зручні при розрахунках, але залежать від температури.
В залежності від одиниць маси розчиненої речовини та одиниць об’ємів розчину розрізняють наступні концентрації:
1. Молярна концентрація (молярність) показує кількість молів розчиненої речовини, що міститься в одному літрі розчину. Розмірність: моль/л.
Молярна концентрація (С 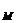 ) розраховується за рівнянням
) розраховується за рівнянням
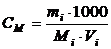 , (1.1)
, (1.1)
де mi – маса розчиненої речовини, г; Мi – молярна маса розчиненої речовини, г; Vi - об’єму розчину, мл; 1000 – коефіцієнт переходу від мілілітрів до літрів.
2. Молярна концентрація еквівалента (нормальність) показує кількість моль-еквівалентів розчиненої речовини, що міститься в одному літрі розчину. Розмірність: моль-екв/л.
Молярна концентрація еквівалента (СН) розраховується за рівнянням
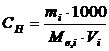 , (1.2)
, (1.2)
де mi – маса розчиненої речовини, г; Мe,i – молярна маса еквівалента речовини, г; Vi - об’єму розчину, мл; 1000 – коефіцієнт переходу від мілілітрів до літрів.
3. Титр розчину – відношення маси розчиненої речовини до об’єму розчину. Розмірність: г/мл.
Титр розчину (Т) розраховується за рівняннями
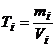 , (1.3)
, (1.3)
де 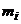 – маса розчиненої речовини, г;
– маса розчиненої речовини, г; 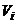 - об’єму розчину, мл.
- об’єму розчину, мл.
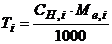 , (1.4)
, (1.4)
де 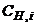 – молярна концентрація еквівалента речовини, моль-екв/л;
– молярна концентрація еквівалента речовини, моль-екв/л;
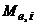 - молярна маса еквівалента речовини, г/моль-екв.
- молярна маса еквівалента речовини, г/моль-екв.
В кількісному аналізу часто використовують поняття – титр розчину за речовиною, що визначається (ТВ/А). Вона показує, скільки грамів речовини, що визначається, реагує з 1мл титрованого розчину. Розраховується за рівнянням
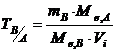 , (1.5)
, (1.5)
де ТВ/А - титр розчину В за речовиною А, що визначається, г/мл; m – маса розчиненої речовини В, г; Vi - об’єм розчину, мл; Ме,А і Ме,В – молярні маси еквівалентів речовин А і В, г.
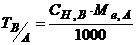 , (1.6)
, (1.6)
де 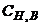 – молярна концентрація еквівалента титрованого розчину В, моль-екв/л;
– молярна концентрація еквівалента титрованого розчину В, моль-екв/л; 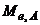 - молярна маса еквівалента речовини А, г/моль-екв.
- молярна маса еквівалента речовини А, г/моль-екв.
Масові концентрації – це кількість одиниць маси розчиненої речовини в одиниці маси розчинника (розчину). Ці концентрації не залежать від температури, але не дуже зручні у роботі, бо потребують тривалої операції зважування.
1. Моляльна концентрація (моляльність) показує кількість молей розчиненої речовини, що міститься в 1кг розчинника. Розмірність: моль/кг.
Моляльна концентрація (Сm) розраховується за рівнянням
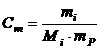 , (1.7)
, (1.7)
де mi – маса розчиненої речовини, г; mР – маса розчинника, кг; Мi – молярна маса розчиненої речовини, г.
2. Мольна частка (Хi) показує, яку частину від загальної кількості молей розчину складає розчинена речовина або розчинник. Розраховується за рівнянням
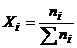 , (1.8)
, (1.8)
де ni– кількість молей і-го компонента в розчині, моль; 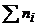 - сума молей усіх компонентів розчину, моль.
- сума молей усіх компонентів розчину, моль.
Для бінарних розчинів сума мольних часток розчинника (Хо) і розчиненої речовини (Хі) дорівнює одиниці.
Хі + Хо = 1. (1.9)
Мольні частки виражають у частинах від одиниці або у відсотках.
3. Масова частка у відсотках ( 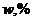 ) показує кількість грамів розчиненої речовини в 100г розчину. Розраховується за рівнянням
) показує кількість грамів розчиненої речовини в 100г розчину. Розраховується за рівнянням
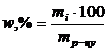 , (1.10)
, (1.10)
де mi – маса розчиненої речовини, г; mр-ну – маса розчину, г.
Розчин характеризується певною густиною ρ (г/мл або кг/дм3), яку беруть до уваги під час переходу від масових концентрацій до об’ємних, і навпаки.
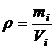 , (1.11)
, (1.11)
де mi – маса розчину, г; Vi- об’єм розчину, мл.
Рівняння, що пов’язують масову частку з молярністю, нормальністю та моляльністю розчинів, мають вигляд
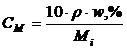 , (1.12)
, (1.12)
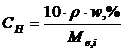 , (1.13)
, (1.13)
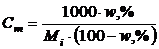 . (1.14)
. (1.14)
1.1. Розв’язування типових задач
Задача 1. Визначте молярну и моляльну концентрації 87,69%-го розчину сульфатної кислоти густиною ρ=1,86г/мл.
Розв’язування. Розрахуємо молярну концентрацію Н2SO4 за рівнянням (1.12)
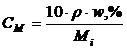 ,
,
де ρ – густина розчину, г/мл; 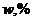 - масова частка розчину, %; Мi – молярна маса кислоти, г.
- масова частка розчину, %; Мi – молярна маса кислоти, г. 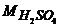 = 98г/моль.
= 98г/моль.
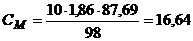 моль/л.
моль/л.
Моляльність розчину розрахуємо за рівнянням (1.14)
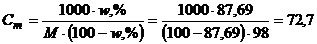 моль/кг.
моль/кг.
Задача 2. Розрахуйте молярну концентрацію еквівалента та масову частку у відсотках розчину НСІ, який утворюється при розчиненні 7,3г НСІ в 150мл води. Густина отриманого розчину дорівнює 1,02г/мл.
Розв’язування. Розрахуємо молярну концентрацію еквівалента розчину хлоридної кислоти за рівнянням (1.2)
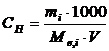 .
.
Об’єм розчину розрахуємо за рівнянням
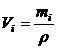 ,
,
де mi – маса розчину, г; ρ – густина розчину, г/мл.
Якщо густина води дорівнює 1г/мл, то її об’єм можна прийняти рівним до маси. Тоді маса розчину становитиме
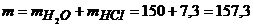 г.
г.
Знайдемо об’єм розчину
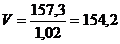 мл.
мл.
Молярну масу еквівалента НСІ визначимо за рівнянням
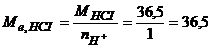 г/моль-екв.
г/моль-екв.
Молярна концентрація еквівалента розчину НСІ дорівнюватиме
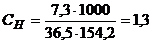 моль-екв/л.
моль-екв/л.
Масову частку НСІ у відсотках розрахуємо за рівнянням (1.10)
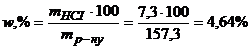 .
.
Задача 3. Визначте масову частку у відсотках, моляльність, титр розчину і мольну частку розчиненої речовини після розчинення 8г натрій гідроксиду в 200г води. ρ=1,01 г/мл.
Розв’язування. Масову частку NaOH у відсотках в отриманому розчині розрахуємо за рівнянням (1.10)
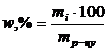 .
.
Маса розчину становитиме
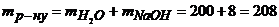 г.
г.
Тоді
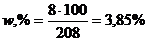 .
.
Моляльність розчину визначимо за рівнянням (1.7).
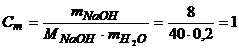 моль/кг.
моль/кг.
Знайдемо титр розчину за рівнянням (1.3)
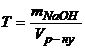 .
.
Оскільки густина розчину дорівнює 1,01г/мл, то
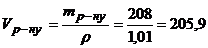 мл.
мл.
Тоді
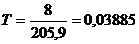 г/мл.
г/мл.
Мольну частку NaOH у розчині розрахуємо за рівнянням (1.8)
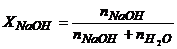 .
.
Кількість молей NaOH дорівнює
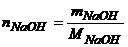 ,
,
де МNaOH – молярна маса NaOH, г/моль. МNaOH=40г/моль.
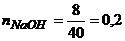 моль.
моль.
Кількість молей Н2О дорівнює
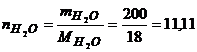 моль.
моль.
Тоді
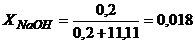 .
.
Задача 4. Обчисліть необхідну кількість силікованадію, який вміщує 48% Ванадію, для отримання 10т сталі із вмістом Ванадію 1,5%.
Розв’язування. Розрахуємо кількість Ванадію, що вміщується в 10т сталі із вмістом Ванадію 1,5%, з відповідної пропорції
100т сталі вміщує 1,5т Ванадію,
10т сталі вміщує Х т Ванадію.
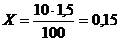 т=
т= 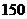 кг.
кг.
Кількість силікованадію, що вміщуватиме 150кг Ванадію, знаходимо з наступної пропорції
100кг силікованадію містить 48кг Ванадію,
Хкг силікованадію містить 150кг Ванадію.
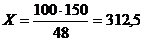 кг.
кг.
Задача 5. Обчисліть масову частку (%) і моляльність розчину, отриманого шляхом змішування 200мл 50%-го розчину сульфатної кислоти густиною 1,4г/мл з 2л 10,6%-го розчину сульфатної кислоти густиною 1,07г/мл.
Розв’язування. Визначимо масу 50%-го і 10,6%-го розчинів H2SO4 за рівнянням 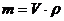
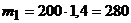 г;
г; 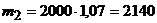 г.
г.
Тоді загальна маса отриманого розчину становитиме
 г.
г.
Розрахуємо вміст H2SO4 в 50%-му і 10,6%-му розчинах за рівняннями
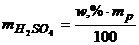 ,
,
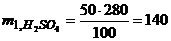 г,
г,
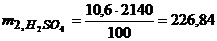 г.
г.
Загальна маса кислоти в отриманому розчині дорівнюватиме
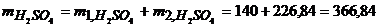 г.
г.
Масову частку H2SO4 у відсотках розрахуємо за рівнянням (1.10)
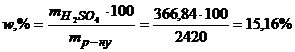 .
.
Для розрахунку моляльності отриманого розчину знайдемо масу води за рівнянням
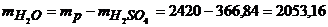 г=
г= 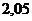 кг.
кг.
Моляльність отриманого розчину обчислимо за рівнянням (1.7)
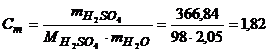 моль/кг.
моль/кг.
Задачі для самостійної роботи
1. Обчисліть, скільки грамів калій гідроксиду вміщує 200мл 0,092н розчину?
2. Визначте об’єм 56%-го розчину сульфатної кислоти густиною 1,46г/мл, який потрібен для приготування 5л 2н розчину.
3. Розрахуйте, скільки мілілітрів 2н розчину Натрій карбонату треба для приготування 250мл 0,35н водного розчину Na2CO3?
4. 1л насиченого розчину CaSO4 вміщує 2г солі. Знайдіть молярну, моляльну концентрації та масову частку (%) розчину. Прийняти ρ=1г/мл.
5. Визначте кількість грамів сульфатної кислоти в 100мл 5М розчину густиною 1,29г/мл.
6. Обчисліть масову частку (%) і мольну частку 5М розчину сульфатної кислоти густиною 1,29г/мл.
7. Розрахуйте масову частку (%) розчину сульфатної кислоти, отриманого шляхом змішування 200мл 5М розчину H2SO4 густиною 1,29г/мл з 350мл води.
8. Визначте масову частку (%) і титр розчину після розчинення 100мл 8,8М розчину фосфатної кислоти густиною 1,425г/мл в 400мл води.
9. Обчисліть моляльність і масову частку (%) 10М розчину ортофосфатної кислоти густиною 1,48г/мл.
10. Розрахуйте нормальність і титр розчину, отриманого при розчиненні 14,6г гідроген хлориду в 200мл води за нормальних умов.
11. Визначте масову частку (%) і молярність розчину сульфатної кислоти, моляльність якої дорівнює 72,7моль/кг. Густина розчину – 1,8г/мл.
12. Розрахуйте масову частку (%) і титр HCI за сріблом, якщо молярна концентрація хлоридної кислоти дорівнює 12,11моль/л, а густина розчину -1,185г/мл.
13. Розрахуйте масову частку (%) розчину, отриманого шляхом змішування 40мл 12,11М розчину хлоридної кислоти густиною 1,185г/мл з 500мл води.
14. Обчисліть кількість мілілітрів 10М розчину ортофосфатної кислоти густиною 1,485г/мл, необхідну для одержання 3л 10%-го розчину густиною 1,055г/мл.
15. Визначте масову частку (%) і моляльність 7М розчину хлорної кислоти густиною 1,41г/мл.
16. Визначте молярність і моляльність 45%-го розчину калій гідроксиду густиною 1,45г/мл.
17. Розрахуйте молярність і титр розчину, отриманого шляхом змішування 20мл 30%-го розчину натрій гідроксиду густиною 1,33г/мл з 250мл води.
18. Обчисліть молярність і мольну частку 14%-го розчину Натрій карбонату густиною 1,145г/мл.
19. Визначте, скільки грамів Натрій хлориду і води необхідно для приготування 5л фізиологічного розчину (3% розчин NaCI).
20. Знайдіть масову частку (%) розчину, одержаного при змішуванні 70мл 70%-го розчину нітратної кислоти густиною 1,415г/мл з 1000мл 3%-го розчину нітратної кислоти густиною 1,1г/мл.
21. Розрахуйте необхідну кількість феромангану, який вміщує 35% Мангану, для одержання 100т сталі з вмістом Мангану 2%.
22. Обчисліть, скільки грамів ZnSO4∙7H2O потрібно для приготування 200мл 0,5н розчину за Zn?
23. Обчисліть, скільки грамів СuSO4∙5H2O потрібно для приготування 10л 3%-го розчину за Сu?
24. Розрахуйте молярність і мольну частку розчину, одержаного при змішуванні 70мл 70%-го розчину нітратної кислоти густиною 1,415г/мл з 1000 3%-го розчину HNO3 густиною 1,1г/мл.
25. Визначте титр і масову частку (%) 2,3М розчину ортофосфатної кислоти густиною 1,115г/мл.
26. Визначте мольну частку і молярність 20,25%-го розчину ортофосфатної кислоти густиною 1,115г/мл.
27. Обчисліть масову частку (%) розчину, одержаного в результаті розчинення 30г SO3 в 200мл H2O за нормальних умов.
28. Розрахуйте молярність і масову частку (%) розчину, одержаного при розчиненні 44,8л аміаку за нормальних умов в 200мл води.
29. Визначте молярність і масову частку (%) розчину, одержаного при розчиненні 34г аміаку за нормальних умов в 200мл води.
30. Розрахуйте, скільки мілілітрів 70%-го розчину сульфатної кислоти густиною 1,61г/мл і 10,56%-го розчину сульфатної кислоти густиною 1,07г/мл необхідно взяти для приготування 1,5кг 25%-го розчину сульфатної кислоти густиною 1,178г/мл?
Дата добавления: 2018-04-05; просмотров: 1606; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
