Влияние температуры на скорость реакции
ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика - раздел физической химии, посвящённый закономерностям протекания химических процессов во времени. Одной из задач химической кинетики является количественное описание протекания химических реакций во времени при постоянной температуре в зависимости от концентраций реагирующих веществ. Этот раздел химической кинетики называется формальной кинетикой.
В общем виде химическую реакцию можно записать следующим образом:
n1 А1 + n2 А2 + ... + nn An = n1¢A1¢ + n2¢A2¢ + ... + nn¢An¢ .
Скоростью химической реакции называется количество молекул данного сорта, реагирующих в единицу времени в единице объёма. Для определения скорости химической реакции достаточно знать изменение во времени количества одного из участвующих в реакции веществ (исходного или конечного), так как изменение количества всех остальных веществ можно определить из уравнения реакции. Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора, а также (в частных случаях) и от ряда других факторов, которые будут рассмотрены при решении задач на конкретных примерах.
Химические реакции редко протекают в одну стадию, так как их принято записывать. Запись уравнения реакции можно рассматривать как символическое выражение материального баланса (закона сохранения вещества). В действительности подавляющая часть химических реакций протекает через ряд промежуточных стадий, и в большинстве случаев детальный механизм протекания реакции нам неизвестен из-за больших трудностей выявления промежуточных продуктов. Скорость суммарной реакции определяется скоростью наиболее медленной стадии, которая называется лимитирующей или замедленной.
|
|
|
Еще в самом начале исследований по химической кинетике было сделано физически очевидное предположение, что реагируют только те молекулы, которые сталкиваются. Как известно, число столкновений прямо пропорционально числу молекул, поэтому скорость реакции должна быть пропорциональна концентрации реагирующих веществ. В общем случае можно принять, что скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ в некоторых степенях:
v = k 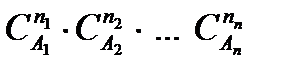 , [v] = моль/(м3×с) или молекул/(м3×с) ;
, [v] = моль/(м3×с) или молекул/(м3×с) ;
вышеприведенное выражение называют основным постулатом химической кинетики. Здесь
k - константа скорости химической реакции, k зависит: 1) от природы реакции; 2) от температуры; 3) от наличия катализатора;
ni - порядок реакции по данному веществу; в общем случае порядки реакции по веществам никак не связаны со стехиометрическими коэффициентами ni этих веществ в уравнении реакции, и только в тех случаях, когда реакция протекает в одну стадию, порядок реакции ni по данному веществу совпадает со стехиометрическим коэффициентом ni данного вещества в химическом уравнении (химические реакции, протекающие в одну стадию, являются чрезвычайно редкими, например, разложение и синтез HJ, разложение NO2 и некоторые другие); порядок ni может быть положительным или отрицательным, целым или дробным. Сумма показателей степеней n1 + n2 + ¼ + nn определяет порядок реакции в целом.
|
|
|
Физический смысл коэффициента k : v = k , если 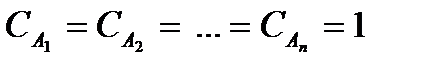 , то есть константа скорости химической реакции есть скорость реакции при условии, что концентрации реагирующих веществ равны 1; k иногда называют удельной скоростью химической реакции. Размерность константы скорости зависит от порядка реакции.
, то есть константа скорости химической реакции есть скорость реакции при условии, что концентрации реагирующих веществ равны 1; k иногда называют удельной скоростью химической реакции. Размерность константы скорости зависит от порядка реакции.
Скорость реакции является функцией времени, так как количества реагирующих веществ меняются во времени. Введем понятие средней скорости реакции:
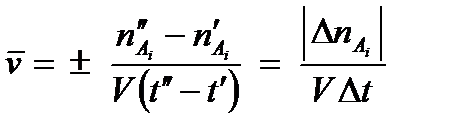 ,
,
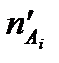 и
и  - число молей одного из веществ в начальный t¢ и конечный t¢¢ моменты времени; V - объем системы. Знак «-» в выражении стоит тогда, когда мы следим за ходом реакции по изменению количества одного из исходных веществ, поскольку в этом случае
- число молей одного из веществ в начальный t¢ и конечный t¢¢ моменты времени; V - объем системы. Знак «-» в выражении стоит тогда, когда мы следим за ходом реакции по изменению количества одного из исходных веществ, поскольку в этом случае 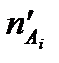 >
>  , а скорость реакции может быть только положительной величиной. Знак «+» используют, если скорость реакции определяют по ее продукту.
, а скорость реакции может быть только положительной величиной. Знак «+» используют, если скорость реакции определяют по ее продукту.
|
|
|
Если V = const, то 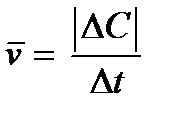 .
.
Этим уравнением удобно пользоваться при рассмотрении реакций в растворах, так как изменением объема раствора в результате реакции во многих случаях можно пренебречь.
Если мы знаем значения концентраций реагирующих веществ в определенный момент времени, то по основному постулату химической кинетики можем рассчитать скорость реакции в данный момент времени; такая скорость называется истинной скоростью реакции (естественно, нам должна быть известна величина константы скорости реакции). Истинная скорость в начальный момент времени называется начальной скоростью реакции. Следует помнить, что величина константы скорости реакции не зависит ни от времени, ни от концентраций реагирующих веществ!
Для реакций, протекающих в газовой фазе, скорость можно определять также через парциальные давления веществ.
Следует иметь в виду, что при вышеприведенном определении скорости химической реакции (число молекул, реагирующих в единицу времени в единице объема) числовое значение величины скорости реакции будет зависеть от того, какое вещество из участвующих в реакции мы выбрали, чтобы следить за ее скоростью, так как стехиометрические коэффициенты разных участников реакции могут отличаться друг от друга. Например, в реакции синтеза бромоводорода
|
|
|
Н2 + Br2 = 2HBr
за одно и то же время образуется в 2 раза большее число молей HBr, чем прореагирует молей Н2 и Br2 , и, следовательно, скорость реакции, определенная по бромоводороду, будет в 2 раза выше, чем скорость, определенная по водороду либо по брому:
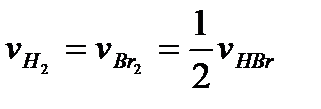 .
.
Чтобы устранить эту неопределенность, скорость реакции рассчитывают на единицу стехиометрического коэффициента, и тогда ее величина не зависит от того, по какому веществу ее определяют:
 .
.
Влияние температуры на скорость реакции
Скорость большинства реакций увеличивается с ростом температуры, так как при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения – правило Вант-Гоффа и уравнение Аррениуса.
Правило Вант-Гоффа: при повышении температуры на 10оС скорость реакции возрастает в 2–4 раза. Для характеристики зависимости скорости химической реакции от температуры был введен температурный коэффициент скорости реакции
g = 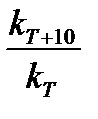 ,
,
где kT+10 и kT – константы скорости химической реакции при температуре Т+10 и Т. Пользуясь температурным коэффициентом скорости реакции, можно рассчитывать константы скоростей при различных температурах:
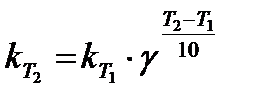
или 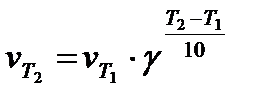 .
.
При использовании последнего выражения (через скорости химической реакции) следует помнить, что сравнивать скорости реакции при различных температурах мы можем только при одинаковых концентрациях реагирующих веществ. Это следует из основного постулата химической кинетики. Отношение скоростей реакции при двух температурах можно в общем виде записать следующим образом:
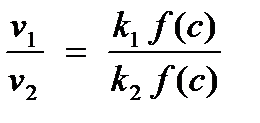 .
.
Если реакцию проводят так, что концентрации участников при двух температурах одинаковы, то именно тогда
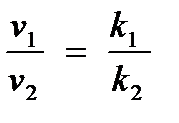 .
.
Для удобства расчета выражения можно прологарифмировать и пользоваться формулой
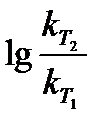 =
= 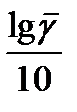 (T2 – T1) ,
(T2 – T1) ,
где 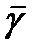 – средний температурный коэффициент в интервале температур Т1 ÷ Т2.
– средний температурный коэффициент в интервале температур Т1 ÷ Т2.
Такая оценка зависимости скорости реакции от температуры носит весьма приближенный характер, применима только в очень ограниченном интервале температур и потому имеет малую практическую ценность. Более обоснованную зависимость константы скорости реакции от Т можно получить с помощью уравнения Аррениуса. Уравнение Аррениуса, записанное для интервала температур Т1 ÷ Т2 , имеет вид
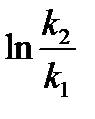 =
=  =
= 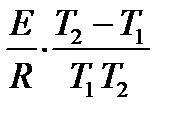 ,
,
где k2 – константа скорости химической реакции при температуре Т2 , k1 – то же при Т1.
Это уравнение (как и правило Вант-Гоффа) характеризует зависимость константы скорости химической реакции от температуры. Величина Е имеет размерность энергии и носит название энергии активации. Энергию активации можно определить как тот избыток энергии по сравнению со средней энергией молекул при данной температуре, которой должны обладать молекулы, чтобы они могли вступить в химическую реакцию. Для большинства реакций между валентнонасыщенными молекулами энергия активации составляет 50-100 кДж/моль.
Т.о., зная величину константы скорости реакции при одной температуре, можно вычислить ее величину при другой Т, если нам известна энергия активации реакции в данном интервале температур.
Артемов А.В. «Тесты по химии. Общая и неорганическая химия. ЕГЭ»
Разбирать тесты №1-10 по Теме 6 «Химическая кинетика и химическое равновесие» (стр. 138)
ВОПРОСЫ ПО ТЕМЕ
Скорость химической реакции
1. От каких факторов зависит скорость реакции? Приведите примеры.
2. Почему скорость многих химических реакций с течением времени уменьшается? Приведите примеры, когда скорость реакций с течением времени увеличивается. Может ли скорость реакции в течение достаточно большого промежутка времени оставаться постоянной, если это не состояние равновесия?
3. Могут ли отличаться скорости прямой и обратной реакций до достижения равновесия?
4. В растворе протекает химическая реакция по уравнению А + В = С. Как изменится ее скорость, если: 1) концентрацию А увеличить в 2 раза, оставив концентрацию В прежней; 2) концентрацию В увеличить в 2 раза, оставив концентрацию А прежней; 3) концентрации обоих веществ увеличить в 2 раза; 4) концентрацию одного из веществ увеличить в 2 раза, а другого – уменьшить в 2 раза; 5) увеличить в 2 раза давление на реагирующую смесь, предполагая, что реагируют газообразные вещества?
5. Почему вещества горят в кислороде значительно интенсивнее, чем на воздухе?
6. Изменится ли скорость реакции между водородом и кислородом, если в их смесь, сохранив условия (какие?), ввести азот? Ответ поясните.
7. Смесь водорода с кислородом можно хранить при обычной температуре неопределенно долго. Можно ли сказать, что здесь достигнуто состояние химического равновесия?
8. Может ли степень измельчения взятых веществ влиять на скорость их взаимодействия? Приведите примеры, в т.ч. бытовые.
Дата добавления: 2018-04-05; просмотров: 341; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
