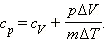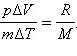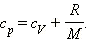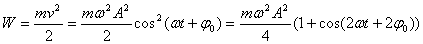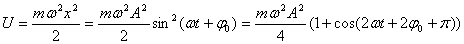Упругие и неупругие столкновения
 Абсолютно неупругий удар – столкновение двух тел, в результате которого они соединяются и далее двигаются как одно целое.
Абсолютно неупругий удар – столкновение двух тел, в результате которого они соединяются и далее двигаются как одно целое.
Два шара  ,
, 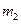 с
с 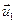 и
и 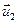 испытывают абсолютно неупругий дар друг с другом. По закону сохранения импульса
испытывают абсолютно неупругий дар друг с другом. По закону сохранения импульса  . Отсюда скорость после соударения
. Отсюда скорость после соударения 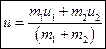 . Кинетические энергии до и после удара:
. Кинетические энергии до и после удара: 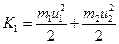 и
и 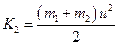 . Найдем разность
. Найдем разность
 ,
,
где 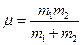 – приведенная масса шаров. Отсюда видно, что при абсолютно неупругом столкновении двух шаров происходит потеря кинетической энергии макроскопического движения. Эта потеря равна половине произведения приведенной массы на квадрат относительной скорости.
– приведенная масса шаров. Отсюда видно, что при абсолютно неупругом столкновении двух шаров происходит потеря кинетической энергии макроскопического движения. Эта потеря равна половине произведения приведенной массы на квадрат относительной скорости.
Абсолютно упругий удар – столкновение двух тел, в результате которого механическая энергия системы остается прежней.
Два шара  ,
, 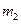 с
с 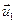 и
и 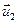 до соударения и
до соударения и  и
и  после. По закону сохранения импульса и энергии:
после. По закону сохранения импульса и энергии: 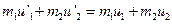 ,
,  . Решением системы может стать
. Решением системы может стать 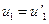 и
и 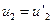 . Это значит, что шары не встретились. Потребуем
. Это значит, что шары не встретились. Потребуем 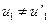 и
и 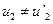 и перепишем уравнения в виде:
и перепишем уравнения в виде: 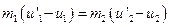 ,
, 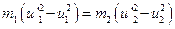 . Второе уравнение делим почленно на первое и получаем
. Второе уравнение делим почленно на первое и получаем 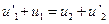 . Решаем систему из двух линейных уравнений и имеем:
. Решаем систему из двух линейных уравнений и имеем: 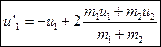 ,
, 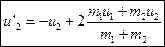 .
.
2) Применение первого закона термодинамики к изопроцессам идеального газа.
| | ||||||||||||||
Первый закон термодинамики позволяет вычислить изменение параметров идеального газа при тепловых и механических процессах.
Так, если в газе протекают изопроцессы, первый закон термодинамики может быть записан в частном виде.
При изотермическом процессе изменения внутренней энергии в идеальном газе не происходит и все подводимое к газу количество теплоты идет на совершение им работы.
При изохорном процессе объем газа остается постоянным. Соответственно, не совершается работа и внутренняя энергия газа изменяется исключительно за счет теплообмена с окружающей средой.
(Индекс V означает, что процесс протекает при постоянном объеме). Если при теплообмене происходит изменение температуры газа на ΔT, то QV = cVmΔT. cV – удельная теплоемкость газа при постоянном объеме. Подставляя это выражение в уравнение первого закона термодинамики для изохорного процесса, имеем: ΔU = cVmΔT. С другой стороны, для одноатомного идеального газа Приравняв правые части уравнений и произведя соответствующие преобразования, имеем: При изобарном процессе изменение внутренней энергии газа происходит как за счет теплообмена, так и за счет совершения механической работы. Если к газу подводится некоторое количество теплоты, то оно частично расходуется на увеличение внутренней энергии газа, частично на совершение газом работы при его расширении.
(Индекс p означает, что процесс протекает при постоянном давлении).
Давление газа остается постоянным за счет соответствующего изменения объема. Так как ΔU = QV, то Qp = QV + pΔV. Таким образом оказывается, что для повышения температуры газа на одно и то же количество градусов при постоянном давлении надо сообщить ему большее количество теплоты, чем при постоянном объеме, так часть теплоты расходуется на совершение работы. Если обозначить удельную теплоемкость при постоянном давлении cp, то первый закон термодинамики для изобарного процесса примет вид: Из уравнения Менделеева–Клапейрона следует, что Таким образом, С учетом того, что Наряду с удельными теплоемкостями газа при постоянном объеме и постоянном давлении cV и cp, можно ввести молярные теплоемкости CV = cVM при постоянном объеме и Cp = cpM при постоянном давлении. Сделав это, имеем: Cp = CV + R. Полученное уравнение носит название уравнения Майера. Кроме рассмотренных, возможен еще вариант, когда термодинамическая система не обменивается теплотой с окружающей средой. Процесс, происходящий при этом с газом, называется адиабатным. При адиабатном процессе работа совершается газом за счет убыли его внутренней энергии, либо наоборот, за счет совершения над газом работы, увеличивается его внутренняя энергия. Q = 0; A = –ΔU.
Адиабатный процесс и его результаты можно пронаблюдать с помощью следующих опытов. Бутылку из светлого стекла закрепим в штативе и закроем пробкой, сквозь которую пропущена трубка. На трубку надет шланг, соединенный с нагнетающим насосом. Будем увеличивать давление воздуха в бутылке до тех пор, пока из нее не будет выбита пробка. Газ, расширяясь, совершает работу. В результате этого его внутренняя энергия уменьшается, соответственно, падает и температура. Об уменьшении температуры газа можно судить по появлению в сосуде тумана.
Насыпем в запаянный с одного конца прозрачный цилиндр легковоспламеняющееся вещество. В качестве такого вещества используется одна раздавленная в пыль головка от спички. Вставим в цилиндр поршень. При резком сжатии газа, находящегося в цилиндре, его внутренняя энергия повышается, соответственно, повышается и температура. Это приводит к воспламенению горючего вещества. |
БИЛЕТ-16
1) Время затухания колебаний. Логарифмический декремент затухания.
Свободные колебания технических систем в реальных условиях протекают, когда на них действуют силы сопротивления. Действие этих сил приводит к уменьшению амплитуды колеблющейся величины.
|
|
|
Колебания, амплитуда которых из-за потерь энергии реальной колебательной системы уменьшается с течением времени, называются затухающими.
Наиболее часто встречается случаи, когда сила сопротивления пропорциональна скорости движения

где r - коэффициент сопротивления среды. Знак минус показывает, что FC направлена в сторону противоположную скорости.
Запишем уравнение колебаний в точке, колеблющийся в среде, коэффициент сопротивлений которой r. По второму закону Ньютона
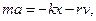
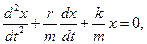
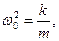
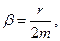
где β - коэффициент затухания. Этот коэффициент характеризует скорость затухания колебаний, При наличии сил сопротивления энергия колеблющейся системы будет постепенно убывать, колебания будут затухать.
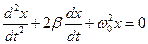
- дифференциальное уравнение затухающих колебаний.
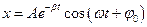
- уравнение затухающих колебаний.
ω – частота затухающих колебаний:
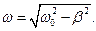
Период затухающих колебаний:

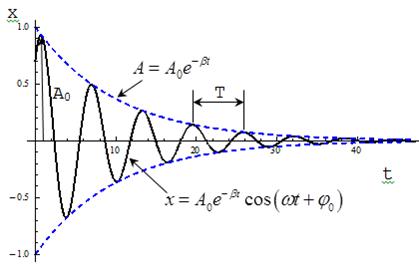 Затухающие колебания при строгом рассмотрении не являются периодическими. Поэтому о периоде затухаюших колебаний можно говорить, когда β мало.
Затухающие колебания при строгом рассмотрении не являются периодическими. Поэтому о периоде затухаюших колебаний можно говорить, когда β мало.
Если затухания выражены слабо (β→0), то 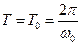 . Затухающие колебания можно
. Затухающие колебания можно
рассматривать как гармонические колебания, амплитуда которых меняется по экспоненциальному закону
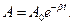
В уравнении (1) А0 и φ0 - произвольные константы, зависящие от выбора момента времени, начиная е которого мы рассматриваем колебания
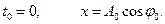
Рассмотрим колебание в течение, некоторого времени τ, за которое амплитуда уменьшится в е раз


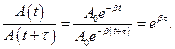

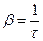
τ - время релаксации.
Коэффициент затихания β обратно пропорционален времени, в течение которого амплитуда уменьшается в е раз. Однако коэффициента затухания недостаточна для характеристики затуханий колебаний. Поэтому необходимо ввести такую характеристику для затухания колебаний, в которую входит время одного колебаний. Такой характеристикой является декремент (по-русски: уменьшение) затуханияD, который равен отношению амплитуд, отстоящих по времени на период:
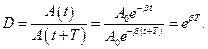
Логарифмический декремент затухания равен логарифму D:

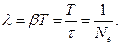
Логарифмический декремент затухания обратно пропорционален числу колебаний, в результате которых амплитуда колебаний уменьшилась в ераз. Логарифмический декремент затухания - постоянная для данной системы величина.
Еще одной характеристикой колебательной система является добротность Q.

Добротность пропорциональна числу колебаний, совершаемых системой, за время релаксации τ.
Добротность Q колебательной системы является мерой относительной диссипации (рассеивания) энергии.
Добротность Q колебательной системы называется число, показывающее во сколько раз сила упругости больше силы сопротивления.
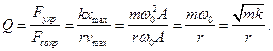
Чем больше добротность, тем медленнее происходит затухание, тем затухающие колебания ближе к свободным гармоническим.
2) Работа, совершаемая идеальным газом, при различных процессах. Графическое изображение процессов.
Если известна для некоторого обратимого процесса зависимость давления газа от объема, т. е. функция p=f(V), то работа, совершаемая в ходе этого процесса, вычисляется путем интегрирования:
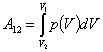
| (51.1) |
где V1 и V2 – объем газа в начальном и конечном состояниях.
Рассмотрим 4 процесса: изохорный, изобарный, изотермический и адиабатический.
1. m=const; V=const; - изохорный процесс. d¢А=p(V)dV=0;

| (51.2) |
В ходе изохорного (изохорического) процесса работа равна 0,это справедливо не только для идеального газа, но и вообще для всякого тела, т.к. приращение объёма dV=0.
Рис. 51.1 
2. m=const; P=const - изобарный процесс.
Тогда при интегрировании (по формуле 51.1) постоянное давление можно вынести из-под знака интеграла:
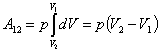
| (51.3) |
Эта формула справедлива для любого тела. Если известен график зависимости Р=f(V), то величину работы в изобарном процессе можно найти графически, она численно равна площади заштрихованного прямоугольника, см рис51.2
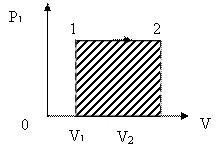
Рис. 51.2
3. T=const. Изотермический процесс.
Но из уравнения Менделеева – Клапейрона следует:

| (51.4) |
Подставим (51.4) в (51.1), получим:
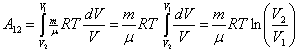
| (51.5) |
но 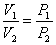 из закона Бойля – Мариотта, тогда
из закона Бойля – Мариотта, тогда
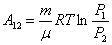
| (51.6) |
или
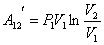
| (51.6) |

Рис. 51. 3.
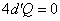 Адиабатный процесс.
Адиабатный процесс.
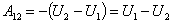
| (51.7) |
Работа в адиабатном процессе совершается за счёт убыли внутренней энергии идеального газа.
Запишем выражения для внутренней энергии идеального газа для состояний 1 и 2:
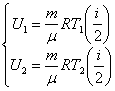
| (51.8) |
Подставив значения внутренней энергии для состояний 1 и 2 в соотношение (51.7) получим формулу для расчёта работы в адиабатном процессе:
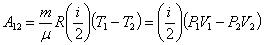
| (51.9) |
Используя формулу связи между числом степеней свободы и показателем адиабаты для идеального газа преобразуем формулу для расчёта работы газа в адиабатном процессе таким образом:
Т.к.  ;
; 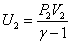 ; U2=(P2 V2)/(g-1), тогда
; U2=(P2 V2)/(g-1), тогда
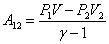
| (51.10) |
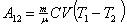
|
БИЛЕТ-17
1) Энергия гармонических колебаний.
При механических колебаниях колеблющееся тело (или материальная точка) обладает кинетической и потенциальной энергией. Кинетическая энергия тела W:
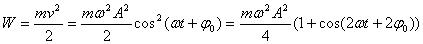
(Скорость тела v = ds/dt)
Для вычисления потенциальной энергии тела воспользуемся самой общей формулой, связывающей силу и потенциальную энергию тела в поле этой силы:
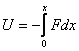
где U - потенциальная энергия, набираемая (или теряемая) телом, движущимся в силовом поле F от точки 0 (точки, в которой потенциальная энергия принимается равной 0) до точки х.
Для силы, линейно зависящей от смещения (как в случае наших механических маятников, такие силы носят общее название квазиупругих сил) мы имеем:
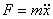

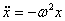

| для кинетической и потенциальной энергии механического маятника, можно сделать следующие выводы: |
1. Полная механическая энергия тела не изменяется при колебаниях: 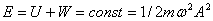
2. Частота колебаний кинетической и потенциальной энергии в 2 раза больше частоты колебаний маятника.
3. Колебания кинетической и потенциальной энергии сдвинуты друг относительно друга по фазе на p (на полпериода). Когда кинетическая энергия достигает максимума, потенциальная - минимума (нуля) и наоборот. Энергия при колебаниях постоянно перекачивается из потенциальной в кинетическую и обратно.
В случае электрических колебаний энергия в конуре представляет собой сумму энергии электрического поля, запасенной между обкладками конденсатора, и энергии магнитного поля, запасенной в катушке с индуктивностью. Вычислим обе составляющие.
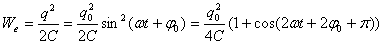
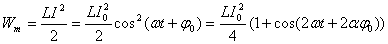
Сравнивая эти формулы, можно сделать следующие выводы:
1. Полная энергия в контуре остается неизменной: 
2. Частота колебаний энергий в 2 раза превосходит частоту колебаний заряда и тока в контуре.
3. Электрическая и магнитная энергии сдвинуты по фазе на полпериода друг относительно друга; происходит непрерывное перекачивание энергии из одной формы в другую и обратно.
Поскольку в контуре происходят колебания электрической и магнитной энергий, электрический колебательный контур также называют электромагнитным.
2) Число степеней свободы молекул. Закон равномерного распределения энергии по степеням свободы.
Важной характеристикой термодинамической системы является ее внутренняя энергия U — энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия — однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
Нами было введено понятие числа степеней свободы: это число независимых переменных (координат), полностью определяющих положение системы в пространстве. В ряде задач молекулу одноатомного газа (рис. 77, а) рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать (r ® 0, J = mr2® 0, Tвр=Jw2/2®0).
В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис. 77, б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i = 5). Трехатомная (рис. 77, я) и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 значения <e0> в (43.8):
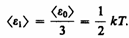
В классической статистической физике выводитсязакон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT.Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы
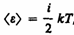
где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:
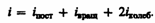
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равнасумме кинетических энергий Na молекул:
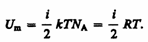 (50.1)
(50.1)
Внутренняя энергия для произвольной массы т газа.
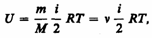
где М — молярная масса, n — количество вещества.
БИЛЕТ-18
1) Закон импульса. Закон сохранения момента импульса
Моментом импульса называется векторная величина, характеризующая инерционные свойства объекта, осуществляющего вращательное движение относительно определенной точки (начала координат).
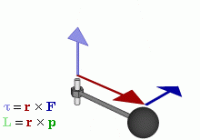
Определение
Моментом импульса материальной точки относительно начала координат в классической механике есть величина, равная векторному произведению радиус-вектора на ее импульс.
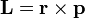
Соответственно,
В системе из многих материальных точек, то момент импульса начала координат является суммой (интегралом) всех моментов импульса составляющих системы.
Закон сохранения момента импульса: момент импульса замкнутой системы тел относительно любой неподвижной точки не изменяется с течением времени.
Это один из фундаментальных законов природы.
Аналогично для замкнутой системы тел, вращающихся вокруг оси z:
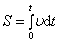 отсюда
отсюда 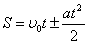 или
или  .
.
Если момент внешних сил относительно неподвижной оси вращения тождественно равен нулю, то момент импульса относительно этой оси не изменяется в процессе движения.
Момент импульса и для незамкнутых систем постоянен, если результирующий момент внешних сил, приложенных к системе, равен нулю.
2) Энтропия идеального газа
Понятие энтропия было введено в науку в середине 19 века. От греческого entropia -- поворот, превращение. Понятие энтропии впервые было введено в термодинамике для определения меры необратимого рассеяния энергии. Функция состояния термодинамической системы...
КЛАУЗИУСА НЕРАВЕНСТВО -неравенство, выражающее теорему термодинамики: для кругового процесса
3) 
4) где 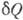 - кол-во теплоты, сообщаемое системе (или отводимое от неё) на бесконечно малом участке цикла, Т _ абс. темп-pa соответствующего элемента среды. Кол-во теплоты
- кол-во теплоты, сообщаемое системе (или отводимое от неё) на бесконечно малом участке цикла, Т _ абс. темп-pa соответствующего элемента среды. Кол-во теплоты 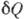 , сообщаемое системе, считается положительным, отводимое от неё - отрицательным. Необратимому (хотя бы на одном участке) циклу соответствует неравенство, циклу, состоящему только из обратимых процессов,- знак равенства (равенство Клаузиуса). Величина
, сообщаемое системе, считается положительным, отводимое от неё - отрицательным. Необратимому (хотя бы на одном участке) циклу соответствует неравенство, циклу, состоящему только из обратимых процессов,- знак равенства (равенство Клаузиуса). Величина  наз. элементарной приведённой теплотой. К. н. даёт количеств. формулировку второго начала термодинамики.
наз. элементарной приведённой теплотой. К. н. даёт количеств. формулировку второго начала термодинамики.
5) К. н. установлено в 1850 Р. Клаузиусом с помощью Карно теоремы о максимальности кпд цикла Карно, т. к. любой круговой процессможно рассматривать как предел большого числа элементарных циклов Карно и, следовательно, для него 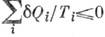 , где
, где  - кол-во теплоты, сообщаемое (отводимое) в i-м элементарном цикле Карно при темп-ре Ti .
- кол-во теплоты, сообщаемое (отводимое) в i-м элементарном цикле Карно при темп-ре Ti .
6) Из равенства Клаузиуса следует, что 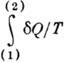 не зависит от формы пути и 1/T есть интегрирующий множитель для
не зависит от формы пути и 1/T есть интегрирующий множитель для  . Это означает существование такой ф-ции состояния S, названной Клаузиусом энтропией, что
. Это означает существование такой ф-ции состояния S, названной Клаузиусом энтропией, что 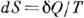 . Для необратимого процесса из (*) следует, что
. Для необратимого процесса из (*) следует, что
7) 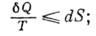
8) это неравенство также наз. К. н. Наряду с 1-м началом термодинамики К. н. может быть положено в основу построения термодинамики.
БИЛЕТ-19
1) Законы динамики. Инерциальные системы отсчета.
Дата добавления: 2018-04-04; просмотров: 467; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

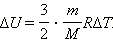
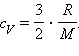
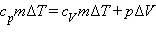 или:
или: