Иммобилизация за счёт образования ковалентных связей между ферментом и носителем
Основы роста и культивирования микроорганизмов. Поверхностный и глубинный способы культивирования продуцентов. Периодическая культура, фазы роста и размножения. Периодический и непрерывный методы культивирования микроорганизмов.
Стадия культивирования микроорганизмов является наиболее сложной и ответственной.
Рост и культивирование биомассы требуют следующих условий:
•жизнеспособности посевного материала;
•наличия источника энергии (тепла);
• достаточного количества соответствующей питательной среды;
• необходимых физико-химических условий для жизнедеятельности.
С начала 1950-х гг. вирус полиомиелита для производства вакцины выращивали в культуре клеток млекопитающих, в том числе фибробла-стов эмбриона человека. С тех пор фибробласты эмбриона стали незаменимы для выделения и выращивания ряда других вирусов, при производстве высокоспецифичных белков (антител, интерферонов), в исследованиях рака и противовирусной химиотерапии.
Культуры, приготовленные непосредственно из тканей организма (эмбриональных или тканей новорожденных), называют первичными культурами. В большинстве случаев клетки первичной культуры переносят из культуральной чашки и используют для получения большого количества вторичных культур, которые можно последовательно перевивать в течение недель или месяцев. Разные типы клеток нуждаются в различных питательных веществах, а также в одном или нескольких белковых факторах роста.
|
|
|
Клеточные линии можно использовать для получения клонов, которые происходят из одной клетки-предшественника.
Биотехнология использует методы поверхностного и глубинного культивирования микроорганизмов.
При поверхностном культивировании (в монослое) суспензию клеток получают обработкой измельчённой ткани эмбриона трипсином. Клетки в такой суспензии, оседая на плотной поверхности сосуда с культуральной средой, становятся плоскими иделятся, образуя монослой на поверхности сосуда. Обычно при этом способе культивирования пользуются цилиндрическими бутылями, которые медленно вращаются вдоль своей длинной оси. Рост клеток и выход биомассы можно увеличить, добавив к суспензии носитель — микроскопические гранулы из инертного синтетического полимера, на которых клетки закрепляются и пролиферируют. Суспензионные культуры можно получать в сосудах объёмом до 1000 л при перемешивании.
Преобладающим является глубинный метод культивирования, предполагающий возможность использования всего объема питательной среды.
На рост и развитие микроорганизмов влияют внутри- и внеклеточные факторы. К внутриклеточным факторам относятся: структура клетки, механизмы метаболизма и генетические характеристики. Внеклеточные (внешние) факторы, т.е. условия внешней среды клетки, являются основными регуляторны.ми факторами биотехнологии.
|
|
|
Промышленное культивирование и очистка целевого продукта -процессы многоступенчатые. Общая схема ферментации представлена на рис. 8.
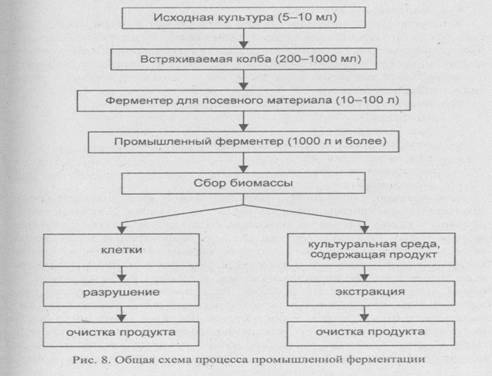
Процесс начинается с приготовления и стерилизации культуральной среды и оборудования. Вначале выращивают исходную культуру (5-10 мл), затем инкубируют ее во. встряхиваемой колбе (200-1000 мл), далее переносят в ферментер для посевного материала (10-100 л) и, наконец, в промышленный ферментер (1000-100000 л). По завершении ферментации выделяемый продукт находится в клетках или в культуральной среде, но не в обеих фракциях одновременно, поэтому дальнейшие манипуляции проводят с одной из этих фракций.
Микроорганизмы можно выращивать:
• в ферментере периодического действия;
• в ферментере периодического действия с добавлением субстрата;
• в непрерывной культуре.
В первом случае микроорганизмы выращивают в стерильных условиях без добавления в ходе ферментации свежей культуральной среды. При периодической ферментации состав культуральной среды, концентрация микроорганизмов (биомассы), количество белкового продукта или метаболита зависят от фазы роста, клеточного метаболизма и наличия питательных веществ.
|
|
|
Различают шесть основных фаз роста (рис. 9):
лаг-фаза (1);
фаза ускорения (2);
экспоненциальная или логарифмическая фаза (3);
фаза замедления (4);
стационарная фаза (5);
фаза отмирания (6).
Как правило, после инокуляции стерильной культуральной среды мгновенного увеличения числа клеток не наблюдается. В течение определенного периода времени, называемого лаг-фазой, клетки адаптируются к новым условиям (другим рН или концентрации питательных веществ). Продолжительность лаг-фазы зависит от времени, в течение которого клетки посевного материала находились в стационарной фазе, и от того, насколько различалась среда, в которой росла культура, от новой, свежей культуральной среды. Если посевным материалом служит культура, находящаяся в экспоненциальной фазе, выраженная лаг-фаза может отсутствовать и рост клеток начнется немедленно после инокуляции. Между лаг- и экспоненциальной фазами есть короткий период — фаза ускорения, когда скорость роста клеток увеличивается до достижения постоянной величины. В период экспоненциальной фазы клетки претерпевают несколько делений. Когда субстрат присутствует в избытке, достигается максимальная скорость роста культуры в экспоненциальной фазе, из-за большого числа клеток в конце экспоненциальной фазы субстрат расходуется очень быстро, наступает фаза замедления, которая может быть кратковременной. В результате истощения лимитирующего субстрата или накопления продуктов метаболизма, замедляющих рост, увеличение числа клеток постепенно прекращается
|
|
|
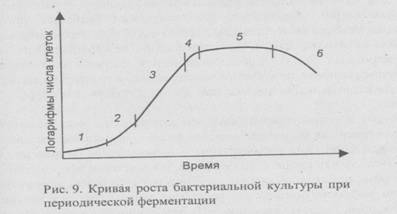
и культура переходит в стационарную фазу. В это время биомасса остается постоянной, метаболизм претерпевает кардинальные изменения, синтезируются соединения (вторичные метаболиты), представляющие коммерческий интерес, например антибиотики. Продолжительность стационарной фазы зависит от конкретного микроорганизма и условий роста. В фазе отмирания метаболизм прекращается, так как энергетические запасы клеток оказываются исчерпанными. При промышленном синтезе, еще до наступления фазы отмирания, ферментацию останавливают.
Периодическая культура с добавлением субстрата предполагает периодическое внесение в ферментер увеличивающегося количества питательных веществ. При этом культуральную среду не удаляют до окончания процесса. Периодическое добавление субстрата приводит к удлинению экспоненциальной и стационарной фаз, к увеличению биомассы и количества метаболитов, синтезируемых во время стационарной фазы. Для обеспечения непрерывного синтеза рекомбинантного белка и его стабильности необходим тщательный контроль процесса и добавление субстрата (источника углерода, азота, витаминов, микроэлементов и др. БАВ) тотчас, как в этом возникает необходимость.
В зависимости от генотипа микроорганизма и природы рекомби-нантного белка периодическая ферментация с добавлением субстрата может повысить выход готового продукта на 25-1000% по сравнению с простой периодической ферментацией.
Периодическая ферментация с добавлением субстрата используется также для культивирования клеток млекопитающих и насекомых; эти культуры широко применяют для получения белковых продуктов, имеющих медицинское значение, кроме того, без периодического добавления субстрата, клетки млекопитающих неэффективно синтезируют чужеродные белки. Для периодической ферментации характерны небольшие различия во времени сбора клеток, который проводят, начиная с середины экспоненциальной фазы, и заканчивают ее поздним этапом.
Однако в стационарной фазе микроорганизмы часто синтезируют протеолитические ферменты - протеиназы, разрушающие производимые белки; если цель ферментации - получение белковых продуктов, нужно остановить процесс до перехода его в стационарную фазу. Определяя время добавления следующей порции субстрата, используют показатели, коррелирующие с его расходом: количество синтезированных органических кислот, значение рН или количество образовавшегося СО2. Конечный продукт собирают по завершении процесса.
При непрерывной ферментации свежая культуральная среда поступает в ферментер непрерывно, параллельно отводится такой же объем клеточной суспензии. Таким образом, убыль числа клеток (удаление продукта) уравновешивается их увеличением в результате деления. При этом жестко контролируют скорость притока культуральной среды и постоянный объем культуры в биореакторе.
Следует заметить, что в промышленных целях непрерывная ферментация применяется реже, хотя стоимость получения определенного количества биомассы в ферментере непрерывного действия существенно ниже, чем в биореакторе, работающем в периодическом режиме. Это удешевление обусловлено следующим:
-при непрерывной ферментации нужны не столь громоздкие биореакторы и оборудование для сбора клеток, их разрушения, последующей очистки белкового продукта или метаболита, синтезированного микроорганизмами;
.
2. Микроорганизмы-прокариоты-продуценты витамина В12 (пропионовокислые бактерии и др.). Схема биосинтеза. Регуляция биосинтеза. Среды и условия для культивирования микроорганизмов-продуцентов. Регуляция биосинтеза.
Витамины представляют собой группу незаменимых органических соединений различной химической природы, необходимых любому организму в ничтожных концентрациях и выполняющих в нем каталитические и регуляторные функции. Недостаток того или иного витамина нарушает обмен веществ и нормальные процессы жизнедеятельности организма, приводя к развитию патологических состояний.
Известно, что многие микроорганизмы способны к синтезу целого ряда витаминов. Благодаря изучению физиологии и генетики микроорганизмов — продуцентов витаминов и выяснению путей биосинтеза каждого из них создана теоретическая основа для получения микробиологическим способом практически всех известных в настоящее время витаминов. Однако наиболее востребованными оказались разработки технологий промышленного микробиологического производства лишь особо сложных по строению витаминов: В2, В12, β-каротина (провитамин А) и предшественников витамина D. Остальные витамины либо выделяют из природных источников, либо синтезируют химическим путем.
Витамины - объекты международной торговли. Так, витамин В12 российского производства экспортируют в Польшу, Германию, Чехию, Словакию и другие страны. Витамины используются в качестве лечебных препаратов, для создания сбалансированных пищевых и кормовых рационов и для интенсификации биотехнологических процессов.
Получение витамина B12.
Витамин В открыт в 1948 г. одновременно в США и Англии. В 1972 г. в Гарвардском университете был осуществлен химический синтез корриноидного предшественника витамина В12. Химический синтез корнестерона - структурного элемента корринового кольца витамина, включающий 37 стадий, в крупных масштабах не воспроизведен из-за сложности процесса.-
Витамин В12 регулирует углеводный и липидный обмен, участвует в метаболизме незаменимых аминокислот, пуриновых и пиримидиновых оснований, стимулирует образование предшественников гемоглобина в костном мозге, применяется в медицине для лечения злокачественной анемии, лучевой болезни, заболеваний печени, полиневрита и т. п. Добавление витамина к кормам способствует более полноценному усвоению растительных белков и повышает продуктивность сельскохозяйственных животных на 10— 15%.
Первоначально витамин В12 получали исключительно из природного сырья, но из 1 т печени можно было выделить всего лишь 15 мг витамина. Единственный способ его получения в настоящее время - микробиологический синтез. Механизмы регуляции биосинтеза витамина B12 до настоящего времени полностью не расшифрованы. Известно, что при высоких концентрациях витамин полностью репрессирует синтез ключевых ферментов своего новообразования.
Продуцентами витамина В]2 при его промышленном получении служат актиномицеты, метанообразующие и фотосинтезирующие бактерии, одноклеточные водоросли. В 70-х гг. XX в. интерес ученых привлекли пропионово-кислые бактерии, было выделено 14 видов этих бактерий, продуцирующих витамин В12 (Л.И. Воробьевой дана физиолого-биохимическая характеристика этих бактерий).
Для получения высокоочищенных препаратов витамина В12 пропионовокислые бактерии культивируют периодическим способом на средах, содержащих глюкозу, казеиновый гидролизат, витамины, неорганические соли, хлорид кобальта. Так, выход витамина на среде с кукурузным экстрактом и глюкозой при поддержании стабильного значения рН близ нейтральных зон достигает 21-23 мг/л. Мутант пропионовокислых бактерий продуцирует до 30 мг/л витамина. Бактерии плохо переносят перемешивание. Применение уплотняющих агентов (агар, крахмал), предотвращающих оседание бактерий, а также использование высокоанаэробных условий и автоматического поддержания рН способствует наиболее высокому выходу витамина - 58 мг/л.
Из культуральной жидкости витамин В12 выделяют экстракцией органическими растворителями, ионообменной хроматографией с последующим осаждением из фракций в виде труднорастворимых соединений. В процессе получения витамина В,2 с помощью пропионовокислых бактерий применяют дорогостоящую антикоррозийную аппаратуру, сложные и дорогие питательные среды. Усовершенствование технологического процесса идет в направлении удешевления компонентов питательных сред (замена глюкозы сульфитными щелоками) и перехода с периодического культивирования на непрерывный процесс. В последние годы исследуется возможность получения витамина с использованием иммобилизованных клеток пропионовокислых бактерий.
Сотрудниками Института биохимии им. А.Н. Баха РАН разработана простая и дешевая технология получения витамина В12 при культивировании комплекса термофильных микроорганизмов, производящих метановое брожение (целлюлозо-разлагающие, углеводсбра-живающие, аммонифицирующие, сульфит-восстанавливающие и метанообра-зующие бактерии). Этот процесс промышленного получения витамина Bi2 -пример безотходной и экологически чистой технологии. Сырьем для ее реализации служат массовые отходы, а конечными продуктами - биогаз (65% метана, 30% диоксида углерода), используемый как топливо, и биомасса метановых бактерий - источник биологически активных соединений, активирующих, например, рост молочнокислых бактерий.
Цианкобаламин, или витамин В12— получают только микробиологическим синтезом. Его продуцентами являются прокариоты и, прежде всего, пропионовые бактерии, которые и в естественных условиях образуют этот витамин. Мутанты Propionibacterium shermanii М-82 и Pseudomonas denitrificans M-2436 продуцируют на жидкой среде до 58—59 мг/л цианкобаламина.
Учитывая важную функцию витамина в организме человека (он является противоанемическим фактором), его мировое производство достигло 10 т в год, из которых 6,5 т расходуют на медицинские нужды, а 3,5 т — в животноводстве.
Отечественное производство цианкобаламина базируется на использовании культуры P.freudenreichii var. shermanii, культивируемой в периодическом режиме без доступа кислорода. Ферментационная среда обычно содержит глюкозу, кукурузный экстракт, соли аммония и кобальта, рН около 7,0 поддерживают добавлением NH4OH; продолжительность ферментации 6 суток; через 3 суток в среду добавляют 5,6-диметилбензимидазол — предшественник витамина В12 и продолжают ферментацию еще 3 суток. Цианкобаламин накапливается в клетках бактерий, поэтому операции по выделению витамина заключаются в следующем:
сепарирование клеток, экстрагирование водой при рН 4,5—5,0 и температуре 85—90°С, в присутствии стабилизатора (0,25% раствор натрия нитрита). Экстракция протекает в течение часа, после чего водный раствор охлаждают, нейтрализуют раствором едкого натра, добавляют коагулянты белка — хлорид железа трехвалентного и алюминия сульфат с последующим фильтрованием. Фильтрат упаривают и дополнительно очищают, используя методы ионного обмена и хроматографии, после чего проводят кристаллизацию витамина при 3—4°С из водно-ацетонового раствора.
Кристаллический цианкобаламин можно получать с помощью резорцина или фенола, образующих с ним продукты, которые сравнительно легко разлагаются на составляющие компоненты.
При реализации данного биотехнологического процесса не забывать о высокой светочувствительности витамина В12, поэтому все операции необходимо проводить в затемненных условиях (или при красном свете).
На ацетонобутиловой и спиртовой бардах с добавлением солей кобальта и метанола в нашей стране получают кормовой препарат КМБ12 — концентрат, содержащий витамин В12 и другие ростовые вещества. Биообъектом здесь является смешанная культура метаногенных бактерий.
Иммобилизация за счёт образования ковалентных связей между ферментом и носителем.
Предварительная обработка культуральной жидкости направлена не только на то, чтобы провести коагуляцию белково-коллоидных примесей, но и улучшить структуру получаемого осадка. С этой целью обработку электролитами проводят таким образом, что смешивают два электролита, которые при своем взаимодействии непосредственно в культуральной жидкости образуют осадок, повышающий плотность твердой фазы, предотвращающий слипание частиц мицелия и способствующий образованию гранул. Мицелий приобретает комковатую структуру, и вместе с белково-коллоидными примесями образует при фильтрации сравнительно хорошо проницаемый слой.
Эффективность данного метода очень высока и он широко применяется в производстве.
Обработка культуральной жидкости полиэлектролитом
Полиэлектролиты (ПЭ) - высокомолекулярные органические соединения с большим содержанием ионогенных групп в структуре.
Первыми ПЭ были ВА-2 (поли-(4-винил-Н-бензил-тиметиламмоний хлорид), ПКБ-1; ПКБ-402 - линейные полиэлектролиты.
Возможности флокуляции культуральной жидкости антибиотиков значительно расширились с использованием разветвленных ПЭ. Наиболее перспективными из них являются дисперсные формы анионитов АВ-16, АВ-17, с размером частиц ОД -5 мкм.
Разветвленные ПЭ, в отличие от линейных, обладают большей поверхностью и поэтому кроме взаимодействия по функциональным группам могут на своей поверхности адсорбировать различные примеси, повышая качество нативного раствора.
Достоинства метода:
а) метод является «мягким», целевой продукт не подвергается инактивации;
б) значительно увеличивается скорость фильтрации;
в) процесс фильтрации сопровождается депигментацией нативного раствора, что ведет к повышению качества целевого продукта.
Недостатки метода: нестабильность при хранении.
На практике перед фильтрацией культуральной жидкости обычно используют сочетание нескольких из рассмотренных методов предварительной обработки. При этом достигается максимальный эффект.
Способ выделения антибиотика методом экстракции из культуральной жидкости и мицелия
Конечным продуктом стадии ферментации является культуральная жидкость (КЖ). Культуральные жидкости обычно являются сложными смесями большого числа компонентов, многие из которых обладают близкими физико-химическими свойствами. Наряду с растворенными минеральными солями, углеводами, белками и другими органическими веществами культуральные жидкости содержат в значительном количестве полидисперсные коллоидные частицы и взвеси. Следовательно, они являются не только многокомпонентными растворами, но и суспензиями. Дисперсная фаза этих суспензий состоит из мицелия или клеток микроорганизмов, а также из твердых частиц, содержащихся в большинстве питательных сред - муки, хлопьев из кукурузного экстракта и т.п.
Из всего сказанного можно дать определение. Культуральная жидкость - это жидкость, содержащая целевой продукт, либо в жидком виде (нативный раствор), либо в осадке (мицелий).
Характерной особенностью культуральной жидкости является сравнительно низкое содержание целевых продуктов. Например, содержание биомассы при производстве дрожжей составляет 5-10%, а при производстве бактериальных препаратов не превышает 1-2%.
Большинство целевых продуктов микробиологического синтеза являются нестабильными и подвержены влиянию различных факторов. Белки, например, исключительно чувствительны к нагреванию, изменению рН среды, ко многим физическим и химическим воздействиям.
При разработке технологии выделения целевых продуктов необходимо учитывать не только физико-химические свойства культуральной жидкости, низкую концентрацию целевого продукта в них и его лабильность, но и вид готовой товарной формы биопрепарата. Все товарные формы биопрепаратов с точки зрения технологии их получения можно разделить на три основные группы.
Первая группа - биопрепараты на основе инактивированной биомассы клеток и полупродуктов ее переработки (кормовые дрожжи, грибной мицелий и др.)
Вторая группа - биопрепараты на основе очищенных продуктов метаболизма микроорганизмов (витамины, аминокислоты, ферменты, антибиотики и др.).
Третья группа - биопрепараты на основе жизнеспособных микроорганизмов (средства зашиты растений, бактериальные удобрения, закваски для силосования кормов и др.).
Технология выделения продуктов на основе метаболитов строится в зависимости от того, находится целевой продукт в культуральной жидкости или внутри клеток микроорганизмов. В первом случае используются такие методы, как экстракция, ионный обмен, адсорбция, кристаллизация. Когда целевой продукт находится внутри клеток, используют либо метод экстракции, либо выделяют целевой продукт после дезинтеграции (разрушения) клеточной стенки.
Дата добавления: 2018-04-04; просмотров: 633; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
