Реакции, идущие без изменения степеней окисления химических элементов
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
Li2O+H2O=2LiOH;
- многие реакции разложения:
2Fe(OH)3
| t° |
| → |
Fe2O3+3H2O;
- реакции этерификации:
HCOOH+CH3OH⇄HCOOCH3+H2O.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердымиодом:
N2+O2=2NO–Q,
H2(г)+I2(т)=2HI–Q.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
4P+5O2=2P2O5+Q,
CH4+2O2=CO2+2H2O+Q.
Гидрирование этилена — пример экзотермической реакции:
CH2=CH2+H2
| Pt |
| → |
CH3−CH3+Q
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
CaCO3
| t° |
| → |
CaO+CO2↑−Q;
б) крекинг бутана:
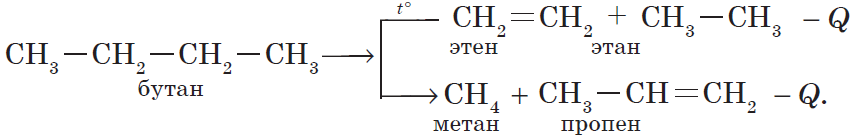
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
H2(г)+Cl2(г)=2HCl(г)+92.3кДж,
|
|
|
N2(г)+О2(г)=2NO(г)–90.4кДж.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
2Al(т)+3CuCl2(р−р)=3Cu(т)+2AlCl3(р−р),
СаС2(т)+2Н2О(ж)=С2Н2↑+Са(ОН)2(р−р).
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):

Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
2HgO
| t° |
| → |
2Hg+O2↑,
C2H4+3O2
| t° |
| → |
2CO2+2H2O.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
2KClO3
| MnO2,t° |
| → |
2KCl+3O2↑,
| C2H5OH |
| этанол |
| H2SO−4,t° |
| → |
| CH2=CH2 |
| этен |
↑+H2O
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более 70% химических производств используют катализаторы.
|
|
|
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только вод ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование - дегидрирование;
- гидратация - дегидратация;
- полимеризация - деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
·
·
·
·
·
·
Дата добавления: 2018-02-28; просмотров: 3963; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
