На электродах протекают реакции 4 страница
S0298 = 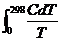 . (4.4)
. (4.4)
Зная стандартную энтропию, можно вычислить значение абсолютной энтропии данного вещества при любой температуре Т:
ST = S0298 + 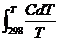 . (4.5)
. (4.5)
Таблицы стандартных значений энтропий играют существенную роль при расчетах констант химических реакционных равновесий и определении направления протекания химических реакций и других процессов.
Необходимо подчеркнуть, что третье начало термодинамики дает возможность вычислить абсолютное значение энтропии различного рода веществ при данном состоянии, тогда как для других термодинамических функций (U, H) могут быть определены только их изменения при переходе данной системы из одного состояния в другое.
Расчеты изменения энтропии в различных процессах
Методов непосредственного измерения энтропии не существует, но можно рассчитать изменение этой функции при различного рода процессах, пользуясь математическим выражением второго начала термодинамики для обратимых процессов. Так как энтропия является функцией состояния, то ее изменение при переходе системы из начального состояния в конечное будет одним и тем же независимо от того, совершается ли этот переход обратимым или необратимым путем.
1. Расчеты изменения энтропии при изотермических процессах
Примерами изотермических могут служить такие процессы, как плавление, испарение, возгонка, превращение одной полиморфной модификации в другую. При обратимом (равновесном) проведении этих процессов давление остается постоянным.
|
|
|
При изотермическом процессе, проводимом обратимо, изменение энтропии рассчитывается по следующей формуле:
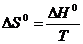 . (4.6)
. (4.6)
2. Расчет изменения энтропии в неизотермических процессах
Если процесс протекает не изотермически, то расчет изменения энтропии проводят, исходя из следующего:
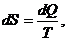 но
но  ,
,
тогда
 .
.
Для конечных изменений
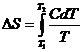
или
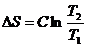 . (4.7)
. (4.7)
Уравнение (4.7) справедливо для тех случаев, когда теплоемкость в данном температурном интервале практически не зависит от температуры.
3. Расчет изменения энтропии сложного процесса
Изменение энтропии сложного процесса, состоящего из нескольких стадий, равняется сумме изменений энтропий каждой отдельной стадии этого процесса:
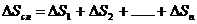 . (4.8)
. (4.8)
Например, изменение энтропии при обратимом превращении 10,0 г льда, находящегося при -10 °С, в пар при 120 °С, если
С(Н2О, ТВ) = 2,03 Дж г-1 К-1; DНпл. льда = 331,89 Дж г-1;
|
|
|
С(Н2О, Ж) = 4,18 Дж г-1 К-1; DНисп. Н2О = 2253,4 Дж г-1.
С(Н2О, Г) = 1,93 Дж г-1 К-1;
Вычисляют следующим образом.
Данный процесс представим из пяти стадий:
1. Нагревание льда от -10 °С до 0 °С, DS1.
2. Плавление льда, DS2.
3. Нагревание жидкой воды от 0°С до 100 °С, DS3.
4. Испарение воды, DS4.
5. Нагревание пара от 100 °С до 120 °С, DS5.
Изменение энтропии в 1, 3, 5 стадиях рассчитывают по уравнению
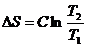 .
.
В стадиях 2, 4 – по уравнению 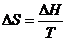 .
.
Общее изменение энтропии составит: 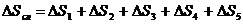 .
.
4.4. Расчет изменения энтропии
при протекании химического процесса
Изменение энтропии химического процесса равно алгебраической сумме стандартных энтропий участников реакции с учетом их стехиометрических коэффициентов, причем энтропии продуктов реакции берутся со знаком плюс, а энтропия исходных веществ – со знаком минус.
Для реакции, протекающей по уравнению aА + bB ® mM + nN
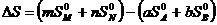 . (4.9)
. (4.9)
В общем виде:
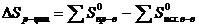 (4.10)
(4.10)
(с учетом стехиометрических коэффициентов).
Критерии направления протекания процессов и достижения равновесных состояний в открытых и закрытых системах. Понятие об энергии Гиббса
По изменению энтропии можно судить о направлении и пределах протекания процессов только в изолированных системах. В случае закрытых и открытых систем необходимо также учитывать изменение энтропии окружающей среды. Решение последней задачи сложно или невозможно. Поэтому в термодинамике для изучения открытых или закрытых систем используют другие термодинамические функции, так называемые термодинамические потенциалы, изменение которых позволяет определить направление процессов и пределы их протекания без учета изменений в окружающей среде. В частности, к термодинамическим потенциалам относится функция состояния, называемая энергией Гиббса, которую обозначают через G.
|
|
|
Понятие об энергии Гиббса было введено на основе объединенного уравнения первого и второго начал термодинамики. Это уравнение может быть выведено следующим образом. Из первого начала термодинамики следует:
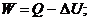
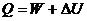 ; (4.11)
; (4.11)
из второго начала термодинамики для обратимого процесса получаем:
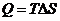 . (4.12)
. (4.12)
Для необратимого процесса:
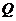 <
< 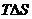 . (4.13)
. (4.13)
Подставляя значение 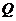 из уравнения (4.12) и уравнений (4.13) в (4.11), находим:
из уравнения (4.12) и уравнений (4.13) в (4.11), находим:
|
|
|
для обратимого процесса
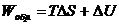 ; (4.14)
; (4.14)
для необратимого процесса
 <
< 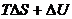 . (4.15)
. (4.15)
Уравнение (4.14) называют объединенным уравнением первого и второго начал термодинамики для обратимых процессов. Так как внутренняя энергия и энтропия являются функциями состояния, то их изменения не зависят от того, как протекает данный процесс, обратимо или необратимо, следовательно:
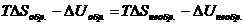 и
и 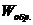 >
>  , (4.16)
, (4.16)
т.е. работа, совершаемая при обратимом процессе, больше работы, производимой системой при необратимом процессе при условии, что начальное и конечное состояния системы одинаковы в обоих случаях.
Имея в виду, что работа, производимая системой при обратимом процессе, является максимальной для данного изменения состояния системы, преобразуем уравнение (4.14):
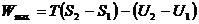 . (4.17)
. (4.17)
группируя величины с одинаковыми индексами, получим:
 , (4.18)
, (4.18)
так как 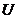 и
и  – функции состояния, то величина (
– функции состояния, то величина (  должна быть также функцией состояния.
должна быть также функцией состояния.
Если система кроме полезной работы совершает работу против силы внешнего давления (Р = const), то для обратимого процесса
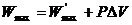 (4.19)
(4.19)
или
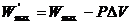 ,
,
где 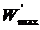 – максимальная полезная работа, совершаемая системой в обратимом изобарно-изотермическом процессе. Из уравнения (4.18) получаем для обратимого процесса:
– максимальная полезная работа, совершаемая системой в обратимом изобарно-изотермическом процессе. Из уравнения (4.18) получаем для обратимого процесса:
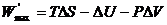 . (4.20)
. (4.20)
Для необратимого процесса
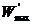 =
= 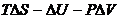 . (4.21)
. (4.21)
Учитывая, что
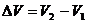 ,
,
получим
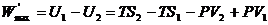 . (4.22)
. (4.22)
Группируя величины с одинаковыми индексами, находим:
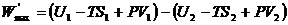 . (4.23)
. (4.23)
Величину ( 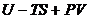 ), которая является функцией состояния, так как
), которая является функцией состояния, так как 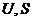 и
и  есть функции состояния, называют энергией Гиббса и обозначают G.
есть функции состояния, называют энергией Гиббса и обозначают G.
Раньше эту функцию состояния называли изобарно-изотермическим потенциалом.
Таким образом,
G = 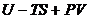 . (4.24)
. (4.24)
Имея в виду последнее уравнение, можно записать:
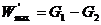 ,
,
или, так как 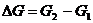 ;
;
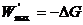 . (4.25)
. (4.25)
Из уравнения (4.25) следует, что максимальная полезная работа, совершаемая системой в обратимом изобарно-изотермическом процессе, равна уменьшению энергии Гиббса.
Для необратимого процесса путем аналогичного преобразования справедливо
 <
<  , (4.26)
, (4.26)
т.е. уменьшение энергии Гиббса в необратимом процессе больше производимой системой работы (полезной).
Зная, что
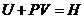 ,
,
уравнение (4.24) запишем следующим образом:
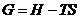 (4.27)
(4.27)
или
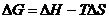 . (4.28)
. (4.28)
Последнее уравнение может быть представлено следующим образом:
 (4.29)
(4.29)
или
 . (4.30)
. (4.30)
Из этого следует, что изменение внутренней энергии системы можно представить как сумму трех слагаемых:
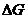 – часть внутренней энергии, способная при изобарно-изотермических условиях превращаться в работу;
– часть внутренней энергии, способная при изобарно-изотермических условиях превращаться в работу;
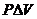 – часть внутренней энергии, затрачиваемая системой на совершение работы против сил внешнего давления;
– часть внутренней энергии, затрачиваемая системой на совершение работы против сил внешнего давления;
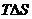 – связанная энергия, представляющая собой часть внутренней энергии, которая в указанных условиях не может быть превращена в работу.
– связанная энергия, представляющая собой часть внутренней энергии, которая в указанных условиях не может быть превращена в работу.
«Связанная энергия» тем больше, чем больше энтропия данной системы. Таким образом, энтропию можно рассматривать как меру «связанной энергии».
Определим изменение энергии Гиббса при протекании обратимого и необратимого процессов.
Для этого продифференцируем уравнение (4.27), помня при этом, что дифференциал произведения двух функций равен сумме производных, взятых в предположении, что в данных условиях изменяется только одна из функций, а другая остается постоянной.
В результате дифференцирования получим:
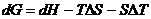 . (4.31)
. (4.31)
Из соотношений (4.13) и (4.15) следует:
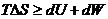 , (4.32)
, (4.32)
где знак равенства относится к обратимым, а знак неравенства – к необратимым процессам.
Предполагая, что никакой работы, кроме работы расширения, не производится, получаем:
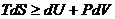 . (4.33)
. (4.33)
Подставляя найденное значение 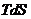 в уравнение (4.31) и зная, что
в уравнение (4.31) и зная, что 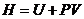 , следовательно
, следовательно  , имеем:
, имеем:
 . (4.34)
. (4.34)
Из уравнения (4.34) следует, что для обратимых процессов при постоянных Р и T и при условии, что из всех видов работы может производиться только работа расширения,
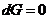 ,
,
так как
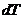 и
и 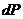 =0. (4.35)
=0. (4.35)
Поскольку обратимые процессы являются равновесными, т.е. такими, когда система в каждый момент времени находится в состоянии равновесия, то уравнение (4.35) является критерием равновесия.
Протекание необратимых процессов, к которым относятся все самопроизвольные процессы, сопровождается уменьшением энергии Гиббса (Р и Т постоянны), так как при этом
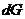 < 0. (4.36)
< 0. (4.36)
Поэтому неравенство (4.36) является критерием направления самопроизвольных процессов.
Из неравенства (4.36) следует, что при переходе системы из неравновесного состояния в равновесное G уменьшается и в момент равновесия достигает минимального значения:
Gравн. = Gmin. (4.37)
Уравнение (4.37) представляет собой второй критерий достижения равновесия в открытых и закрытых системах.
4. Особенности термодинамического описания процессов в закрытых и открытых системах. Клетка как пример открытой системы. Энергия Гиббса; энергия Гельмгольца. Взаимосвязи между внутренней энергией, работой и "связанной энергией" в изобарно-изотермическом процессе. Энергия Гиббса; энергия Гельмгольца. Взаимосвязи между внутренней энергией, работой и "связанной энергией" в изобарно-изотермическом процессе.
Понятие о химическом потенциале
Химическую реакцию можно рассматривать с точки зрения изменения в системе количеств продуктов реакции и исходных веществ.
Изменение энергии системы с увеличением числа молей данного вещества на единицу времени при неизменных прочих параметрах системы можно рассмотреть на следующей простой модели.
В сосуде при постоянном давлении и температуре находятся три газа: азот n(N2), кислород n(О2) и водород n(H2) в одинаковых количествах:
n(N2) = n(O2) = n(H2).
Из сосуда можно вывести или (ввести) один моль какого-либо газа, например кислорода. Очевидно, для этого нужно затратить энергию:
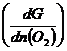 при Р и Т, n(N2) и n(H2) = const. (5.1)
при Р и Т, n(N2) и n(H2) = const. (5.1)
Изменение энергии Гиббса системы в этом случае может быть записано как:
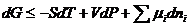 , (5.2)
, (5.2)
где mi – коэффициент пропорциональности между изменением энергии и количества i-го компонента.
Определим изменение энергии Гиббса системы от изменения давления. Учтем, что 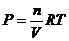 , поэтому это фактически равнозначно изменению энергии Гиббса, связанному с изменением концентрации вещества в системе:
, поэтому это фактически равнозначно изменению энергии Гиббса, связанному с изменением концентрации вещества в системе:
 . (5.3)
. (5.3)
Дата добавления: 2018-02-28; просмотров: 389; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
