В основу этой теории положено два учения: молекулярно-кинетическая теория и теория Больцмана
Вывод уравнения ТАС.
z– общее число столкновений в единицу времени.
z= 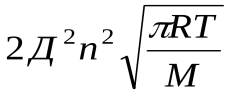
Д – эффективный диаметр молекул;
n– число молекул в единице объема;
M– молекулярная масса.
С помощью закона Больцманаопределяем количество активных столкновенийz  , т.е. таких, в которых энергия превышает энергию активации:
, т.е. таких, в которых энергия превышает энергию активации:
z 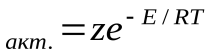
Тогда доля активных столкновений составит:
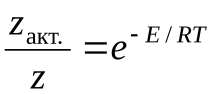
Рассмотрим бимолекулярную газовую реакцию типа: 2А 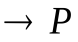 , где Р – продукты реакции. Например, это может быть разложение йодистого водорода:
, где Р – продукты реакции. Например, это может быть разложение йодистого водорода:
2HJ 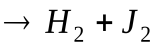
Теперь заметим, что в результате каждого активного столкновения расходуется две молекулы исходного вещества. Поэтому количество прореагировавших молекул в единице объема будет равна удвоенному количеству активных столкновений в то же время и в том же объеме:
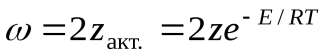 или
или
 (
( 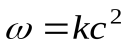 )
)
Отсюда видно, что скорость реакции зависит от квадрата концентрации.
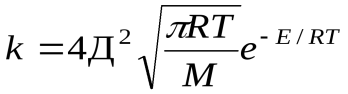
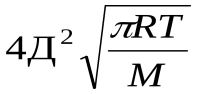 =k
=k 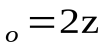
k=k 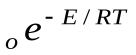 уравнение Аррениуса
уравнение Аррениуса
Сравнение этих уравнений позволяет установить физический смысл предэкспоненциального множителя k 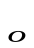 , который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема за единицу времени.
, который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема за единицу времени.
В общем виде уравнение Аррениуса для всех типов реакций часто пишут в виде:
k=z 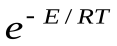 уравнение Аррениуса
уравнение Аррениуса
Константа, рассчитанная по этому уравнению, не дает совпадения с экспериментальными данными. Для корректировки в это уравнение вводят стерический фактор р.
Тогда уравнение Аррениуса с точки зрения ТАС запишется следующим образом:
|
|
|
k=pz 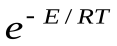
Считается, что стерический фактор отличается от единицы потому, что для осуществления реакции необходима определенная ориентация реагирующих молекул.
В этом уравнении Е – энергия активации, рассчитанная по ТАС, абсолютная (истинная) энергия активации, а экспериментальная – эффективная энергия активации.
Е 
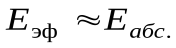
Факты, которые не объясняет ТАС:
1. Не дает метода теоретического расчета энергии активации.
2. Не объясняет протекания в растворах.
3. Не объясняет природы стерического фактора
Теория активного комплекса.
Основным представлением ТАК является положение о том, что всякая химическая реакция протекает через образование некоторого переходного состояния, которое затем распадается на продукты данной реакции.
Основные положения теории:
1. В ходе процесса молекулы постепенно приближаются друг к другу, в результате чего меняются межъядерные расстояния.
2. В ходе реакции образуется активированный комплекс, когда один из атомов становится как бы обобществленным, и межъядерное расстояние становится одинаковым.
3. Активированный комплекс превращается в продукты реакции.
Например, реакцию разложения йодоводорода можно представить следующим образом:
|
|
|

Сначала две молекулы HJ расположены достаточно далеко друг от друга. При этом существует взаимодействие лишь между атомами в молекуле. После сближения на достаточно короткое расстояние начинают возникать связи между атомами, входящими в состав разных молекул, и связи H–J становятся более слабыми. В дальнейшем они ещё более ослабевают и полностью разрываются, а новые связи H–H и J–J, наоборот, упрочняются. В результате происходит перегруппировка атомов и вместо исходных молекул НJ образуются молекулы Н2 и J2. В процессе сближения и перегруппировки атомов молекулы образуют некоторый малоустойчивый активированный комплекс из двух молекул водорода и двух молекул йода; комплекс существует очень недолго и в дальнейшем распадается на молекулы продуктов. На его образование необходима затрата энергии, равная энергии активации.
Представление об активированном комплексе и об энергии активации подтверждается с помощью энергетических диаграмм, построение которых используется в ТАК.
Активированный комплекс всегда имеет избыток энергии по сравнению с энергией реагирующих частиц.
А–В+D 
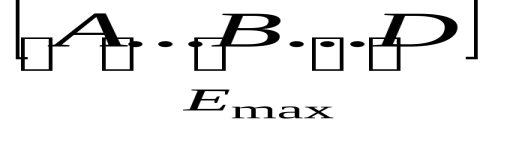 →A+B–D
→A+B–D
переходное состояние
|
|
|
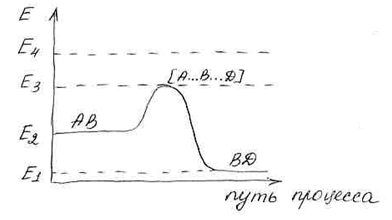
Е1– энергия связи BD без А.
Е2– энергия связи АB без D.
Е3– энергия связи переходного состояния.
Е4– энергия свободных атомов.
Е3– Е2 = Е активации прямой реакции.
Е2– Е1 = ∆Н тепловой эффект реакции.
Е4– Е2 – энергия разрыва связи АВ.
Е4– Е1 – энергия разрыва связи ВD.
Так как энергия разрыва связей Е4 >> Е активации, то реакция протекает с образованием активированного комплекса без предварительного разрыва связей.
Дата добавления: 2018-02-28; просмотров: 454; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
