Кондуктометрия. (Отсканируй лабу )
Кондуктометрическое титрование.
Метод титрования, при котором точку эквивалентности фиксируют по резкому изменению электропроводности исследуемого раствора, называют кондуктометрическим.
Электропроводность раствора зависит от природы электролита, его концентрации в растворе, природы растворителя и концентрации. Поскольку удельная электропроводность разбавленных растворов пропорциональна концентрации электролита, можно, измеряя электропроводность, определить концентрацию.
Практическое применение этого метода ограничено тем, что электропроводность раствора определяется суммарной концентрацией всех ионов, находящихся в растворе.
Кондуктометрическое титрование имеет большое значение при анализе окрашенных и мутных растворов. Условием применимости этого метода является существенное изменение электропроводности в момент достижения точки эквивалентности. При титровании анализируемого вещества стандартным раствором титранта в случае образования нерастворимого или малодиссоциированного соединения электропроводность раствора снижается вследствие уменьшения количества ионов в растворе. Наименьшее количество ионов, а значит и наименьшая электропроводность раствора будут в точке эквивалентности. После достижения этой точки электропроводность снова начнет возрастать вследствие избытка титранта-электролита.График титрования электропроводность - объем титранта обычно имеет вид ломаной линии, где точки перегиба (излома) соответствуют точкам эквивалентности. Форма кривой титрования зависит от природы реагирующих и образующихся веществ. 
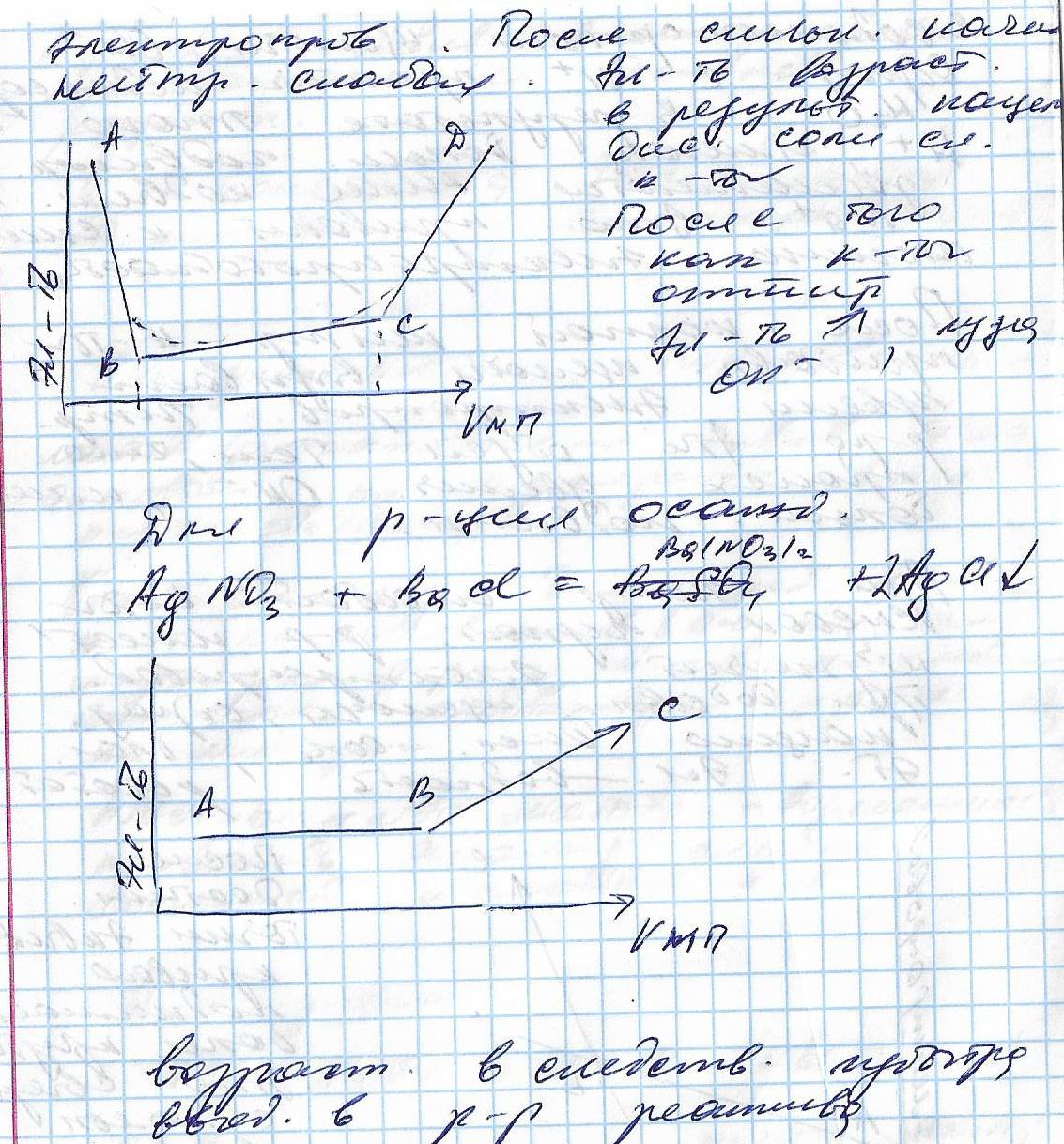
|
|
|
Механизм возникновения электродных потенциалов. Двойной электрический слой.
На границе раздела фаз протекает электродный процесс–реакция между компонентами фаз, в результате которой происходит переход электрических зарядов из одной фазы в другую. Каждая фаза при этом приобретает электрический заряд, и на границе их раздела образуется двойной электрический слой(ДЭС), которому соответствует скачок потенциала.










Обратимые и необратимые электрохимические элементы. Уравнение Нернста для электродного потенциала и электрохимической цепи.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Вывод уравнения Нернста
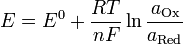 , где
, где
E — электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
n — число моль электронов, участвующих в процессе;
 и
и 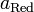 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
|
|
|
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при 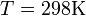 получим
получим
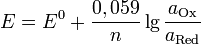
Уравнение Нернста.Значение электродного потенциала, возникающего на границе металл - раствор, зависит от природы металла, активности его ионов в растворе и от температуры. Влияние всех перечисленных факторов на величину электродного потенциала металла выражается уравнением Нернста:
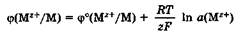
где φ° - стандартный электродный потенциал; R - универсальная газовая постоянная, 8,31 Дж/(моль • К); Т - температура, К; z - заряд потен-циалопределяющих ионов металла; F - число Фарадея, 96 500 Кл/моль; а(Мz+) - активность потенциалопределяющих ионов металла в растворе, моль/л.
Дата добавления: 2018-02-28; просмотров: 741; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
