Химическое равновесие в гетерогенных реакциях
Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями.
При равенстве скоростей прямой и обратной реакции наступает химическое равновесие в гетерогенной системе. Примерами гетерогенных процессов является пароводяная конверсия углерода, или восстановление оксидов металлов водородом:
С(к) + 2Н2О = СО2 + 2Н2 ,
МеО(к) + Н2 = Ме(к) + Н2 О.
Как и для любого равновесия, условием гетерогенного химического равновесия является равенство энергии Гиббса нулю, ΔG = 0.
Константа равновесия гетерогенной реакции
Как и в случае гомогенной химической реакции, константа гетерогенного равновесия равна отношению произведения равновесных концентраций (активностей) или парциальных давлений продуктов реакций к произведению равновесных концентраций (активностей) или парциальных давлений исходных веществ в степенях, равных стехиометрическим коэффициентам в уравнении. Для реакции пароводяной конверсии углерода константа равновесия имеет вид:
Кр = (рСО2)р (рН2)2р/(рН2О)2р,
для восстановления металла
Кр = (рН2O)р/(рН2)р.
Из приведенных выражений следует, что в уравнения констант гетерогенного химического равновесия не входят концентрации твердых веществ, участвующих в прямой и обратной реакциях.Это особенность гетерогенного химического равновесия.
Так как прямая и обратная реакции протекают на одной и той же поверхности раздела фаз, то площадь поверхности раздела фаз также не входит в уравнение константы химического равновесия.
|
|
|
Смещение равновесия гетерогенных реакций подчиняется принципу ЛеШателье.
Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия.
???25. Понятие раствора, фазы, компонента. Понятие о химическом потенциале.
Растворы – это гомогенные многокомпонентные системы , не имеющие строго определенного состава. В них нет отдельных различных фаз и нет границ раздела . Если один из компонентов раствора находится в большем количестве, чем другие, то его называют растворителем. Другие компоненты в этом случае называют растворенными веществами. Растворителем считают также то вещество, агрегатное состояние которого при образовании раствора не изменяется. В зависимости от агрегатного состояния растворителя растворы бывают жидкими, газообразными и твердыми.
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.
Компонент– химически индивидуальные вещества, наименьшего числа которых достаточно для образования всех фаз, т. е. гомогенных частей данной системы.
|
|
|
Выражения I закона термодинамики справедливы при условии неизменности количеств составляющих систему веществ. Количество взаимодействующих веществ и продуктов реакции определяется числом моль 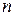 . В результате физико-химических процессов, связанных с изменением количеств участвующих в процессе веществ (химических реакции, фазовых переходов), изменяются всœе характеристические функции.
. В результате физико-химических процессов, связанных с изменением количеств участвующих в процессе веществ (химических реакции, фазовых переходов), изменяются всœе характеристические функции.
Для 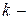 компонентной системы, с учетом изменения числа моль компонентов, участвующих в физико-химическом процессе, уравнение (83) для изменения энергии Гиббса примет вид:
компонентной системы, с учетом изменения числа моль компонентов, участвующих в физико-химическом процессе, уравнение (83) для изменения энергии Гиббса примет вид:
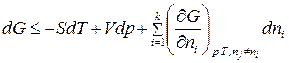 . (86)
. (86)
В (86) знак ʼʼнеравенстваʼʼ относится к самопроизвольному процессу, а знак ʼʼравенстваʼʼ – к равновесному. Частная производная от энергии Гиббса (или любой другой из характеристических функций ( 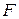 ,
,  ,
,  )) по изменению числа моль одного из компонентов при неизменности чисел моль остальных компонентов и соответствующих параметров состояния - ϶ᴛᴏ химический потенциал
)) по изменению числа моль одного из компонентов при неизменности чисел моль остальных компонентов и соответствующих параметров состояния - ϶ᴛᴏ химический потенциал  го компонента
го компонента 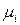 .
.
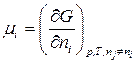 . (87)
. (87)
С учетом (87) получим:
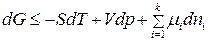 . (88)
. (88)
Химический потенциал можно выразить через частные производные и других термодинамических потенциалов
 (89)
(89)
и аналогично уравнению (86) выразить энергию Гельмгольца  ,
, 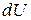 ,
, 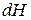 .
.
|
|
|
Химический потенциал размерная величина – 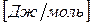 .
.
Химический потенциал имеет физический смысл парциальной мольной работы при изменении числа моль данного компонента на единицу при постоянных внешних параметрах и числах моль всœех других компонентов, составляющих раствор.
Для изобарно-изотермических условий, когда 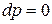 и
и 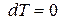 , из (88) при равновесии имеем:
, из (88) при равновесии имеем:
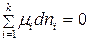 . (90)
. (90)
Для однокомпонентной системы из (87), получим:
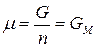 , (91)
, (91)
где 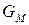 – мольная энергия Гиббса компонента (индивидуального вещества) или мольный термодинамический потенциал.
– мольная энергия Гиббса компонента (индивидуального вещества) или мольный термодинамический потенциал.
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, химический потенциал индивидуального компонента тождественен мольной энергии Гиббса.
Дата добавления: 2018-02-28; просмотров: 1435; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
